不同体重指数对年龄小于35岁多囊卵巢综合征患者IVF/ICSI-ET助孕结局的影响
2022-09-06张艳劳凯雪李易倩王雁林
张艳 劳凯雪 李易倩 王雁林
多囊卵巢综合征(Polycystic ovarian syndrome,PCOS)在我国19~45 岁年龄段女性人群中患病率为5.6%[1],是一种常见内分泌疾病,主要临床特征为月经不规律、高雄激素血症及相关表现、排卵障碍性不孕等,通常伴有肥胖、代偿性高胰岛素血症、胰岛素抵抗(Insulin resistance,IR)等代谢异常[2],该疾病在不孕人群中占20%~30%,其中约70%为排卵障碍性不孕。PCOS 患者中肥胖患者占50%~70%,其作为独立危险因素增加了患者一系列内分泌代谢问题,进一步影响妊娠结局。我院生殖中心的超重及肥胖PCOS 患者呈逐年上升趋势且年轻化明显。针对多囊卵巢疾病本身特点,在行体外受精-胚胎移植(IVF/ICSI-ET)辅助生殖技术过程中发现拮抗剂方案的使用有助于降低卵巢过度刺激综合征(Ovarian hyperstimulate syndrome,OHSS)的发生率,因此提出PCOS 患者首选拮抗剂方案行促排卵治疗。为进一步明确PCOS 患者行IVF/ICSI-ET 的促排卵效果、妊娠结局等与BMI 之间的关系,本研究将近5年于我院行拮抗剂方案且年龄<35 岁女性以BMI 分组,分析各指标间的相关性,为PCOS患者就诊提供有效诊疗意见。
1 材料与方法
1.1 一般资料回顾性分析2015年10月~2020年10月于我院生殖中心行IVF/ICSI-ET 的210 例PCOS 不孕症患者,根据体重指数分组:正常组(BMI<24kg/m2)62 例、超重组(24kg/m2≤BMI<28kg/m2)71例、肥胖组(BMI ≥28kg/m2)77 例。纳入标准:①年龄<35 岁;②诊断符合2003年鹿特丹PCOS 诊疗标准。排除标准:①夫妻任一方染色体异常者;②子宫及双附件手术史者;③既往有免疫性疾病反复流产史者。
1.2 研究方法所有患者进周期前完善体重、身高等一般检查,月经2~4 天行血清基础性激素检验,经阴道超声检测双侧卵巢基础卵泡数及有无优势卵泡,若无异常,当日开始给予促性腺激素(Gonadotropins,Gn)启动方案,当优势卵泡直径为14~15mm 或者满足优势卵泡直径>12mm 且血清雌二醇(E2)>1 101 pmol/L 时开始使用促性腺激素释放激素激动剂(GnRH-A)。当至少2 个卵泡直径>17mm 时,注射重组人绒促性素(rhCG)6 500IU 扳机,36h 后超声引导下取卵。根据精液质量不同给予相应的IVF/ICSI 人工受精。受精后的Ⅰ、Ⅱ级胚胎划为优质胚胎;胚胎继续培养,符合第4~6 期的AA、AB、BA、BB 囊胚划为优质囊胚。根据患者自身状态及意愿选择鲜胚移植或冻融胚胎移植,移植2 周后测血绒毛膜促性腺激素(HCG)水平,若数值偏低(>25U/L)或仅提示阳性时判断为生化妊娠;移植4 周后行阴超检查,见宫内或宫外孕囊及胎心搏动判断为临床妊娠。
1.3 观察指标①一般临床特征:不孕时间、年龄、促卵泡生成素(FSH)、促黄体生成素(LH)、E2、双侧卵巢基础卵泡数等;②实验指标:Gn 使用量、Gn 使用天数、取卵数、2PN 数、优质囊胚数、受精率、优质胚胎数及第1 周期临床妊娠率等相关数据。
1.4 统计学方法采用SPSS 22.0 统计学软件进行数据分析,符合正态分布的资料使用均数±标准差(±s)表示,偏态分布的资料使用中位数及四分位数间距[M(P25,P75)]表示,组间比较采用非参数H检验,两组间比较采用t检验;正态分布数据采用Pearson 相关性分析,偏态分布数据采用Spearman相关性分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 三组患者一般临床特征比较三组患者的年龄、不孕时间、血清FSH 水平、LH 水平、双侧卵巢基础卵泡数比较差异无统计学意义(P>0.05),血清E2水平比较差异有统计学意义(P<0.05),见表1。
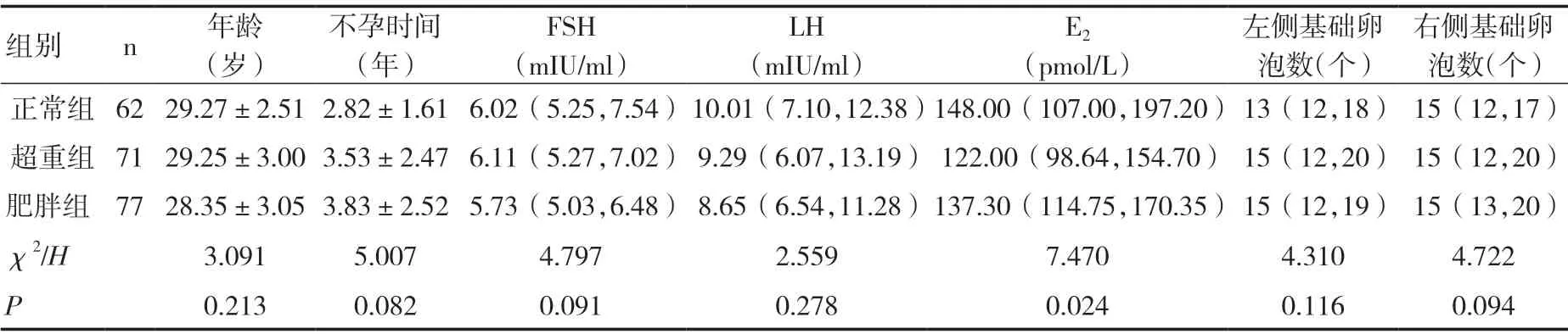
表1 三组患者一般临床特征比较
2.2 三组患者拮抗剂方案促排卵效果比较三组患者的Gn 使用量、Gn 使用天数、获卵总数、2PN 数、优质胚胎数、优质囊胚数、优质囊胚率及临床妊娠率比较差异有统计学意义(P<0.05),三组患者的受精率和优质胚胎率比较差异无统计学意义(P>0.05),见表2。
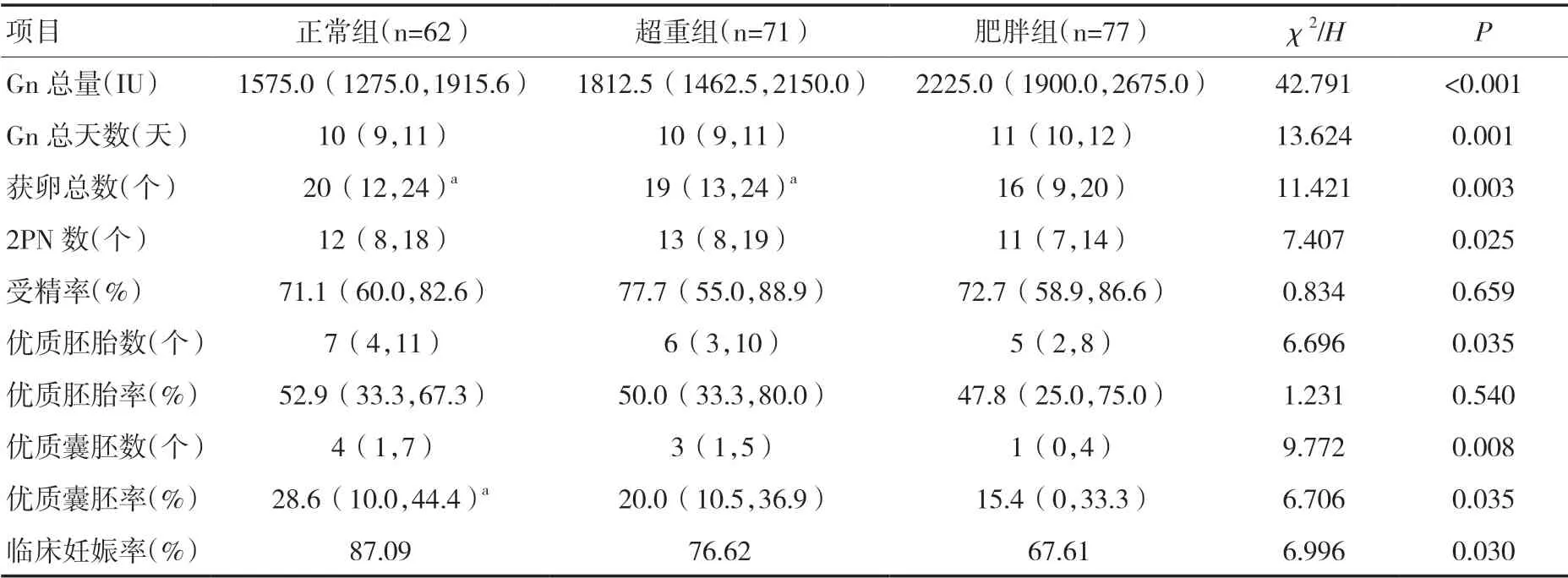
表2 三组患者拮抗剂方案促排卵效果比较
2.3 BMI 与促排卵效果的相关性BMI 与获卵总数(r=-0.168,P=0.015)、优质囊胚率(r=-0.200,P=0.004)、临床妊娠率(r=-0.153,P=0.027)呈负相关。
3 讨论
3.1 BMI 影响卵巢反应性、获卵数分析三组患者基础临床特征,左、右两侧卵巢基础卵泡数无显著性差异(P>0.05),在Gn 使用量及使用时间上肥胖组较正常组患者明显增高,差异具有统计学意义(P<0.05),而双侧卵巢总获卵数中肥胖组明显少于正常组(P<0.05)。这与大多数临床文献报道结果一致。因患者自身卵巢储备功能的不同,Gn 受体表达量存在差异[3],肥胖作为独立危险因素损害了卵巢对Gn 刺激的反应性[4],并根据该实验数据分析,PCOS 患者体内Gn 受体表达量减少且与BMI 呈负相关,其颗粒细胞对促性腺激素的反应性降低;另一方面可能因为超重及肥胖患者需要满足一定的药代动力学而增加Gn 用量及天数。Jungheim 等[5]的动物实验显示肥胖小鼠与正常小鼠相比,排卵率降低,卵泡凋亡率增高,且不成熟卵泡和小卵泡比例增高。有研究显示肥胖患者的获卵数、受精率、卵裂率、优质胚胎数以及冻存胚胎数较正常体重者均明显降低[6],在本研究中三组患者双侧卵巢基础卵泡数差异无统计学意义(P>0.05),但肥胖患者获卵总数明显低于正常体重者,与目前研究结果一致。
3.2 BMI 影响胚胎质量、妊娠率三组患者受精率及优质胚胎率未见明显差异(P>0.05),优质囊胚的形成率差异具有统计学意义(P<0.05)。分析肥胖PCOS 患者胰岛素抵抗(IR)可能影响卵母细胞和颗粒细胞的能量摄入,另外肥胖患者血液和卵泡液中存在多种炎症相关因子,对卵母细胞、胚胎发育有显著影响[7]。既往有研究表示BMI 对妊娠结局无影响[8],也有研究提示,BMI 高于正常范围在卵母细胞和胚胎着床、临床妊娠方面对患有PCOS 的女性起到负面影响[9,10]。Kasum 等[4]认为肥胖是子宫内膜蜕膜化的危险因素,影响胚胎着床发育。一项荟萃分析[11]显示BMI ≥30kg/m2的女性行IVF 助孕后妊娠及活产的概率较正常BMI 者显著降低,当合并PCOS 时,影响则更为显著。本研究中三组患者临床妊娠率存在明显差异(P<0.05),肥胖组患者妊娠率明显低于正常组。
3.3 BMI 与PCOS 疾病的相关性PCOS 是一种常见的生殖内分泌疾病,肥胖虽不作为诊断PCOS 的标准,但其是PCOS 加重的主要原因之一。Patel 等[12]认为PCOS 属于一种低度慢性状态的炎症,超重及肥胖患者体内脂肪组织的氧化应激水平高,可激活各种炎症信号通路,促进脂肪细胞内炎症因子的表达升高,使PCOS 患者慢性炎症状态加重[13]。肥胖诱导的炎症和氧化应激同时促进了IR 的发生发展,导致患者更容易发生IR[14~16],引发PCOS 患者的代谢功能异常,代偿性高水平胰岛素又进一步加重了体内脂肪的异常分布,如此形成一种恶性循环。Pirotta 等[17]认为IR 是引起不孕的主要原因,其影响卵母细胞的成熟发育。本研究对210 例患者的BMI 与促排卵结果行相关性分析,发现BMI 与获卵总数、临床妊娠率、优质囊胚率呈负相关(P<0.05),说明随BMI 升高,获卵数、妊娠率、优质囊胚率呈下降趋势。Best 等[18]研究指出通过改善饮食、运动控制体重能改善排卵情况、提高妊娠率。因此PCOS患者有意识的进行体重控制,对缓解疾病进展、体内代谢功能的正常运作及备孕起到至关重要的作用。
综上所述,本研究证明了BMI 影响PCOS 患者生育能力,肥胖作为独立危险因素对PCOS 患者在IVF/ICSI-ET 中行拮抗剂方案促排卵助孕时的获卵总数、胚胎质量及妊娠率都有负面影响。这其中可能涉及了一系列不同的机制如患者自身状态、卵母细胞质量、内分泌因素等,在妊娠前优化生活方式和体重对拟行IVF/ICSI-ET 拮抗剂方案助孕的PCOS 患者至关重要。
