RNA-seq用于获得共轭亚油酸对贵妃鸡肌内脂肪代谢调控的关键基因
2022-09-06张俊珍李亚莉常强强陈亚萍黄昀巍
张俊珍, 李亚莉, 张 蒙, 常强强, 陈亚萍, 黄昀巍
(山西农业大学动物科学学院,山西 太谷 030801)
贵妃鸡是一种肉蛋兼用型家禽,主要分布于法国、英国和荷兰等欧洲国家。近年来,贵妃鸡作为我国一种新的肉鸡品种,它具有胸肌发达、体型娇小、结构紧凑、骨骼细而坚硬、皮薄和皮下脂肪少等特点[1]。肌内脂肪沉积(intramuscular fat, IMF)量会影响肌肉的品质及风味[2]。鸡IMF依赖于脂类合成、转运、摄取和代谢的平衡,涉及到许多基因的表达和信号通路。IMF作为提高肉品质的重要因素,其调控机制是近年来肉鸡领域的研究热点[3]。
共轭亚油酸(conjugated linoleic acids, CLA)是亚油酸的同分异构体,是一种多不饱和脂肪酸。研究最多的2种CLA异构体是c9, t11-CLA和t10, c12-CLA[4]。据研究表明,CLA具有广泛的生物学功能,例如CLA具有改善糖尿病、增强免疫力、抗癌、减少机体脂肪沉积和增加肌内脂肪,从而提高肉品质,改善肉的风味等作用[5~6]。Zhong等[7]研究发现,在肥育猪的基础日粮中添加12.5和25 g CLA/kg可增加肌肉内脂肪含量,显著影响与能量代谢、脂肪酸氧化与合成和氨基酸代谢等相关的蛋白质含量。Wang等[8]在猪基础日粮中添加1.5% CLA,通过转录物组测序发现,283个已知的miRNAs,14个差异表达的miRNAs参与了Wnt信号通路,PPARγ、C/EBPα、FAS和FATP1在皮下和腹部脂肪组织中表达显著下调。张广民[9]研究发现,在AA肉鸡日粮中添加t-10,c-12 CLA可降低腹脂率,增加IMF的含量可能与血清瘦蛋白(leptin)浓度、脂肪型脂肪酸结合蛋白(A-FABP)、心型脂肪酸结合蛋白(H-FABP)mRNA表达以及肌肉和腹脂中苹果酸脱氢酶(MDH)活性不同有关。Ramiah等[10]采用荧光定量PCR检测发现,在基础日粮中添加5% CLA可以降低肉鸡腹脂中的PPAR和脂肪细胞蛋白(ap2)基因的表达,导致脂肪细胞变小。Wang等[4]采用荧光定量发现,基础日粮中添加CLA可能通过上调肝中HMGR和CYP7A1表达,减少蛋鸡肝和鸡蛋中脂肪和胆固醇等脂质的积累。Fu等[11]在种鸡的饲料中添加CLA发现,CLA可以降低子代雏鸡的脂肪酸生物合成相关基因(FAS、ACC和甾醇调节元件结合蛋白-1c)的mRNA表达,同时能诱导与β-氧化相关基因(CPT1、AMP活化蛋白质激酶)的表达。
目前,研究者采用转录物组技术研究CLA对家禽肌内脂肪代谢相关的报道较少,对贵妃鸡肌内脂肪代谢的研究未有报道。本研究以贵妃鸡为研究对象,在基础日粮中添加CLA,筛选对脂肪代谢相关差异表达基因,揭示CLA调控肌内脂肪代谢的分子机制,为CLA对家禽脂肪代谢的影响提供理论依据。
1 材料与方法
1.1 动物与样本采集
本试验选取山西省养殖技术试验基地108只55日龄体重接近且健康的贵妃鸡公鸡为试验动物,随机分为3组,每组3个重复,每个重复12只,在基础日粮中添加CLA(购买于青岛澳海生物有限公司潍坊分公司,纯度为80.6%)0%、1%和2%,对照组添加2%豆油。试验组分别在基础日粮中以等量的CLA替换豆油,预饲期1周,正饲期6周。饲养结束,每组随机选取6只,采用颈静脉放血法处死。屠宰前禁食12 h,采集胸肌组织,立即放入液氮中备用。
1.2 RNA的提取与cDNA文库构建和测序
严格按照Trizol试剂盒(南京建成生物公司)说明书,对贵妃鸡胸肌组织样本进行RNA提取。采用Agilent 2 100生物分析仪,检测RNA样品的纯度、浓度和完整性,以保障使用合格的样品进行转录物组测序。再进行cDNA文库的构建。文库构建完成,使用PCR方法对cDNA文库的有效浓度(文库有效浓度>2 nmol/L)进行准确定量,以保证文库质量。由北京百迈客生物科技有限公司提供测序服务,使用 Illumina NovaSeq 6000 进行文库的测序。
1.3 测序数据处理
将得到的原始数据(Raw Data)进行过滤,即去掉测序接头序列、重复冗余序列和低质量序列,获得高质量测序数据(Clean Data),再用HISAT2[12](2.0.4,参数-dta-p 6-max-intronlen 5000000)比对系统与指定的参考基因组(GRCg6a)进行序列比对,得到Mapped Data。使用StringTie软件(1.3.4b,参数-p 6-merge -F 0.1 -T 0.1 -i -eB -p 6)与原有的基因组注释进行比较,挖掘新基因。
1.4 差异表达基因(DEGs)的筛选
使用RSEM软件[13](v1.2.19)计算基因的表达量,差异表达基因的表达量以FPKM(fragments per kilobase of exon per million reads mapped)为单位。使用DESeq2软件[14](1.6.3)对测序获得的Clean Data进行差异表达基因的分析,每组样本有3个生物学重复,在差异表达基因检测过程中,将差异倍数(fold change)≥1.5且差异显著性P值(Pvalue < 0.05)作为筛选标准。
1.5 差异表达基因的GO功能富集和KEGG的通路分析
使用DIAMOND软件[15](2.0.4)将发掘的差异表达基因与GO(gene ontology)数据库和KEGG(kyoto encyclopedia of genes and genomes)数据库进行比对分析,获得差异表达基因的GO功能注释和KEGG的通路富集,P<0.05为差异显著。
1.6 q-PCR验证
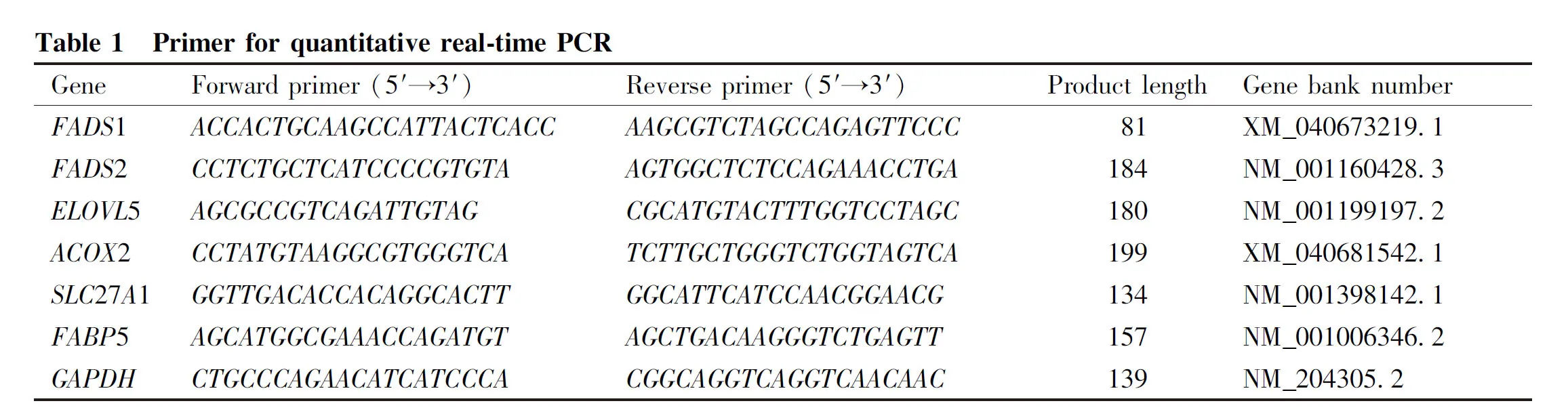
为验证转录物组测序的结果,从筛选出与脂肪代谢相关的候选基因中随机选取6个基因,通过SYBR®PremixExTaqTMⅡ试剂盒(Code:DRR820A)进行qPCR验证。用Oligo 7软件设计引物,交由华大基因合成(Table 1)。反应总体系10 μL:TB GreenPremixExTaqⅡ 5.0 μL,上下游引物各0.4 μL,cDNA 1.0 μL,ddH2O 3.2 μL。扩增条件为:预变性95 ℃ 30 s;(变性95 ℃ 5 s、退火57 ℃ 30 s、延伸72 ℃ 10 s)×44循环;熔解过程(95 ℃ 60 s、55 ℃ 30 s、95 ℃ 30 s)。内参基因GAPDH与目的基因的样本要在同样的条件下进行qPCR,通过2-△△CT法计算目的基因的相对表达量。
2 结果
2.1 转录物组测序数据质量检测和比对结果
对转录物组原始数据进行处理,得到有效数据、GC、Q20、Q30含量(Table 2)。结果显示,GC含量都在53%左右,Q20均在98%以上,Q30均在94%以上。从比对测序结果统计显示(Table 3),各样品的Reads与参考基因组的比对效率在83.26% ~ 87.66%之间,比对到唯一位置的比对率在78.50% ~ 83.32%,比对到多个位置比对率占3.72% ~ 4.76%。结果表明,转录物组测序得到的数据可靠,可用于后续结果分析。
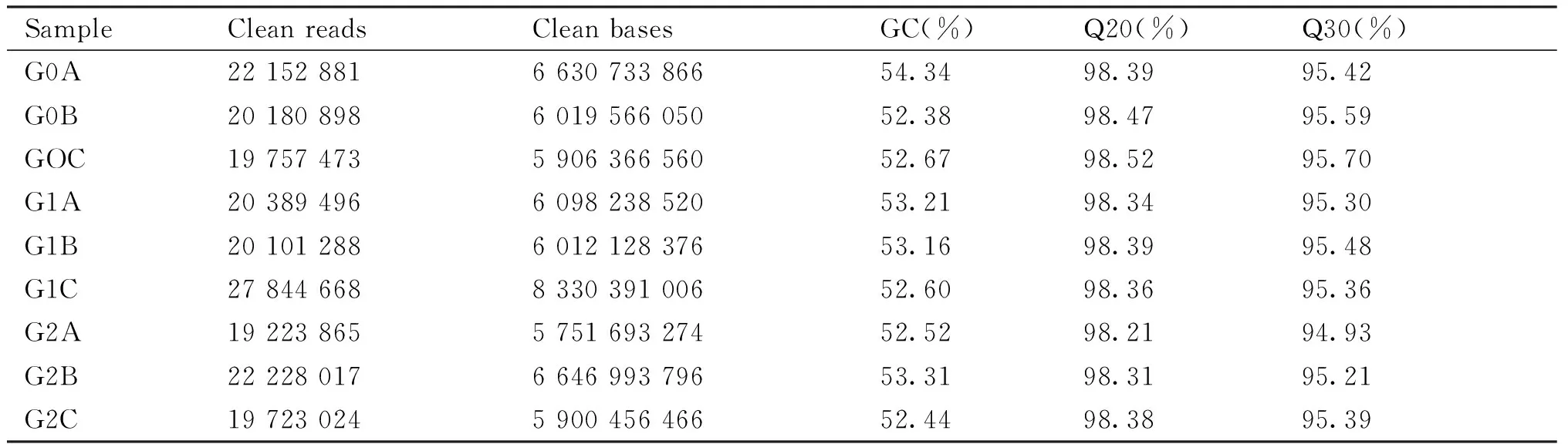
Table 2 The statistical results of sequencing data
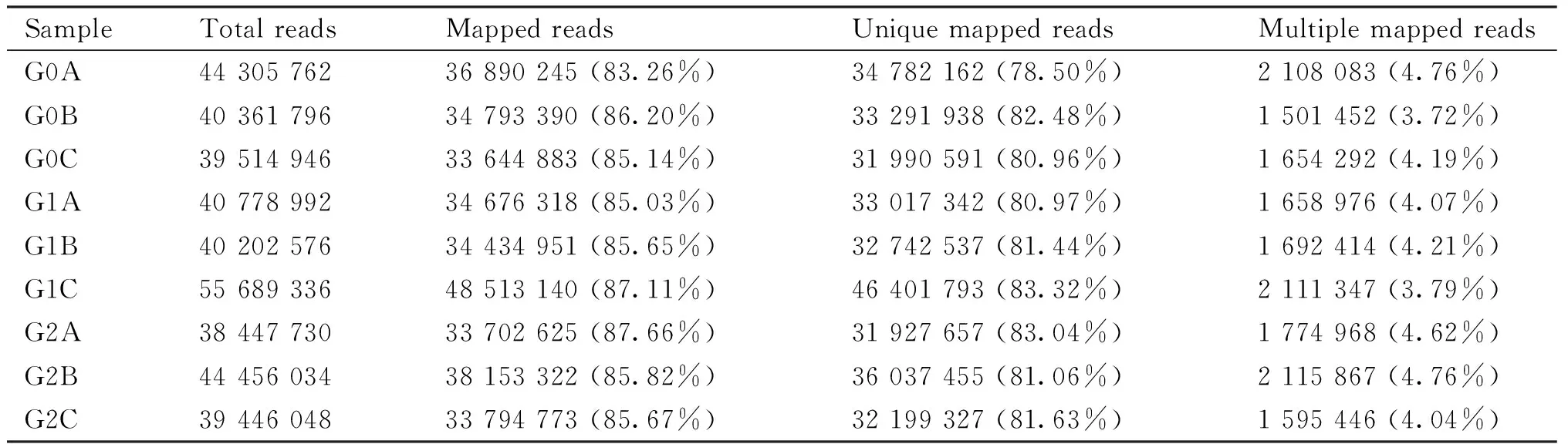
Table 3 Statistics of comparison results between transcriptome sequencing data and reference genome
2.2 重复相关性分析
计算每2个样本之间的皮尔逊(Pearson)[16]相关性,用热图方式表示两两样品的相关性(Fig.1)。结果表明,0A、0B、0C三个生物学重复之间的两两相关系数分别为0.989、0.986和0.992;1A、1B、1C三个生物学重复之间的两两相关系数分别为0.993、0.993和0.992;2A、2B、2C三个生物学重复之间的两两相关系数分别为0.98、0.986和0.982,符合编码(encode)计划对试验中皮尔逊相关系数(R2)至少应该不小于0.92的要求。每组3个重复之间的相关性都较强,表明生物学重复有效。
2.3 差异表达基因的筛选
以倍数变化(Fold Change) ≥ 1.5且P值 < 0.05为筛选标准,0%CLAvs1%CLA试验组总共获得406个差异表达基因,其中上调基因281,下调基因125;0%CLAvs2%CLA试验组总共得到659个差异表达基因,其中上调基因422,下调基因237;火山图中的红色表示上调的差异表达基因,绿色表示下调的差异表达基因,黑色表示无差异的基因(Fig.2A、2B、2C),横坐标绝对值越大,表明表达量在两样品间的表达量倍数差异越大;纵坐标值越大,表明差异表达越显著,筛选得到的DEGs越可靠。
2.4 差异表达基因的GO功能分类
GO富集显示,1%CLA试验组共有406个差异表达基因,其中有354个差异表达基因得到功能注释;2%CLA试验组共有659个差异表达基因,其中有581个差异表达基因得到功能注释。这些差异表达基因集中在生物学过程、细胞组分和分子功能3大类(Fig.3)。DEGs主要富集在生物学过程的细胞过程、单一生物过程、生物调节和代谢过程;DEGs在生物学过程中的细胞聚集(cell aggregation)在1%CLA试验组无差异表达基因的富集;DEGs在细胞组分中的类核(nucleoid)、病毒(virion)和病毒部分(virion part)均不富集;DEGs在分子功能中的化学排斥物活性(chemorepellent activity)在1%CLA试验组无差异表达基因的富集,趋化活性(chemoattractant activity)在2%CLA试验组无差异表达基因的富集。
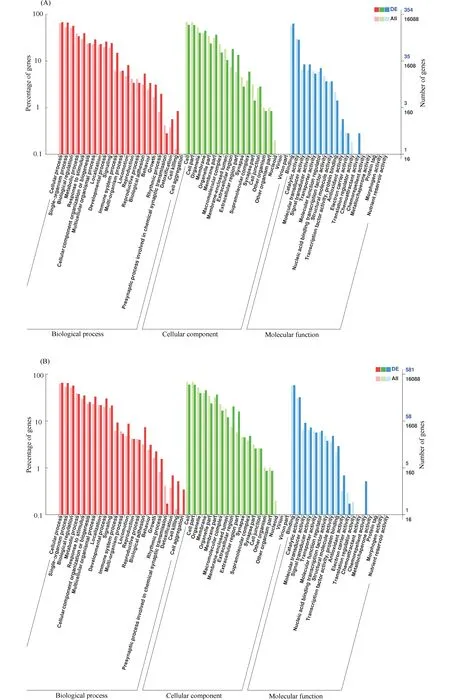
Fig.3 GO function classification statistics map of DEGs (A) GO function classification statistics map of 0%CLA vs 1% CLA, (B) 0% CLA vs 2% CLA. The abscissa is the GO function classification. The left side of the ordinate is the percentage of the number of genes. The number of genes was shown on the right
共筛选到7个与脂肪酸代谢相关的显著富集GO条目,其中1%CLA试验组有6个显著富集的GO条目,2%CLA试验组有2个显著富集的GO条目。发现3个与KEGG数据库中脂肪代谢相关的相同基因,分别是ENSGALG00000005043、ENSGALG00000048882和ELOVL5(Table 4)。

Table 4 Significantly enriched GO entries related to fatty acid metabolism
2.5 差异表达基因的KEGG通路分析
对差异表达基因进行KEGG通路分析,可以进一步了解差异表达基因的生物学功能。1%CLA试验组共有406个差异表达基因,在122条通路中得到注释,其中有14条通路显著富集(P< 0.05),富集在细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)、黏着斑(focal adhesion)、细胞黏附分子(cell adhesion molecules)、肌动蛋白细胞骨架调节(regulation of actin cytoskeleton)和类固醇生物合成(steroid biosynthsis)等信号通路中;2%CLA试验组有659个差异表达基因,在152个通路中得到注释,其中有11条通路显著富集(P< 0.05),富集在黏着斑(focal adhesion)、细胞黏附分子(cell adhesion molecules)、丙酮酸代谢(pyruvate metabolism)、不饱和脂肪酸的生物合成(biosynthesis of unsaturated fatty acids)和脂肪酸生物合成(fatty acids biosynthesis)等信号通路中(Fig.4)。
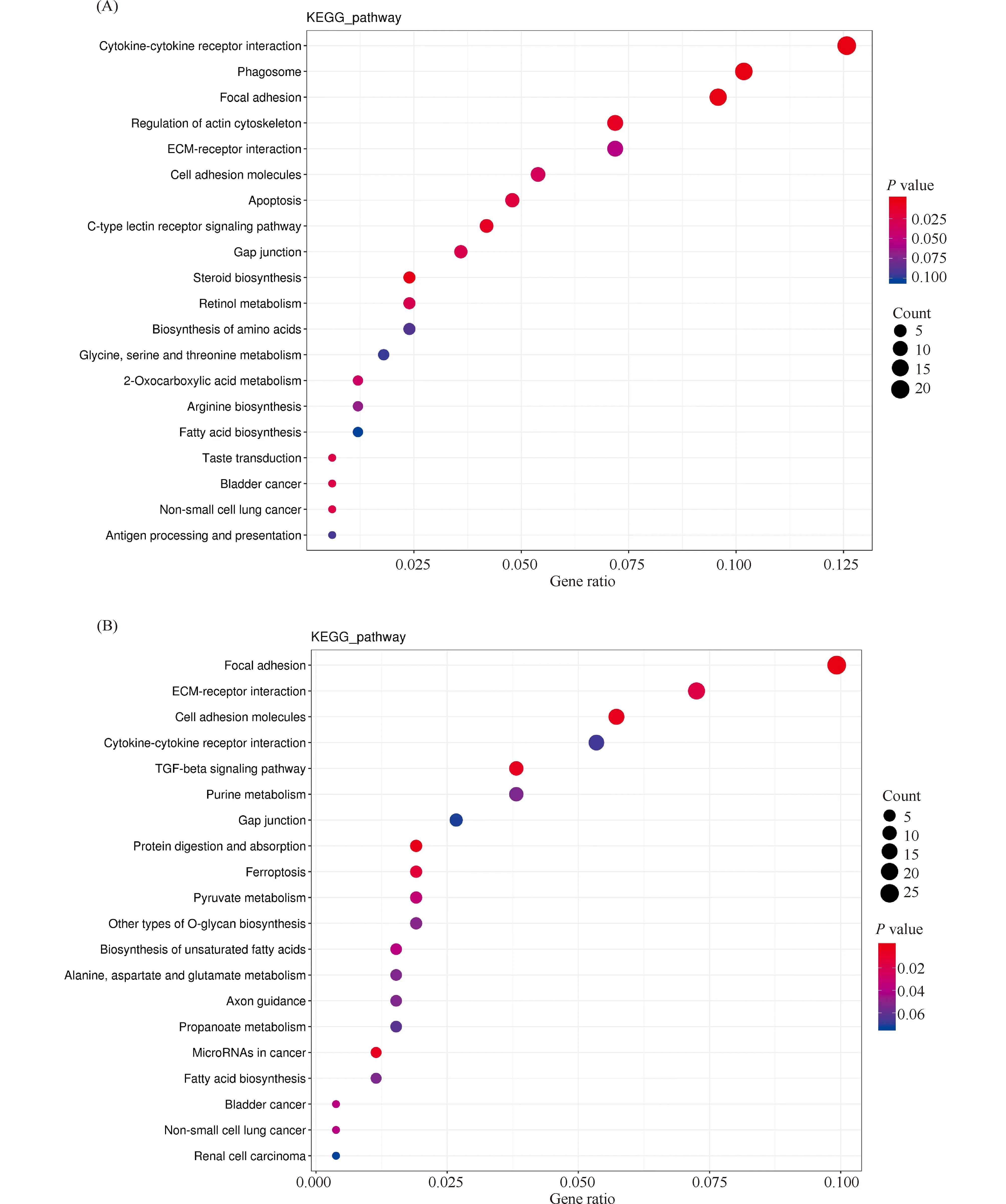
Fig.4 KEGG pathway bubble chart of enrichment of DEGs (A) Bubble chart of KEGG pathway enrichment of 0% CLA vs 1% CLA, (B) 0% CLA vs 2% CLA. The ordinate represents the name of the passage. The abscissa represents the Gene Ratio. The color of the circle represents the p value, The size of the circle indicates the number of genes enriched in the pathway
通过KEGG信号通路分析6个主要参与脂肪代谢通路中的11个差异表达基因(Table 5)。FADS2(脂肪酸脱氢酶)在1%CLA和2%CLA试验组均极显著上调(P< 0.01);在2%CLA试验组FADS1(脂肪酸去饱和酶1)、ELOVL5(极长链脂肪酸延伸酶蛋白5)、LPL(脂蛋白脂肪酶)和FABP5(脂肪酸结合蛋白)显著上调(P< 0.05),ACOX2(脂酰辅酶A氧化酶2)、SLC27A1(脂肪酸运输蛋白)、LOC107050163和ENSGALG00000030996显著下调(P< 0.05),在1%CLA试验组均无差异;差异表达基因ENSGALG00000005043和ENSGALG00000048882在1%CLA和2%CLA试验组均显著下调(P< 0.05)。
2.6 qRT-PCR验证筛选得到的差异表达基因
从11个与脂肪酸代谢相关的候选基因中随机选取6个基因进行qRT-PCR检测其表达水平。结果显示,用qRT-PCR检测的6个基因的相对表达水平变化趋势与RNA-seq的结果一致(Fig.5)。
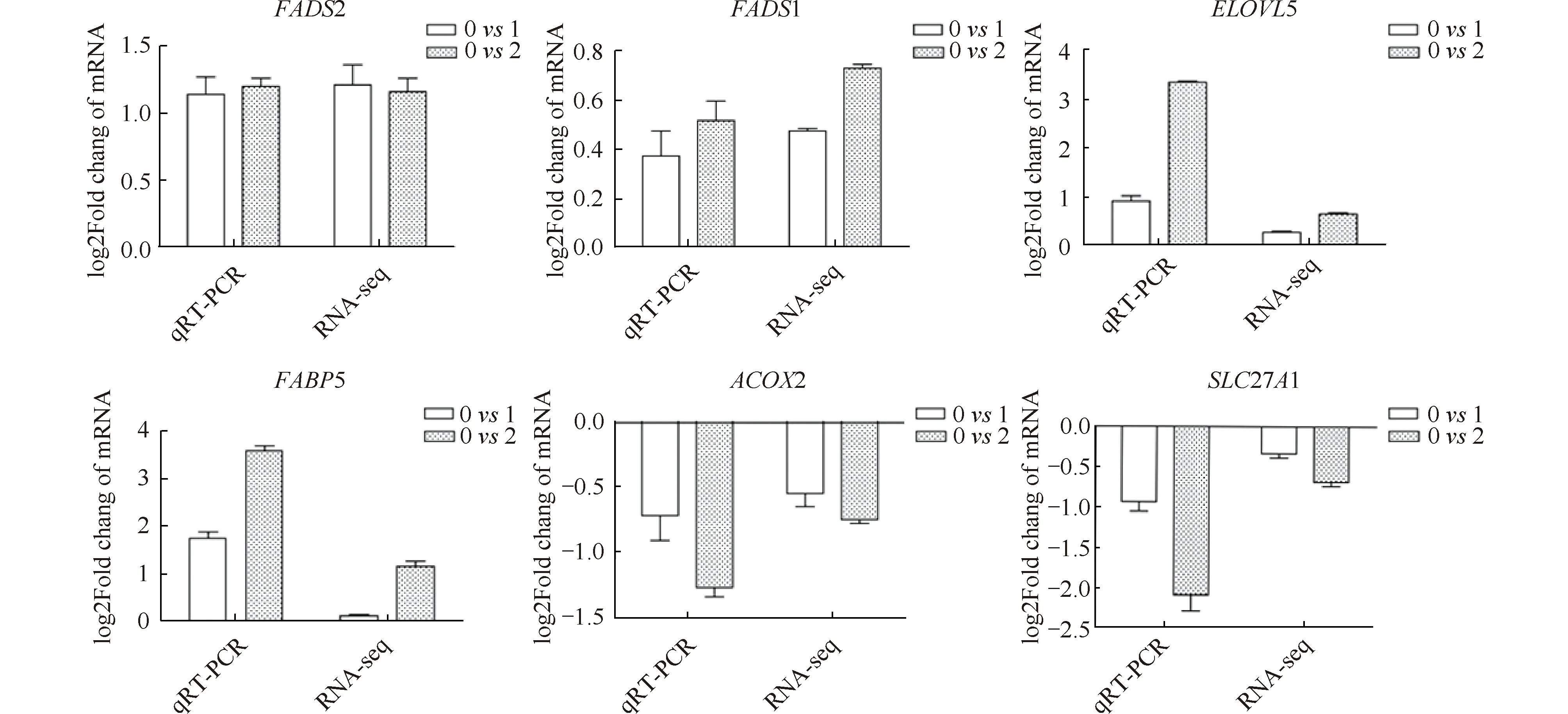
Fig.5 DEGs sequencing results and qPCR validation The ordinate represents log2 fold change of mRNA of candidate gene. The consistent trend of qRT-PCR and RNA-seq indicates that transcriptome data are reliable
3 讨论
肌内脂肪沉积是影响肉品质和风味的重要因素。近年的研究表明,改变饲料营养成分可以增加肌内脂肪沉积,提高肉品质[17~19]。本研究对贵妃鸡基础日粮中添加不同比例CLA的胸肌样本进行转录物组分析,共挖掘新基因3 165个,筛选1 065个差异表达基因。通过对转录物组数据进行质控分析和差异表达基因相关性分析,发现每组3个重复之间的相关性都较强,表明生物学重复有效,测序数据可靠。
本研究对差异表达基因进行GO富集分析发现,DEGs主要集中在生物学过程的细胞过程、单一生物过程、生物调节和代谢过程,这些生物过程可能调控脂肪代谢。在与脂肪代谢相关显著富集GO条目中,1%CLA试验组有6个显著富集条目11个基因参与脂肪代谢,2%CLA试验组有2个显著富集条目3个基因。其中,ENSGALG00000005043、ENSGALG00000048882和ELOVL5在KEGG数据库中脂肪代谢相关的基因也有发现,表明这些GO条目中的基因对CLA影响脂肪酸代谢有着重要作用,为揭示CLA对贵妃鸡脂肪代谢分子调控机制提供理论依据。
有研究发现,细胞因子-细胞因子受体相互作用、黏着斑和细胞黏附分子调节通路可能参与脂质的沉积[20~21]。本研究通过KEGG分析发现,DEGs显著富集在细胞因子-细胞因子受体相互作用、黏着斑和细胞黏附分子信号等通路中,可能参与脂质代谢;1%CLA和2%CLA试验组DEGs分别显著富集在类固醇生物合成和脂肪酸生物合成通路中参与肌内脂肪代谢。本文结果表明,贵妃鸡基础日粮中CLA可能影响这些信号通路中相关基因的表达调控肌内脂肪代谢,具体调控机制有待进一步研究。

Table 5 Pathways and enriched genes related to fatty acid metabolism
脂肪酸脱氢酶(FADS)是一类催化脂肪酸酰基链特定位置C-C脱氢形成C=C的脱氢酶家族,能够催化脂肪酸生成多不饱和脂肪酸[22]。FADS2是花生四烯酸(AA)和二十二碳六烯酸(DHA)等多不饱和脂肪酸(PUFAs)合成过程的限速酶,并在生物体内具有调节脂肪酸代谢等重要作用[23~24]。有研究发现,干扰FADS2可显著降低奶山羊乳腺上皮细胞中AA和DHA比例,导致细胞中PUFAs含量降低;并且抑制二酰基甘油转移酶基因1(diacylglycerol acyltransferase 1, DGAT1)及DGAT2表达,降低细胞中甘油三酯(TG)含量[25]。在新品种二郎鸡胸肌组织中发现,胆固醇的含量与FADS2基因表达量呈显著正相关,低密度脂蛋白与FADS2基因表达量呈显著负相关[26]。本研究发现,FADS2在1%CLA和2%CLA试验组均极显著上调,表明贵妃鸡基础日粮中CLA可能促进TG、胆固醇和PUFA在肌肉组织中形成,调节肌肉组织中的脂肪沉积。
FADS1是参与PUFAs去饱和和伸长级联反应生成长链多不饱和脂肪酸的限速酶之一[27]。FADS1下调可以抑制PPARα-FGF21(成纤维细胞生长因子21)信号通路,从而使脂肪在肝中沉积[28]。Fan等[29]首次证实,牛乳腺上皮细胞中TG、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA)含量与FADS1表达呈显著正相关。极长链脂肪酸延伸酶蛋白家族(elongation of very-long-chain fatty acids,ELOVLs)是长链脂肪酸和超长链脂肪酸合成的起始酶和限速酶[30]。目前,在这个家族中共发现7个成员,其中ELOVL5在鸡上被定位于3号染色体,主要催化合成多不饱和脂肪酸。Moon等[31]研究发现,当敲除小鼠体内ELOVL5基因时,可以通过激活脂肪酸合成相关的靶基因的表达,进而形成脂肪肝。ELOVL5和FASN可以调控绵羊脂肪沉积[32]。脂肪酸结合蛋白质5(fatty acid binding protein 5,FABP5)参与脂肪酸的摄取、结合、转运和代谢,对硬脂酸和亚油酸具有高度亲和力,并通过调节细胞内脂肪酸的转运来调控脂质代谢[33~34]。FABP5可通过PPARγ和LPL影响血管性痴呆大鼠的学习记忆能力和脂质代谢[35]。FABP5表达上调可能导致家鸭脂肪沉积过多[36]。脂蛋白脂酶(lipoprotein lipase,LPL)是参与脂肪代谢的关键酶,王刚等[37]发现,猪肌肉组织LPL基因表达与脂肪沉积呈显著正相关。本研究发现,FADS1、ELOVL5、FABP5和LPL在1%CLA试验组无差异表达,在2%CLA试验组显著上调。表明贵妃鸡基础日粮中的2%CLA可能激活FADS1和ELOVL5参与PUFA合成,提高PUFA在肌肉中的富集。FABP5的上调表达,可能激活PPAR信号通路中的转录因子PPARG,PPARG被激活后可能引起LPL上调,以促进TG的合成[2],调控肌肉组织中的脂肪沉积,改善肉品质。这与张广民[9]在饲粮中添加t-10,c-12 CLA增加AA肉鸡肌内脂肪的研究结果一致。
ACOX2是脂酰辅酶A氧化酶2的编码基因,主要负责支链脂肪酸的降解,影响脂肪酸的β-氧化,调控脂肪酸代谢,是唯一参与胆汁酸生物合成的酰基辅酶A氧化酶[38]。SLC27A1,又称作FATP(fatty acid transport proteins),是脂肪酸运输蛋白质家族成员之一,它可以调节长链脂肪酸的代谢[39]。SLC27A1基因的下调,通过CPT1A介导的抑制脂肪酸的氧化从而增强鸡肌肉内脂肪沉积[40~41]。在过表达SLC27A1的小鼠骨骼肌中,观察到肌内TG的降低,促进脂肪酸的氧化[42]。本研究发现,ACOX2和SLC27A1在1%CLA试验组无差异,在2%CLA试验组显著下调。表明贵妃鸡基础日粮中,2%CLA可能影响脂肪酸的β-氧化,使TG在肌肉中沉积,增加肌肉脂肪的沉积,改善肉品质。
基因LOC107050163和ENSGALG00000030996在1%CLA试验组表达无差异,在2%CLA试验组表达显著下调。基因ENSGALG00000005043和ENSGALG00000048882在1%CLA试验组和2%CLA试验组均显著下调。LOC107050163在多不饱和脂肪酸的合成和脂肪酸代谢通路中,ENSGALG00000030996、ENSGALG00000005043和ENSGALG00000048882在脂肪酸的生物合成通路中。表明贵妃鸡基础日粮中CLA抑制这4个基因表达,调控肌内脂肪代谢,其功能和调控机制需进一步研究。总之,本研究在贵妃鸡基础日粮中添加CLA,共筛选11个与脂肪代谢相关的候选基因,为揭示CLA影响肌内脂肪代谢的分子机制提供理论依据,但CLA影响这些基因的具体调控机制仍需进一步研究。
