冷却治疗对劳力性热射病大鼠肾脏抗利尿激素受体2 mRNA及蛋白表达的影响
2022-09-05刘秀珍王蕴红张冰彭庆文
刘秀珍 王蕴红 张冰 彭庆文
1 安庆师范大学体育学院(安徽安庆246133)
2 首都体育学院运动科学与健康学院(北京100191)
3 清华大学体育部(北京100084)
4 怀化学院体育学院(湖南怀化418000)
马拉松是目前最受欢迎的一项长跑体育赛事,但同时也是一项高风险的运动。劳力性热射病(exertional heat stroke,EHS)是马拉松运动员发生猝死的重要原因[1]。劳力性热射病是在运动中体温调节系统不堪重负时发生的核心体温过高(>40℃/>104℉)以及中枢神经系统功能障碍[2]。劳力性热射病是一种医学急症,病情进展极快,半小时内没有接受快速降温处理的患者发生多器官衰竭乃至死亡的病例明显上升[3]。对于确诊病例或疑似患者,必须在现场快速冷却治疗,然后才是转运到急诊部[4]。
劳力性热射病发病机制涉及高温热损伤、胃肠道缺血、热休克反应、凝血系统激活、肾脏水盐代谢失衡等方面[5-7]。其冷却治疗机制可能与肾脏水盐代谢、热损伤、胃肠道炎症变化、凝血功能等有关,其中水盐代谢与体温调节密切相关[8,9]。抗利尿激素(vasopressin),是机体调节水平衡的重要激素,其分泌异常增多与运动性疾病的发生发展密不可分。Oh 及Siegel[10,11]的研究表明,在马拉松等耐力性运动中发生的劳力性热射病及运动性低钠血症与机体严重脱水引起的抗利尿激素过度分泌有关。Kim 等[12]的研究表明,冷应激能诱导抗利尿激素mRNA 表达显著性下调,但是有关冷却治疗是否能诱导劳力性热射病患者抗利尿激素的改变并没有进一步的研究结果。抗利尿激素有3 种受体,分别是受体1(V1)、受体2(V2)和受体3(V3),其中V2 受体主要分布在肾脏集合管,介导抗利尿激素在肾脏中对水的重吸收,发挥抗利尿作用[13,14]。Sun 等[15]的研究发现,低温环境引起大鼠V2 受体合成中V2 mRNA 表达显著性降低及利尿现象。但是冷却治疗是否通过调控抗利尿激素及其受体V2 对机体水代谢进行调节,国内尚无文献报道。因此,本研究探讨了冷却治疗对抗利尿激素及其受体V2 mRNA 及蛋白表达的影响,为劳力性热射病冷却治疗提供科学依据。
1 材料与方法
1.1 实验动物分组与测试过程
7 周龄雄性Sprague-Dawley 大鼠,初始体重为237.82 ± 30.78 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。大鼠分笼饲养,自由饮水摄食,人工光照控制昼夜节律,室温20℃~25℃,湿度45%~50%。大鼠适应性喂养1 天,随机分为6 组,常温对照组(normal control group,NC 组)8 只、热射病发病组(heat stroke onset group,HSO 组)9 只、热射病休息1 组(heat stroke rest group 1,HSR1 组)9 只、热射病冷浸1 组(heat stroke cold group 1,HSC1 组)7 只、热射病休息2 组(heat stroke rest group 2,HSR2 组)9 只和热射病冷浸2 组(heat stroke cold group 2,HSC2 组)8只,各组大鼠体重无显著性差异。在高温运动至力竭建立劳力性热射病大鼠模型及冷却治疗期间进行体温测试,测试时间点分别为运动前、运动后、冷浸5 min或休息5 min、休息60 min。对完成预定实验的大鼠取材,进行生理指标测试:血液测试指标为红细胞比容(hematocrit,Hct)和抗利尿激素;肾脏测试指标为抗利尿激素受体V2 mRNA 表达和V2 蛋白表达。实验动物分组及测试过程见图1。
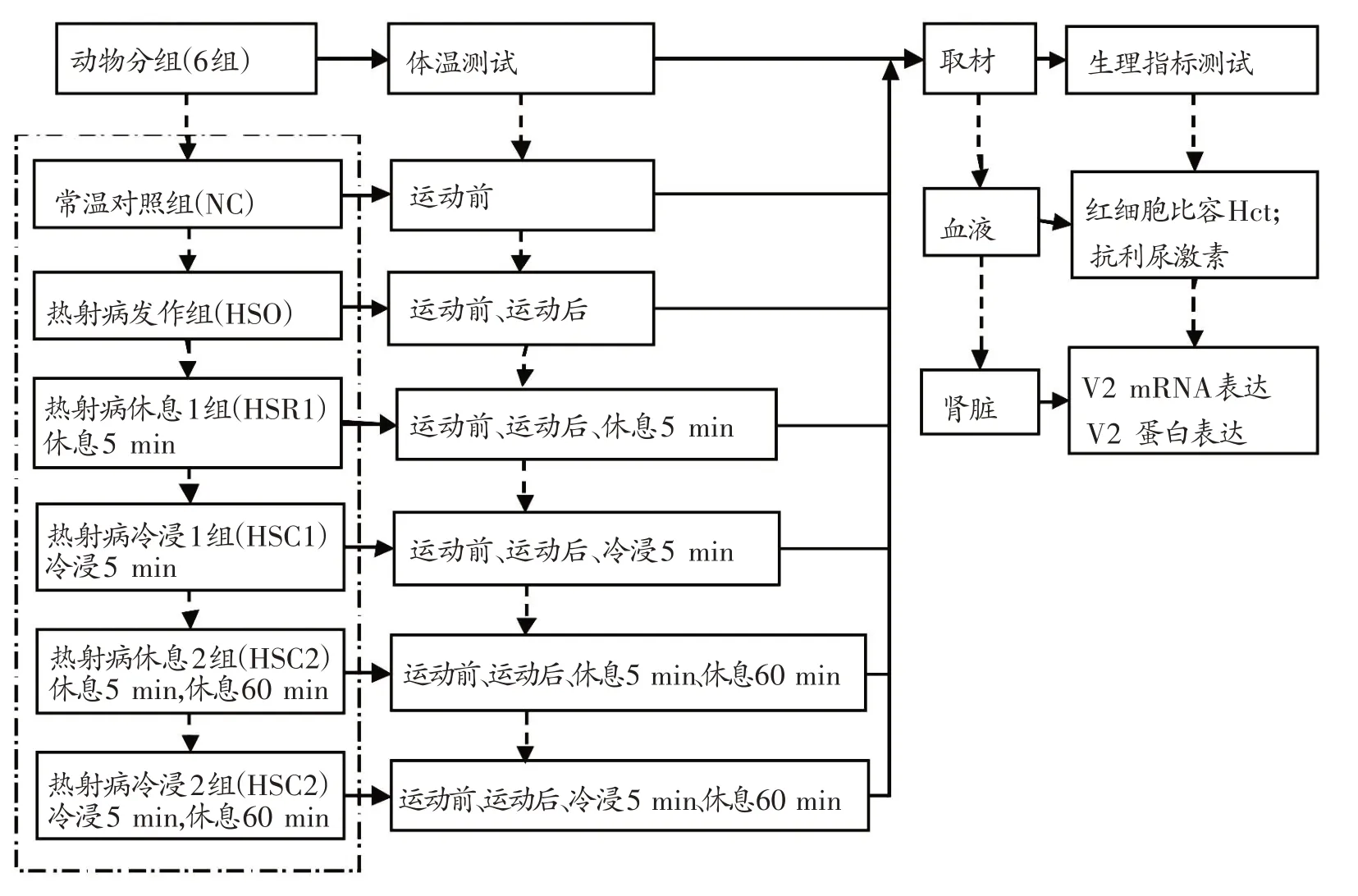
图1 实验动物分组及测试过程
1.2 实验动物模型制备与冷却治疗
1.2.1 适应性训练
热射病组大鼠在建模前先进行为期5 天的适应性训练。跑台坡度设置为0。起始运动速度为18 m/min,每天递增2 m/min,最后达到26 m/min。起始运动时间为30 min,每天递增10 min,最后达到60 min。适应性训练安排见表1。

表1 大鼠适应性训练安排
1.2.2 劳力性热射病大鼠模型建立
适应性训练后休息3 天,大鼠在跑台上进行一次性高温力竭运动实验,建立劳力性热射病大鼠模型。高温力竭运动实验在高温高湿实验室内进行,温度控制为36℃±1℃,湿度控制为75% ±5%相对湿度(relative humidity,RH)。根据Bedford[16]最大摄氧量表及大鼠高温力竭运动预实验,确定大鼠进行跑台运动时坡度为5°,速度为28 m/min,相当于最大摄氧量60%~80%的运动强度。根据Lam[17]报道的经典型热射病大鼠模型(暴露在高温环境中的大鼠直肠温度上升到约42℃和平均动脉压从峰值下降到约25毫米汞柱)和Chang[18]报道的热运动至力竭诱导劳力性热射病大鼠模型以及劳力性热射病大鼠建模预实验,确定劳力性热射病大鼠模型诊断标准为大鼠在高温环境中运动至力竭,并使直肠温度上升到约42℃。大鼠运动至力竭标准为不能维持既定运动强度,滞留于跑台后挡板,使用声、电刺激及毛刷连续驱赶3次无效。
1.2.3 冷水浸泡治疗方案
根据Riana[7]报道的海军陆战队马拉松运动中劳力性热射病冷却治疗方案和Stewart[6]报道的耐力运动中劳力性热射病患者院前冷却治疗案例设定大鼠冷水浸泡预实验,建立大鼠冷水浸泡方案。本研究冷水浸泡方案最终确定为19℃(实际温度为19℃±1℃),冷水浸泡5 min。大鼠休息温度设定为室温20℃(实际温度为20℃±1℃)。高温运动至力竭建立劳力性热射病大鼠模型后,HSR1 组大鼠休息5 min,HSC1 组大鼠冷浸5 min,HSR2组大鼠休息5 min+60 min,HSC2组大鼠冷浸5 min,休息60 min。HSC1 组和HSC2 组大鼠用于观察冷却治疗后不同时间点的生理反应变化,HSC1 组用于观察冷却治疗后即刻效果,HSC2 组用于观察冷却治疗后60 min效果。HSR1组和HSR2组大鼠用于观察未经冷却治疗相应时间点的生理反应变化,HSR1组用于观察休息5 min效果(与HSC1组对照),HSR2组用于观察休息60 min 效果(与HSC2 组对照)。冷却速率以大鼠冷浸5 min 期间单位时间内核心体温的减少量来表示,其计算公式为v=。
1.3 取材及处理
按照0.32 ml/100 g 体重的剂量给大鼠注射10%水合氯醛进行腹腔麻醉。冰上解剖大鼠,从腹主动脉取4 ml 血液,2 ml 血液用于测试血常规,另2 ml 血液用于测试抗利尿激素;摘取肾脏后立即放入液氮中冷冻及保存。
1.4 测试指标与方法
1.4.1 核心体温测试
采用北京搏贝科技有限公司JNT-200 型鼠肛温计测量大鼠直肠温度作为核心体温。测量方法为:将温度计探头插入大鼠直肠6.5 cm,固定探头,待读数稳定后读取数值[9]。
1.4.2 血液红细胞比容
采用全自动血细胞分析仪测试大鼠血常规,单管测定,选取Hct 指标进行研究,仪器为日本光电工业株式会社MEK-7222K 血细胞分析仪,试剂由上海东湖生物医学有限公司提供,批内差:CV≤1.5%,批间差:CV≤2%。
1.4.3 血清抗利尿激素
采用双抗体两步夹心酶联免疫吸附法(ELISA)测试大鼠血清抗利尿激素,单管测定,仪器为美国ThermoMK3 酶标仪,ELISA 试剂盒来自美国Enzolife 公司,批内差:CV≤10%,批间差:≤15%。
1.4.4 肾脏V2mmRRNNAA表达
采用荧光定量qRT-PCR 检测系统测试肾脏V2 mRNA 表达。根据GenBank 数据库查找的目的基因V2及内参GAPDH 的基因序列设计引物,由北京天一辉远生物科技有限公司合成(见表2)。取适量组织放入液氮预冷的研钵中研磨成粉末并转移到EP 管中,用美国Invitrogen 公司提供的Trizol试剂抽提总RNA,用Takara反转录试剂盒将RNA 反转录为cDNA,加入特异性引物,采用EvaGreen 饱和染料Mix 进行实时荧光定量qRT-PCR 检测,每个样本重复三次。获取CT 值、平均CT 值、△CT 值和△△CT 值,采用2-△△CT相对定量公式计算V2基因的相对表达量。

表2 荧光定量qRT-PCR引物
1.4.5 肾脏V2蛋白表达
1)蛋白抽提:预冷RIPA 蛋白抽提试剂,加入cocktail 蛋白酶抑制剂;12000 rpm 离心15 min。取上清,进行蛋白定量。2)BCA 法蛋白定量:按照BCA 蛋白定量试剂盒使用说明测定蛋白浓度。3)Western Blot 检测:根据目的蛋白的分子量,配制10%分离胶,浓缩胶浓度为5%。将样本分别加入凝胶孔中,30 μg/孔。电泳条件为:浓缩胶恒压90 V,20 min;分离胶恒压150 V,根据预染蛋白marker 确定电泳时间。湿转法转膜条件为:100 V 恒压;0.22 μm 孔径PVDF 膜,60 min。5%BSA-TBST 室温封闭,水平摇床孵育1 h。一抗孵育:5%BSA-TBST稀释一抗(抗利尿激素,1∶2000;GAPDH,1∶1000,Abcam公司),一抗来源为兔,4℃水平摇床孵育过夜。第2 日,TBST 洗膜:3×10 min。二抗孵育:5%BSA-TBST 稀释二抗[山羊抗兔IgG(H+L),HRP,1∶10000,Abcam 公司],室温孵育1 h。将ECL 发光液滴加到膜的蛋白面,反应3~5 min。胶片曝光:10 s~5 min,显影2 min,定影。4)计算结果:采用Image J 软件计算蛋白条带灰度值,Western Blot 结果以目的蛋白与内参蛋白灰度值的比值表示。
1.5 统计学分析
采用SPSS20.0 统计分析数据,结果以均值±标准差(± s)表示。组间比较应用非参数检验K 个独立样本Kruskal-Wallis H 检验,有显著性后再进行后续检验;后续检验采用非参数检验2 个独立样本Mann-Whitney U 检验方法。采用非参数检验2 个相关样本Wilcoxon 符号秩检验方法对同一组内不同时间点的数据进行比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 大鼠核心体温及冷却速率
高温运动前,各组大鼠核心体温在H 检验中有显著性差异(P<0.01)。后续U 检验和Wilcoxon 检验结果如表3 所示。高温运动前,与NC 组比较,HSO 组大鼠核心体温显著升高(P<0.01);而参加高温运动实验的5组(HSO 组、HSR1 组、HSC1 组、HSR2 组和HSC2 组)大鼠核心体温相互间均无显著性差异(P>0.05)。同一组大鼠运动后核心体温与运动前比较,HSC1 组和HSC2组显著升高(均P<0.05);HSO组、HSR1组与HSR2组显著升高(均P<0.01)。高温运动后各组大鼠核心体温无显著性差异(P>0.05)。与HSR1 组比较,冷浸5 min 后的HSC1 组大鼠核心体温显著降低(P<0.01)。与HSR2组比较,冷浸5 min 后的HSC2 组大鼠核心体温显著降低(P<0.01)。与HSR2 组比较,冷浸5 min+休息60 min后的HSC2 组大鼠核心体温显著降低(P<0.05)。参加冷浸的HSC1组和HSC2组大鼠在冷浸期间的冷却速率分别为1.18 ± 0.25℃/min 和1.10 ± 0.26℃/min,二者之间无显著性差异(P>0.05)。
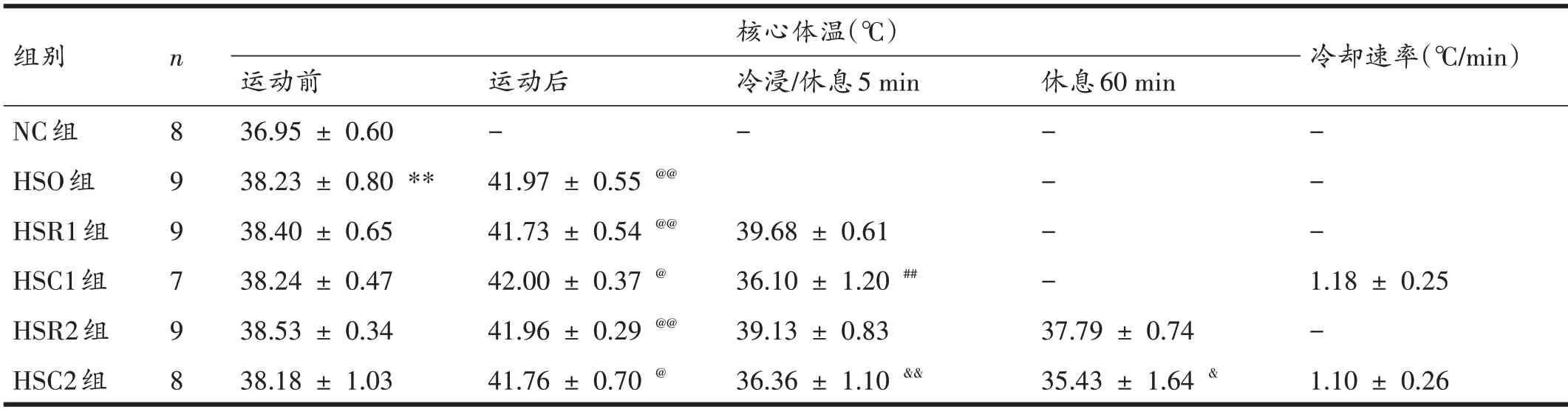
表3 各组大鼠运动前、后各时间点核心体温及冷却速率比较
2.2 大鼠血液红细胞比容
各组大鼠红细胞比容在H 检验中有显著性差异(P<0.05)。后续U 检验结果如表4 所示,与NC 组比较,HSO 组大鼠红细胞比容显著升高(P<0.05)。其余组间比较均无显著性差异(P>0.05)。

表4 各组大鼠红细胞比容比较
2.3 大鼠血清抗利尿激素
各组大鼠血清抗利尿激素在H 检验中有显著性差异(P<0.05)。后续U 检验结果如表5 所示,与NC 组比较,HSO 组大鼠血清抗利尿激素显著升高(P<0.01)。其余组间比较均无显著性差异(P>0.05)。
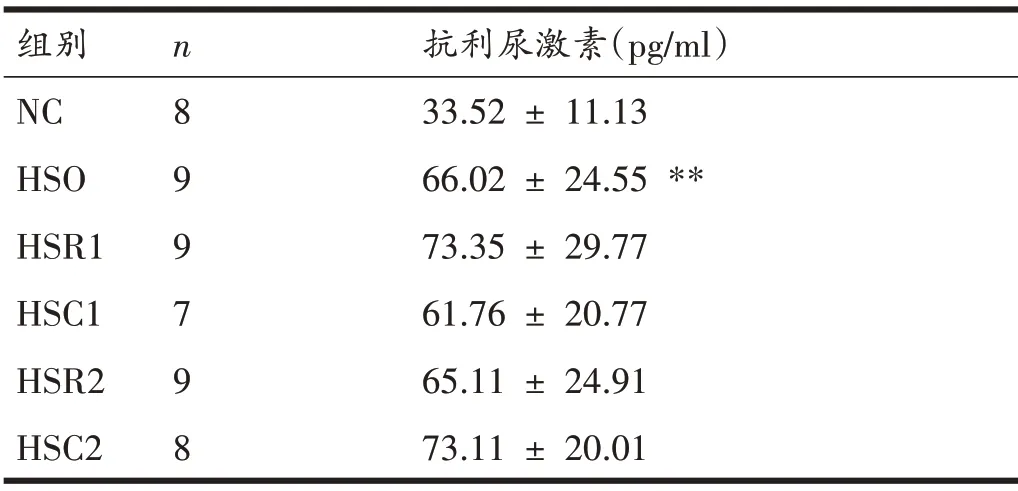
表5 各组大鼠抗利尿激素比较
2.4 大鼠肾脏V2mRNA表达
各组大鼠肾脏V2 mRNA 表达在H 检验中有显著性差异(P<0.01)。后续U 检验结果如表6 所示,与NC组比较,HSO 组大鼠肾脏V2 mRNA 表达显著升高(P<0.01);与HSO 组比较,常温休息HSR1 组和HSR2 组肾脏V2 mRNA 表达无显著性差异(均为P>0.05),经过冷浸的HSC1 组和HSC2 组大鼠肾脏V2 mRNA 表达均显著降低(均为P<0.01);与休息HSR1组比较,冷浸HSC1组大鼠肾脏V2 mRNA 表达显著降低(P<0.01);与休息HSR2 组比较,冷浸HSC2 组大鼠肾脏V2 mRNA 表达显著降低(P<0.01)。
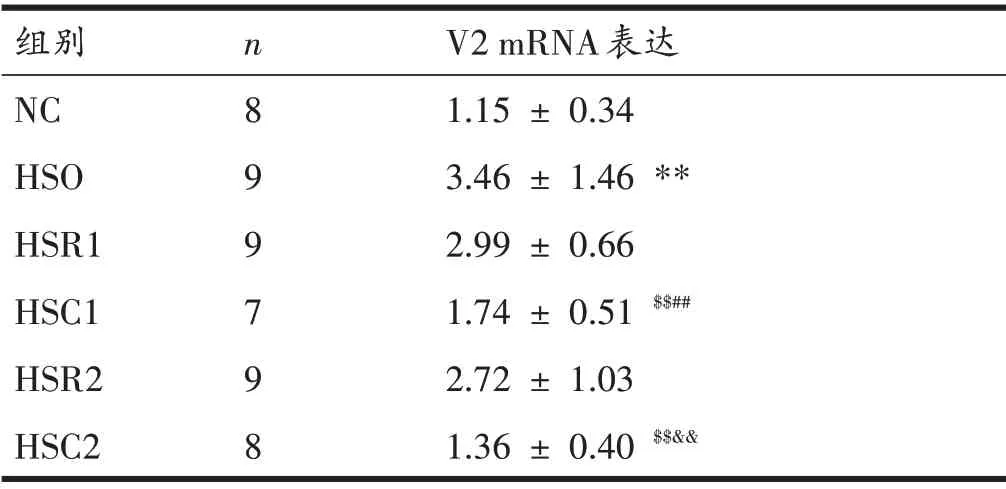
表6 各组大鼠肾脏V2 mRNA表达比较
2.5 大鼠肾脏V2蛋白表达
各组大鼠肾脏V2 蛋白表达在H 检验中有显著性差异(P<0.01)。后续U 检验结果如表7 所示,与NC 组比较,HSO 组大鼠肾脏蛋白表达显著性升高(P<0.01);与HSO 组比较,常温休息HSR1 组和HSR2 组大鼠肾脏V2 蛋白表达无显著性差异(均为P>0.05),经过冷浸的HSC1 组和HSC2 组大鼠肾脏V2 蛋白表达显著降低(均为P<0.05);与休息HSR1 组比较,冷浸HSC1 组大鼠肾脏V2 蛋白表达无显著性差异(P>0.05);与休息HSR2组比较,冷浸HSC2 组大鼠肾脏V2 蛋白表达无显著性差异(P>0.05)。

表7 各组大鼠肾脏V2蛋白表达比较
3 讨论
3.1 冷疗对EHS大鼠核心体温的影响
本研究中常温对照组未经过适应性训练,而5 个劳力性热射病模型组均参加了适应性训练。建模前,经过适应训练的热射病发作HSO组大鼠核心体温显著高于未经过适应训练的常温对照组,但是经过适应训练的5 组大鼠相互之间核心体温并无显著性差异。张婷等[19]建立了经典型与劳力性热射病动物模型,用于研究两种模型大鼠各主要器官病理改变的异同,大鼠未进行适应性训练。Zhang 等[20]建立了劳力性热射病大鼠模型,用于研究红景天苷对线粒体的保护作用,大鼠在建模前未进行适应性训练。与张婷及Zhang 的研究有所不同的是,本研究在劳力性热射病大鼠建模前均进行了适应性训练,发现经过适应训练的大鼠核心体温明显高于未经过适应训练的大鼠,说明适应性训练会引起大鼠核心体温上升。
劳力性热射病动物模型包括大鼠模型和小鼠模型。Chang 等[18]的研究表明,大鼠在36℃高温下运动至力竭时出现了核心体温过高、神经系统损伤、血压较低等热射病症状。King 等[21]分别在37.5℃、38.5℃和39.5℃高温下利用转轮建立了热射病小鼠模型,发现小鼠发生神经系统功能障碍(失去意识)时的最高核心体温为42.1℃~42.5℃。与Chang 及King 的研究相类似,本研究中,高温运动至力竭的5 组大鼠均出现了劳力性热射病症状,包括运动后核心体温上升到42.0℃左右和出现神经系统功能障碍(意识丧失),符合劳力性热射病建模标准,表明劳力性热射病建模成功。
冷水浸泡(cold water immersion,CWI)多用于既往体健的运动员或士兵在劳力性热射病发作最初几分钟时的快速降温急救。Wohlfert 等[22]的研究表明,冷水浸泡由于降温速率最快从而成为劳力性热射病冷却急救公认最有效的方法,患者急救后几乎全部存活。本研究中,HSC1 组大鼠在19℃冷浸5 min 后核心体温由42.00℃降到36.10℃,且显著低于HSR1 组大鼠在20℃环境中休息5 min 后的核心体温(39.68℃);HSC2 组大鼠在19℃冷浸5 min 后核心体温由41.76℃降到36.36℃,且显著低于HSR2 组大鼠在20℃环境中休息5 min 后的核心体温(39.13℃),说明19℃冷浸5 min 对劳力性热射病大鼠核心体温已产生显著影响。Wohlfert等[23]对运动员10℃冷水浸泡时的冷却速率进行了研究,发现预冷组和对照组在核心体温从39.5℃降温到38℃期间的冷却速率分别为0.18℃/min 和0.19℃/min。Godek 等[24]的研究发现:对39℃下热运动至力竭或核心体温上升到39.5℃的运动员进行10℃冷水浸泡时,越野赛运动员的冷却速率(0.26℃/min)高于足球运动员(0.16℃/min),但二者均被认为是理想的冷却速率(dT/dt>0.155℃/min);其中越野赛运动员核心体温下降2℃至正常所需的时间仅为8 min。与前人的研究有所不同,本研究中两组热射病大鼠冷水浸泡5 min 期间冷却速率分别为1.18℃/min 和1.10℃/min,比人体冷却速率更快,时间更短,提示不同物种在体温调节方面可能存在较大的差异性。本研究中在20℃环境中休息60 min后,HSR2 组和HSC2 组大鼠核心体温均有所下降;且HSC2 组大鼠核心体温显著低于HSR2 组大鼠,说明20℃环境休息不仅可以降温,而且有助于延续冷却治疗效果。
3.2 冷疗对EHS大鼠血液浓缩程度的影响
血常规指标红细胞比容是反映血液浓缩/稀释程度的重要指标,在临床上常用于识别病人的脱水情况。全军重症医学专业委员会和全军热射病防治专家组[25,26]在中国热射病诊断与治疗专家共识中指出,劳力性热射病发作时,因机体大量脱水引起血液浓缩及炎症变化,导致血常规检测异常,表现为红细胞比容异常升高,血红蛋白升高,血小板初期正常,继而迅速下降,白细胞计数异常升高、中性粒细胞百分比偏高等症状。本研究中HSO组大鼠在高温力竭运动诱导劳力性热射病发作时出现红细胞比容显著性升高,表明红细胞比容是劳力性热射病病理生理学改变的敏感指标。
Riana 等[7]的研究提出:冷水浸泡是确保马拉松等耐力运动所致劳力性热射病患者存活的冷却急救方案,随后应该立刻检测血液指标,包括血常规、电解质、血糖、肾功能等,治疗脱水、电解质异常和急性肾功能衰竭等。Erkus 等[27]的研究发现,冷暴露会引起人体红细胞比容下降。本研究中冷浸后即刻及其后60 min时,红细胞比容有下降趋势,但未见显著性差异。这提示红细胞比容对冷却治疗期间的温度变化不敏感。脱水是引起红细胞比容改变的根本原因。冷却治疗对红细胞比容没有明显影响,提示冷却治疗未能明显改善热射病机体脱水状况。
3.3 冷疗对EHS大鼠血清抗利尿激素的影响
Casa 等[28]研究发现,运动时机体过度脱水会引起体温升高,并增加罹患热射病风险。抗利尿激素是机体调节水代谢的关键性激素,能促进肾脏对水的重吸收,起到抗利尿(抗脱水)效果。Saissy 等[29]的研究表明,劳力性热射病会引起急性肝衰竭,这不仅与高热会直接损伤肝实质有关,也与抗利尿激素分泌过多使血液再分配引起急性肝缺血病情加重有关。在研究24小时超级耐力赛中相关低钠血症的发生率时,Chlibkova 等[30]研究表明,运动性低钠血症与运动过程中抗利尿激素过度释放有关。本研究中,劳力性热射病发作时,血清抗利尿激素明显升高。上述研究结果表明,机体在通过抗利尿(抗脱水)途径调节机体水平衡的过程中会出现抗利尿激素过度释放情况,使得机体水代谢发生障碍,不仅会引起运动性低钠血症和急性肝损伤,也会导致劳力性热射病。这提示血液抗利尿激素是劳力性热射病病理生理学改变的敏感指标。Jasnic 等[31]研究发现,4℃冷暴露60 min 对大鼠血清抗利尿激素含量没有明显影响。本研究中,在冷浸后即刻及其后60 min 时,血清抗利尿激素均未出现显著性变化,也说明冷浸并不能明显改善抗利尿激素过度释放情况。由于抗利尿激素的合成部位(下丘脑)与释放部位(垂体后叶)并不一致,导致抗利尿激素释放入血的过程滞后于抗利尿激素的合成过程。冷浸对热射病大鼠血清抗利尿激素没有明显影响,其机制可能与抗利尿激素释放入血的过程滞后于下丘脑抗利尿激素的合成有关,因此,冷却治疗与抗利尿激素的关系还有待进一步研究。
3.4 劳力性热射病大鼠冷却治疗期间抗利尿激素及受体调节机制探讨
抗利尿激素受体为G 蛋白耦联受体(G proteincoupled receptors,GPCRs),包括V1、V2 和V3 三种类型。其中V2 受体位于肾脏集合管细胞的基底侧膜,介导抗利尿激素在肾脏对水的重吸收,起到抗利尿(抗脱水)效果。Milander 等[32]的研究发现,铁人三项运动中V2 受体基因的高度表达与机体严重脱水导致的体重丢失存在显著相关。Bes 等[33]的研究进一步证实,肾脏过度抗利尿会诱导V2 基因发生致病性突变,导致肾病综合征患者出现低钠血症。本研究中,劳力性热射病发作时,除了严重脱水外,肾脏抗利尿激素受体V2 mRNA 及V2 蛋白表达显著上调,说明机体在通过抗利尿(抗脱水)途径调节机体水平衡的过程中出现了抗利尿激素受体过度分泌情况,表明抗利尿激素受体V2 过度分泌与机体致病有关,提示血液抗利尿激素受体V2是劳力性热射病病理生理学改变的敏感指标。
包括人类在内的大多数哺乳动物在冷暴露时会发生利尿现象,但是利尿的机制并不完全一致。Sun 等[15]的研究发现,长期冷暴露(5℃)引起大鼠肾水排泄增多,血浆抗利尿激素水平无明显变化,肾脏抗利尿激素受体V2 mRNA 表达显著降低,说明长期冷暴露引起大鼠利尿是由于肾脏V2 受体的抑制,而不是抗利尿激素的抑制。Broman 等[34]的研究发现,冷诱导低体温大鼠(核心体温为28℃)出现明显的利尿利钠,并伴有肾小球滤过率、尿渗透压和血浆抗利尿激素显著下降,进一步研究发现,渗透压不受低体温或去氨加压素(选择性V2 受体激动剂)影响,说明低体温所致的利尿是由于抗利尿激素和肾髓质高渗减少所致,而不是V2 受到了抑制。本研究重点探讨冷却治疗对劳力性热射病大鼠抗利尿激素及V2 受体的影响,结果显示,在冷浸后即刻及60 min 时,调节水代谢的V2 mRNA 表达均显著性下调、V2 蛋白表达均显著减少,抗利尿激素均未出现显著性变化。这些结果说明,冷却治疗后,抗利尿激素过度释放情况未见明显好转,但是抗利尿激素受体V2过度分泌情况得到改善。这提示冷浸可以在一定程度上改善水代谢的调节,其机制可能是通过抑制V2 受体的分泌,减弱机体的过度抗利尿反应。本研究中60 min 的20℃环境休息延续了冷浸5 min(或休息5 min)对抗利尿激素、V2 mRNA 和V2 蛋白表达的影响,提示60 min 的20℃环境休息有助于维持冷却治疗(或常温休息)效果。
4 结论
冷浸可以快速有效地降低热射病大鼠核心体温,对血液Hct及抗利尿激素没有明显影响,但能够显著抑制肾脏抗利尿激素受体V2 mRNA 及蛋白表达,改善水代谢的调节。
