针刺对运动诱发骨骼肌损伤大鼠内质网功能及内质网应激-自噬蛋白的影响
2022-09-05丁海丽靳松林李伦宇闫丹丹黄增浩任在方王瑞元
丁海丽 靳松林 李伦宇 闫丹丹 黄增浩 任在方 王瑞元
1 成都体育学院运动医学与健康研究所,运动医学与健康学院(成都610041)
2 黑龙江省中医药科学院(哈尔滨150036)
3 中日友好医院(北京100029)
4 北京体育大学运动人体科学学院(北京100084)
人体长时间进行大负荷运动或承受不适应运动负荷可导致肌纤维超微结构发生改变,呈现出肌肉僵硬、肌力下降以及主观感觉疼痛等症状和体征,称为运动性骨骼肌损伤(exercise-induced muscle damage,EIMD),进而引起延迟性肌肉酸痛(delayed onset muscle soreness,DOMS)[1]。若不及时进行干预,将影响肌肉工作能力、加剧损伤并影响运动表现[1-3]。运动诱发骨骼肌损伤后可使与肌肉收缩密切相关的“钙库”——内质网腔内错误折叠与未折叠蛋白聚集以及钙离子平衡紊乱,称为内质网应激(endoplasmic reticulum stress,ERS),其发生与内质网两个重要功能酶Ca2+-ATP 酶(Ca2+-ATPase,SERCA)和蛋白二硫键异构酶(protein disulfide isomerase,PDI)密切相关[4-6]。ERS可导致未折叠蛋白反应(unfolded protein response,UPR),上调UPR 靶蛋白葡萄糖调节蛋白78(glucose regulated protein78,GRP78)、钙网蛋白(calreticulin,CRT)等表达,从而代偿辅助蛋白折叠,并可启动自噬途径以平衡蛋白聚集与内质网膨胀[7-8]。适度内质网应激-自噬作为细胞防御机制之一,可以有效清除异常或老化的内质网片段以及易聚集蛋白,维持内质网稳态;过度激活则可能清除健康内质网,或通过信号转导激活其他细胞反应,不利于骨骼肌乃至整个机体健康。研究证实,134 序列相似的家庭成员B(family with sequence similarity 134,member B,FAM134B)可能作为一种受体蛋白,介导了选择性内质网自噬[9]。该过程通过选择性锚定受损内质网,促使异常内质网碎裂成片段与正常结构脱离,并招募自噬蛋白微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)形成自噬体。然而,关于内质网应激-自噬与EIMD的关系如何目前鲜有研究。
EIMD 属中医劳损伤筋范畴。《灵枢-经筋》记载:“治在燔针劫刺,以知为数,以痛为腧”[10],奠定了针刺治疗经筋病的渊源。本团队前期研究发现斜刺针法治疗EIMD 效果显著[11,12],并可能与线粒体和内质网应激自噬有关。近年来,我们在内质网应激与EIMD的作用机制方面进行了研究,发现包括内质网功能、结构、钙信号等[4-6]在内的内质网途径在EIMD 的恢复中作用显著,但内质网应激-自噬这一亚细胞器水平的应激相关机制尚不明确。基于此,本实验旨在观察针刺干预对EIMD 大鼠内质网应激-自噬蛋白的影响,以期进一步揭示针刺改善运动性骨骼肌损伤的分子机制,为传统针刺疗法在运动医学中的应用实践提供依据。
1 材料与方法
1.1 主要仪器与试剂
小动物跑台(淮北正华生物仪器设备有限公司,中国)、酶标仪(BIO-RAD)、垂直电泳槽(北京凯元仪器设备厂)、透射电子显微镜(日本电子)、水平脱色摇床(北京鼎国生物技术发展中心)。
BCA 蛋白定量试剂盒(上海碧云天生物技术研究所P0012s)、大鼠内质网钙泵(SERCA)ELISA 试剂盒(上海碧云天生物技术研究所E02S0463)、大鼠蛋白二硫键异构酶(PDI)ELISA 试剂盒(上海碧云天生物技术研究所E02P0078)、组织内质网蛋白提取试剂盒(BestBio BB-31454-1);GRP78一抗(Abcam ab21685)、calreticulin 一抗(Abcam ab22683)、FAM134B 一抗(Abcam ab151755)、LC3B一抗(Abcam ab48394)。
1.2 研究对象与分组
健康雄性8周龄SD大鼠88只,SPF级,体重233.51 ± 11.07 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001,在北京体育大学科研中心实验动物房饲养和训练。按随机数字表法分为空白对照组(C 组)、模型组(E 组)和针刺干预组(EA组),E组和EA组根据运动及干预后不同取材时间点,又分为0 h、12 h、24 h、48 h、72 h 五个亚组,共11 个组别,每组8 只。大鼠自由饮食饮水,室内温度20℃~26℃,相对湿度40%~70%,12 h 明暗交替。实验中动物处置符合国家科学技术部2006 年颁布的《关于善待实验动物的指导性意见》相关规定,获得北京体育大学运动科学实验伦理委员会批准。
1.3 建立运动性骨骼肌损伤大鼠模型
参照Armstrong 等[13]的运动诱发骨骼肌损伤方案,予E 组和EA 组大鼠以一次大负荷运动建立EIMD 模型。使用小动物电动跑台训练,先进行3 天适应性训练,第1 天跑台坡度0°,速度16 m/min,运动时间5 min;第2 天坡度0°,速度16 m/min,时间10 min;第3天休息。适应性训练后开始正式实验,坡度-16°,速度16 m/min,时间90 min。
1.4 针刺干预方案
运动后即刻对针刺干预组施以“阿是穴-斜刺”。固定器固定并消毒大鼠双后肢,用直径0.25 mm 的无菌毫针[汉医牌,津食药监械(准)字2009 第2270002号],以斜刺进针法,针与皮肤间的倾斜角约30°,沿大鼠小腿三头肌的纵向从远端穿过肌腹,留针2 min。前期研究证实[14],依据“以痛为腧”采用“阿是穴-斜刺”可有效治疗EIMD。
1.5 样本采集和指标检测
取材:按照各组对应时相将大鼠称重,腹腔注射10%水合氯醛(3.5 ml/kg 体重)麻醉,腹主动脉取血并分离血清,迅速分离比目鱼肌。冰冷生理盐水漂洗,滤纸拭干,剔除结缔组织。右侧比目鱼肌组织取2 mm×3 mm 组织块投入2.5%戊二醛固定液,制备电镜样品,剩余组织剪碎后匀浆,待测ELISA 实验;左侧比目鱼肌组织组织置于液氮迅速冷冻后-80℃冰箱保存,待测Western Blot实验。
透射电镜观察肌纤维超微结构:经戊二醛固定,锇酸再固定,丙酮溶液脱水,环氧树脂Spurr 包埋后,制备超薄切片,醋酸双氧铀和柠檬酸铅双染色。采用H-600IV型透射电子显微镜观察骨骼肌纤维超微结构。
ELISA 法测定血清血清肌酸激酶(creatine kinase,CK)、骨骼肌型肌酸激酶(creatine kinase,muscle,CK-MM)和肌组织SERCA、PDI 含量:酶标板空白孔中加入100 μL 样品,空白对照加入100 μL 蒸馏水,各孔加入50 μL 酶标记溶液,密封后37℃孵育1 h;洗涤并拍干,加显色剂A、B 各50 μL,室温避光10 min;加50 μL 终止液,置于酶标仪30℃孵育2 h;在550 nm波长处每隔1 min连续测定各孔光密度OD值。
Western Blot 法检测肌组织GRP78、CRT、FAM134B、LC3 蛋白表达量:取比目鱼肌于冰上研钵中剪碎、研磨,按1 mg∶10 μL 加入裂解液,14000 rpm、4℃离心10 min,取上清,BCA 试剂盒测定蛋白浓度。配制12%分离胶,5%浓缩胶,上样量20 μg/孔;浓缩胶恒压90 V,约20 min,分离胶恒压120 V。湿转法转膜,丽春红染色,封闭PVDF 膜。5%BSA-TBST 稀释一抗(1∶1000),5%BSA-TBST 稀释HRP 标记山羊抗兔IgG(1∶10000)。胶片曝光,显影,定影。分析蛋白条带灰度值,以GAPDH为内参计算相对表达量。
1.6 统计学方法
2 结果
2.1 各组大鼠肌纤维超微结构变化
图1 显示,C 组肌节清晰,明、暗带分界清楚,排列规则,Z 线整齐且两侧线粒体均匀分布。E 组0 h、12 h、24 h 和48 h 出现不同程度的Z 线加宽、断裂,明、暗带分界不清,线粒体肿胀并聚集在肌膜下,72 h有所缓解但未完全恢复。EA 组对应时相比E 组明显改善,72 h肌节结构整齐,线粒体在肌膜两侧排列整齐。
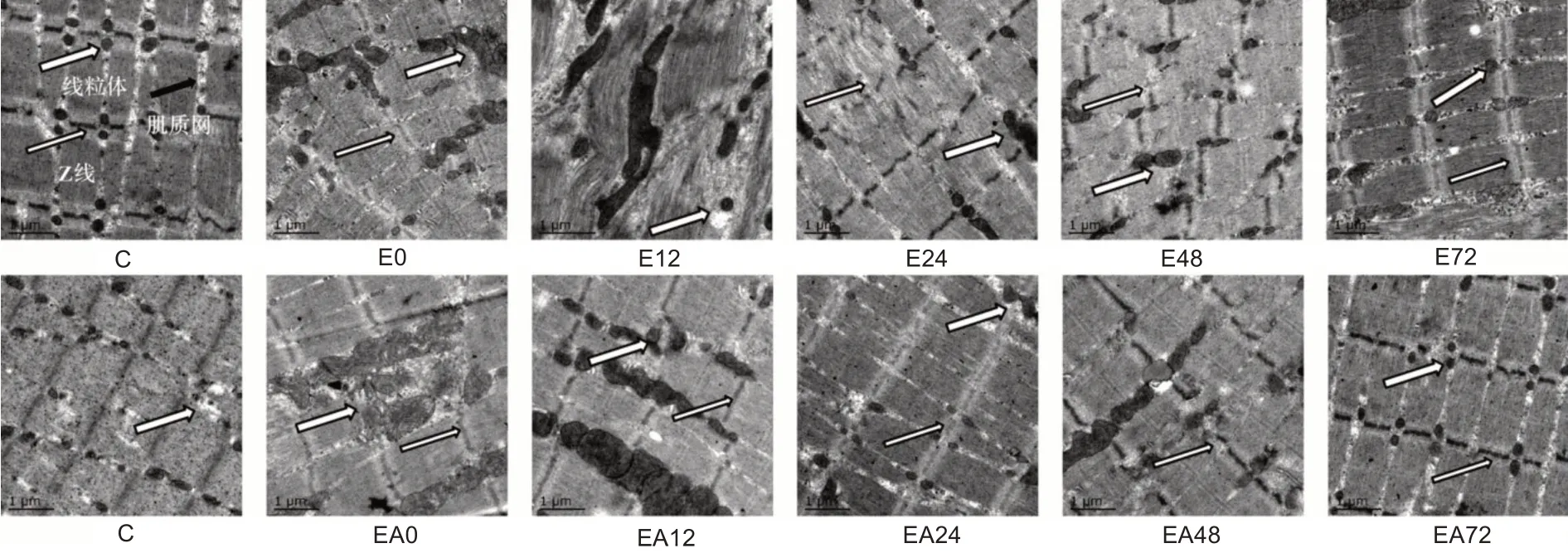
图1 各组大鼠肌纤维超微结构图(透射电镜,×8000)
2.2 各组大鼠血清CK和CK-MM含量比较
血清CK 和CK-MM 统计结果显示,不同干预和时相两因素以及二者的交互作用显著(P<0.05),因此逐一分析各因素的单独主效应。由图2 可知,与C 组比较,E 组CK 和CK-MM 在0 h 至48 h 均显著升高(P<0.05);EA 组CK 在0 h、12 h、24 h 显著升高(P<0.05),48 h 和72 h 已无显著差异,CK-MM 呈相似变化趋势。与E 组对应时相比较,EA 组CK 在0 h 至48 h 均显著降低(P<0.05),CK-MM 在0 h 和12 h 显著降低(P<0.05)。
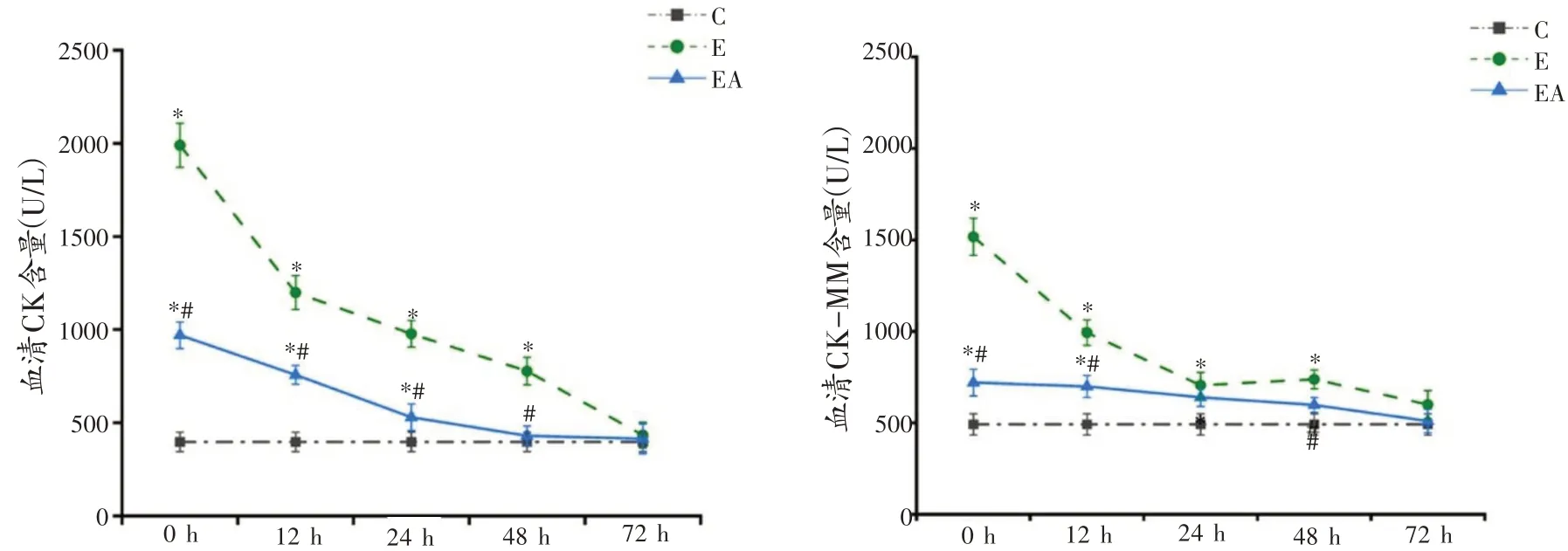
图2 各组大鼠血清CK、CK-MM 含量比较(n=8)
2.3 各组大鼠肌组织SERCA和PDI含量比较
肌组织SERCA 和PDI 统计结果显示,不同干预和时相两因素以及二者的交互作用显著(P<0.05),因此逐一分析各因素的单独主效应。由图3可知,与C组比较,E 组SERCA 在0 h 至48 h 均显著降低(P<0.05),而PDI含量在各时相均无显著差异;EA 组SERCA 在0 h、12 h、24 h 显著降低(P<0.05),48 h 和72 h 已无显著差异;PDI 在各时相均显著升高(P<0.05)。与E 对应时相比较,EA 组SERCA 在48 h 和72 h 显著升高(P<0.05),而PDI在各时相均显著升高(P<0.05)。
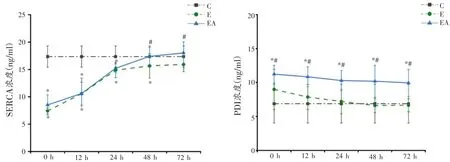
图3 各组大鼠肌组织SERCA、PDI含量比较(n=8)
2.4 各组大鼠肌组织GRP78和CRT蛋白表达比较
肌组织GRP78 和CRT 统计结果显示,不同干预和时相两因素以及二者的交互作用显著(P<0.05),因此逐一分析各因素的单独主效应。由图4可知,与C组比较,E 组GRP78 在运动后0 h 至72 h 均显著升高(P<0.05),CRT 在0 h 至48 h 显著升高(P<0.05);EA 组GRP78和CRT仅0 h显著升高(P<0.05),其余时相则无显著差异。与E 组对应时相比较,EA 组GRP78 各时相均显著降低(P<0.05),CRT 在24 h 和48 h 显著降低(P<0.05)。

图4 各组大鼠肌肉GRP78、CRT蛋白表达比较(n=8)
2.5 各组大鼠肌组织FAM134B和LC3蛋白表达比较
肌组织FAM134B 和LC3II/I统计结果显示,不同干预和时相两因素以及二者的交互作用显著(P<0.05),因此逐一分析各因素的单独主效应。由图5可知,与C组比较,E 组FAM134B 和LC3Ⅱ/Ⅰ在0 h 至48 h 均显著升高(P<0.05);EA 组FAM134B在0 h和12 h显著升高(P<0.05),其余无显著差异;LC3Ⅱ/Ⅰ仅在0 h 显著升高(P<0.05),其余则无显著差异。与E组对应时相比较,EA 组FAM134B 在12 h、48 h 和72 h 显著降低(P<0.05),LC3Ⅱ/Ⅰ在12 h、24 h 和48 h 显著降低(P<0.05)。

图5 各组大鼠肌肉内质网FAM134B、LC3蛋白表达比较(n=8)
3 讨论
3.1 针刺对运动诱发大鼠骨骼肌损伤的改善效应
本实验采用“阿是穴-斜刺”干预大鼠运动性骨骼肌损伤(exercise-induced muscle damage,EIMD),通过透射电镜观察和血清肌酶检测发现,针刺干预可以缓解肌纤维超微结构改变,显著下调运动后血清肌酸激酶CK 及同工酶CK-MM 水平,提示针刺可改善运动诱导的骨骼肌损伤,促进其修复进程,与课题组前期研究结果相一致[5-6];张安宁[15]、朱世鹏[16]等通过腓肠肌钝挫伤模型,也证实了针刺阿是穴可有效促进骨骼肌损伤修复。
《灵枢-经筋》首次提出“以痛为腧”,并记载了19首处方,标志着经筋病以痛为腧治法的形成。包括阿是穴在内的经筋病取穴方法,在缓解疼痛和改善运动功能等方面效果确切[17-20]。20 世纪70 年代中期,卢鼎厚先生在学习“阿是穴温针”疗法的基础上,将“以痛为腧”进一步发展提出“以劳损肌束为腧”,采用“阿是穴斜刺,不提针、捻针,留针3~5 min”的方案可有效治疗肌肉运动损伤,缓解大负荷运动后延迟性肌肉酸痛症状,促进骨骼肌机能恢复[20]。其后陆续有研究从细胞骨架、蛋白质代谢、信号通路、细胞因子及线粒体等细胞器方面进行了机制探讨[5,6,12,21]。然而,参与收缩的重要细胞器内质网相关机制尚有待阐明。本实验在前期研究基础上,从介导内质网应激-自噬关键蛋白的角度探索针刺干预EIMD的机制。
3.2 针刺对EIMD大鼠骨骼肌内质网功能的影响
内质网功能包括Ca2+调节、蛋白质折叠修饰及脂质胆固醇合成等。研究发现,长时间的离心运动可导致肌浆网钙释放与回收能力下降,并可持续至运动后24~48 h[22]。刘阳等[5]认为,运动诱发骨骼肌损伤后可出现肌细胞内的“钙库”——肌浆网膨大,Ca2+扮演着介导损伤和修复的关键角色,而针刺可能通过影响细胞钙信号促进损伤恢复。我们前期研究[4]也证实了运动后针刺可逐渐恢复[Ca2+]ER且有效调节内质网应激程度,初步探索了Ca2+调节机制与蛋白折叠的协同效应。本研究结果显示,针刺干预组Ca2+-ATP 酶(SERCA)含量在48 h 和72 h 时与模型组相比具有显著性差异,结合其在运动即刻出现急剧降低至最低值的现象,提示一次大负荷运动后行针刺干预,骨骼肌SERCA 含量恢复在早期并没有体现,表明SERCA 可能并未立即表现出针刺的直接靶点作用。
骨骼肌也具有分泌活性物质的功能,可表达、合成和分泌多种生物信号分子,是一种极为重要的内分泌器官[23]。分泌型蛋白前体需要在内质网中经过翻译、加工、修饰等过程,才能成为成熟的蛋白质,肌肉中的分泌蛋白或者说肌肉因子于内质网腔内通过在分子内或分子间形成二硫键,从而形成其天然构象,蛋白二硫键异构酶(PDI)是催化这些二硫键形成和异构化的重要功能酶[24],其表达有助于蛋白质正确折叠。本研究为了完整地对内质网功能进行评价,在分析钙泵变化的同时,对内质网中唯一的分子伴侣兼蛋白折叠酶PDI含量进行了测定,发现相对于针刺干预后SERCA 变化情况,PDI 的反应更为及时和明显,从而可有效应对运动后骨骼肌内质网应激导致的未折叠、错误折叠蛋白聚集。一次大负荷运动后PDI 含量仅在运动后即刻有所升高,而针刺干预后PDI 含量在各时相均显著提升,可见大负荷运动后骨骼肌未能有效对抗内质网功能受损导致的蛋白折叠障碍,而针刺可缓解大负荷运动后骨骼肌内质网功能受损情况。
3.3 针刺对EIMD 大鼠骨骼肌内质网应激-自噬蛋白的影响
内质网功能紊乱时,未折叠、错误折叠蛋白在腔内聚集以及钙离子失衡从而导致ERS。适度ERS 可应对细胞环境扰动并恢复良好的蛋白折叠环境;过度ERS则引起细胞功能失调、自噬或凋亡。持续的ERS 和未折叠蛋白反应(UPR)可以激活内质网自噬,内质网自噬是参与调控内质网功能的主要方式之一,可以有效清除细胞中受损的内质网片段和无效蛋白质,但过度激活则可清除细胞内健康内质网,或通过传导信号激活其他细胞反应,反而加剧机体病变[25-31]。葡萄糖调节蛋白78(GRP78)、钙网蛋白(CRT)定位于内质网且为发生ERS 的重要标志。本研究结果表明,运动后针刺干预可显著下调GRP78 和CRT 表达,说明针刺可有效缓解EIMD 大鼠骨骼肌内质网应激。CRT 作为Ca2+结合蛋白不仅可以感受钙紊乱,还能在内质网应激时帮助错误折叠蛋白重新折叠并激活自噬途径[32]。大负荷运动后即刻CRT急剧增加并有可能在应对急性的错误折叠与未折叠蛋白聚集以及钙离子平衡紊乱过程中激活自噬途径。
内质网自噬可降解多余内质网膜,能够控制内质网体积从而维持细胞稳定。已有研究揭示了不同类型运动与内质网应激的关系[33],但有关运动后内质网应激引发的后续效应目前较少关注。134 序列相似的家庭成员B(FAM134B)家族基因与哺乳动物肌肉的生理功能密切相关[30-31]。Khaminets[9]、Kurth[34]等的研究指出,FAM134B 的N 端具有LIR 结构域,可与自噬蛋白微管相关蛋白1 轻链3(LC3)结合并相互作用,当内质网自噬启动后,FAM134B锚定受损内质网,帮助其碎裂成片段并与正常结构脱离,随即与LC3 相互作用,进而被自噬膜包裹形成自噬体。FAM134B锚定的靶向部位是含KDEL序列的蛋白,即内质网滞留信号。CRT是定位于内质网的KDEL 家族成员,亦是骨骼肌内质网应激的重要蛋白。因此,FAM134B 可能作为一种自噬受体蛋白,通过锚定CRT 后招募LC3,介导选择性骨骼肌内质网自噬。本实验中针刺显著下调了FAM134B、LC3Ⅱ/Ⅰ及CRT表达,提示FAM134B可能是介导针刺调节内质网应激-自噬水平的靶点之一,但其确切作用途径和分子机制有待进一步探究。
4 小结
本研究表明,针刺可以有效改善运动性骨骼肌损伤,促进其恢复进程,相关作用机制可能与上调二硫键异构酶PDI 辅助蛋白折叠,下调内质网应激标志蛋白GRP78 与CRT 表达,抑制内质网自噬蛋白FAM134B 与LC3表达,从而调节内质网应激-自噬水平有关。
