慢性完全闭塞病变血运重建后围术期心肌梗死发生率及危险因素分析
2022-09-05刘严慈彭红玉柳景华李文铮吴铮赵东晖程子超
刘严慈 彭红玉 柳景华 李文铮 吴铮 赵东晖 程子超
围术期心肌梗死( periprocedural myocardial inf arction,PMI)可由冠状动脉血栓、栓塞、夹层、边支血管闭塞、微血管阻塞引起,是最常见的经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)并发症之一[1]。据统计,3%~6%的患者在PCI后出现PMI,多达1/3的患者出现手术后心肌损伤[2-3]。研究证实,PCI术后心肌酶升高与不良临床事件相关[4]。在临床工作中,减少PMI的发生,能改善患者远期获益。
慢性完全闭塞(chronic total occlusion,CTO)病变是指冠状动脉病变心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级0级且闭塞时间3个月以上的复杂冠状动脉病变[5]。由于闭塞时间长,病变部位可能合并存在迂曲、钙化和血管负性重塑,是PCI最难克服的堡垒。随着CTOPCI技术的发展,在一些CTO-PCI介入中心,手术成功率可达90%以上[6]。然而,目前对CTO病变血运重建后PMI的研究有限。既往研究由于采用了不同的诊断标准以及测量不同的心肌标志物,CTO-PCI术后PMI发生率从1.1%至18.3%不等[1,6-7]。
因此,本研究旨在应用慢性完全闭塞病变学术联盟(The coronary Chronic Total Occlusion Academic Research Consortium,CTO-ARC)专家共识[5]提出的最新诊断标准,评估CTO血运重建后PMI发生率,并对相关危险因素进行分析。
1 对象与方法
1. 1 研究对象
本研究为回顾性研究将2019年1—6月在北京安贞医院冠心病中心行CTO-PCI术的患者纳入队列。入选标准:(1)干预CTO靶病变;(2)手术技术成功,靶病变术后前向血流达到TIMI血流分级Ⅱ级及以上,且靶病变残余狭窄<30%;(3)在PCI术前48 h及术后48 h内,进行心肌酶学标志物[肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)及血清肌钙蛋白I(cardiac troponin I,cTnI)或高敏肌钙蛋白I(high sensitive cardiac troponin I,hs-TnI)]的定量测定及心电图检查。排除标准:(1)术前心肌酶升高,或诊断急性冠状动脉综合征;(2)冠状动脉旁路移植术后患者;(3)支架内CTO病变患者;(4)临床资料缺失。本研究通过北京安贞医院伦理委员会审查。所有患者均签署知情同意。根据CTO-ARC关于PMI的定义,将患者分为非PMI组与PMI组。
1 1.. 22 PMI及相关定义
本研究采用CTO-ARC最新关于PMI的定义,对于术前心肌酶阴性的患者,符合下列标准中的任意一条,可诊断PMI:(1)术后48 h内CK-MB上升超过参考值上限10倍或cTnI上升超过参考值上限70倍;(2)CK-MB上升超过参考值上限5倍或cTnI上升超过参考值上限35倍,伴相邻两个导联Q波形成或新发左束支传导阻滞;(3)如果使用hs-TnI,hs-TnI在术后上升超过参考值上限70倍,伴相邻两个导联Q波形成或新发左束支传导阻滞、或伴手术相关区域新发室壁运动异常、或伴≥2.0 mm心外膜血管(术前TIMI血流分级Ⅱ~Ⅲ级)术后TIMI血流0~Ⅰ级。
手术技术成功定义为在所有≥2.5 mm的远端血管中,前向血流达到TIMI血流分级Ⅱ级及以上,且靶病变残余狭窄<30%。其余CTO病变手术相关定义及并发症定义均参考2021年CTO-ARC专家共识[5]。
1. 3 患者资料采集
研究者分别收集患者的基线资料、实验室检查,由两位经验丰富的PCI术者记录患者冠状动脉造影结果,并计算Progress评分及J-CTO评分。手术完成策略、支架长度及相关手术并发症发生情况等同时被记录于数据库。
所有患者均在术前及术后(48 h内)进行心电图及心肌酶学( CK-MB及cTnI或hs-TnI)检测以及时识别PMI。对于术后有缺血症状或心肌酶升高的患者,动态监测心肌酶及心电图变化。
1. 4 统计学分析
所有数据采用SPSS 20.0进行统计分析。计量资料符合正态分布采用均值±标准差(±s)描述,组间比较用独立样本的t检验;不符合正态分布的资料用四分位数间距[M(Q1,Q3)]描述,组间比较用Mann-WhitneyU秩和检验。计数资料采用[例(%)]表示,组间比较采用χ2检验或Fisher确切概率法。应用Logistic 回归模型分析CTO血运重建后PMI的危险因素。以P<0.05为差异有统计学意义。
2 结果
自2019年1月至6月,队列共连续纳入CTO-PCI 1 064例。其中手术技术成功882例,成功率82.9%,达到入组标准415例。415例PCI中有20例(4.8%)发生PMI,其潜在的致病原因有边支血管损伤(4例,20.0%),术后TIMI血流分级<Ⅲ级(4例,20.0%),以及供血血管闭塞(2例,10.0%)。此外,在围术期PMI组中,有6例手术出现休克(30.0%),有8例(40.0%)患者未能识别出可能的心肌梗死原因。
2. 1 两组患者基线特征、实验室检查及围术期用药方案比较
两组患者的性别、年龄、身体质量指数、血压、基础疾病等基线资料差异无统计学意义(均P>0.05,表1)。PM I组患者超敏C反应蛋白[2.325(0.900,7.593)mg/L比1.015(0.480,2.648)m g/L,P=0.014]比非PM I组更高(表1)。虽然两组患者超声心动图差异无统计学意义,但P M I 组患者B型脑钠肽比非P M I 组更高[117(30,169)pg/ml比48.0(23.0,83.5)pg/ml,P=0.021,表1]。所有患者围术期用药方案均基于当前指南[8],应用阿司匹林联合氯吡格雷或阿司匹林联合替格瑞洛双联抗血小板治疗。PMI组患者血管活性药物应用比例比非PMI组更高(30.0%比9.4%,P=0.012,表2)。

表1 两组患者基线特征、实验室检查及围术期用药方案比较

表2 两组患者围术期用药方案比较[例(%)]
2. 2 两组患者解剖学特点及手术操作比较
两组患者病变解剖学特点及采用的手术策略比较,差异均无统计学意义(均P>0.05,表3)。PMI组患者手术时间[140.00(82.25,174.75)min比82.00(55.00,118.00)min,P<0.001]及选择支架总长度[106.75(86.50,138.00)mm比77.25(56.00,99.50)mm,P=0.021]比非PMI组更长,差异均有统计学意义。PMI组边支血管损伤(20.0%比1.5%,P=0.001)及TIMI血流分级<Ⅲ级(20.0%比6.3%,P<0.001)与非PMI组相比发生率更高,差异均有统计学意义(表4)。

表3 两组患者病变解剖特点比较
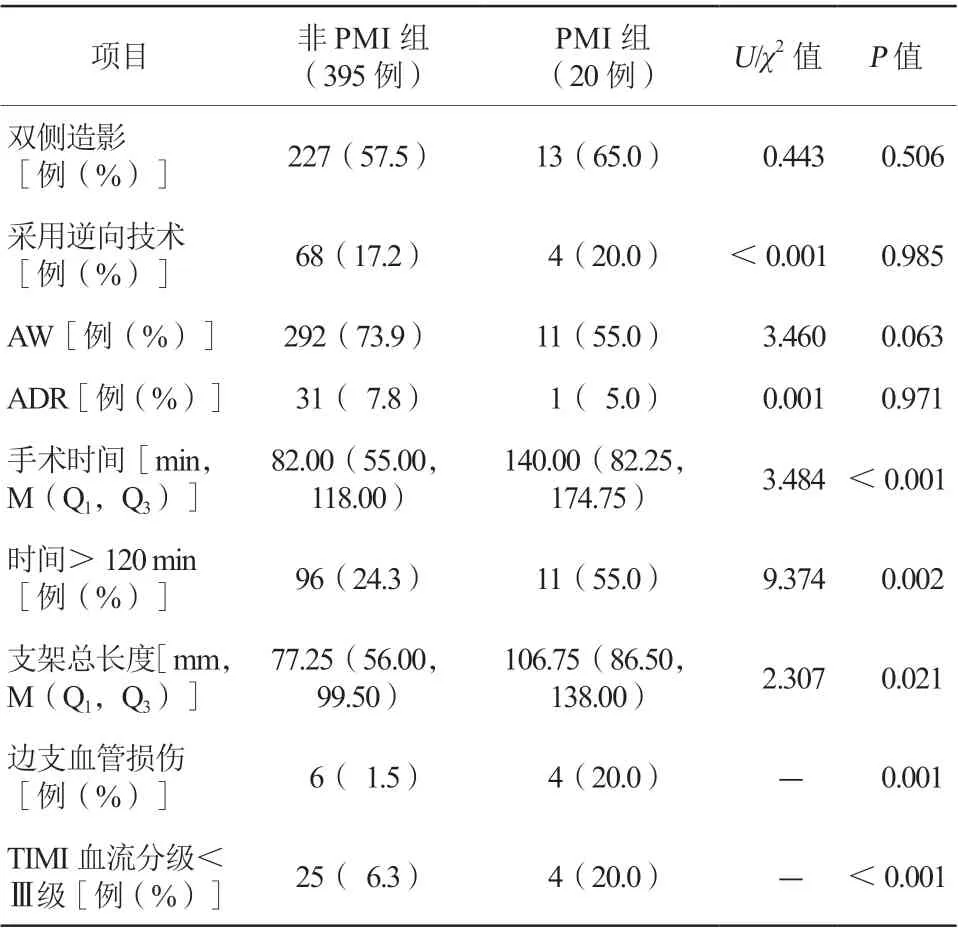
表4 两组患者手术操作特点比较
2. 3 两组患者术后实验室检查比较
术 后P M I 组 患 者c T n I[4.2 4 5(2.7 4 5,11.273)ng/ml比0.195(0.050,0.608)ng/ml,P<0.0 01]、h s-T n I[4 2 7 5.7 5(1 581.7 5,1 2 0 2 1.2 5)n g / m l 比1 5 0.4 0(4 0.4 0,572.80)ng/ml,P<0.001]及CK-MB[35.700(19.4 7 5,7 4.4 2 5)n g/m l比2.9 0 0(1.6 0 0,6.600)ng/ml,P<0.001]均明显高于非PMI组,差异均有统计学意义(表5)。

表5 两组患者术后实验室检查比较[M(Q1,Q3)]
2. 4 两组患者并发症发生率比较
P M I 组供血血管闭塞(1 0.0%比0.3%,P=0.006)及休克(30.0%比9.4%,P=0.010)发生率显著高于非PMI组。两组其余主要并发症发生率比较,差异均无统计学意义(均P>0.05,表6)。
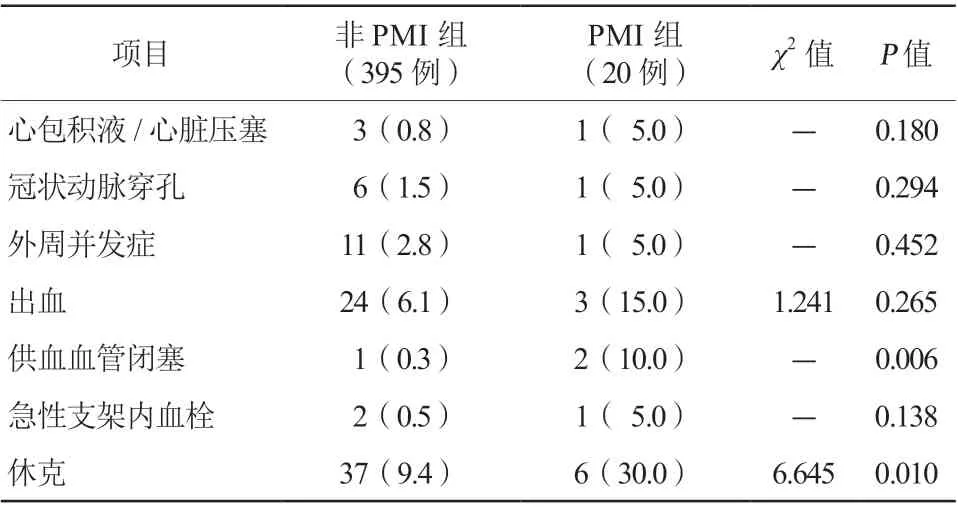
表6 两组患者并发症发生率比较[例(%)]
2. 5 PMI的危险因素分析
根据后退法筛选自变量,并结合临床经验,以P<0.05作为变量的筛选标准。输入变量包括:供血血管闭塞、边支血管损伤、术后TIMI血流分级<Ⅲ级、手术时间、休克、支架长度,最后进行了3步,剩余4个变量。Logistic多因素回归分析结果显示,供血血管闭塞(OR48.818,95%CI2.365~1 007.888,P=0.012)、边支血管损伤(OR20.332,95%CI4.439~93.132,P<0.01)、术后TIMI血流分级<Ⅲ级(OR33.310,95%CI6.209~178.689,P<0.01)及支架长度(OR1.020,95%CI1.005~1.035,P=0.011)与PMI密切相关(表7)。

表7 围术期心肌梗死多因素Logistic 回归分析
3 讨论
3. 1 CTO病变血运重建后PMI定义及发生率
既往研究发现,心肌标志物升高与PCI术后心血管事件风险的增加明显相关[9]。虽然,不同研究检测的心肌标志物和应用的诊断标准不完全一致,但是,大部分研究都发现围术期心肌损伤与不良预后相关[4,10]。
近年来,CTO-PCI取得了显著的进展,其成功率在经验丰富的PCI中心从50%~70%提高到90%以上[6]。与非CTO-PCI相比,CTO病变的斑块负荷重、操作复杂、手术造成的冠状动脉损伤更重,PMI发生的风险更高。然而,既往研究应用不同诊断标准、测量不同心肌标志物及纳入不同患者群,PMI发生率存在明显差异。
关于PMI,目前临床工作中最常使用的有2018年修订的第四次全球心肌梗死统一定义(Fourth Universal Definition of Myocardial Infarction,4th UDMI)[11]及2013年美国心血管造影和介入学会(The Society for Cardiovascular Angiography and Interventions,SCAI)定义[12]。两者的区别在于SCAI定义的标准更高。多项研究已经显示,全球PMI定义与PCI预后的相关性不佳,其临床及科研价值有限,这也是全球PMI定义备受争议的根源。
4th UDMI将PMI定义为4a型心肌梗死:对于术前心肌酶阴性的患者,在PCI术后48 h内cTnI水平升高>5倍参考值上限可诊断PMI。4th UDMI定义的PMI阈值低,将更多患者诊断为PMI。在本队列中,有51.1%(212例/415例)的患者PCI术后48 h内cTnI水平升高>5倍参考值上限,依据4th UDMI,PMI发生率明显高于CTO-ARC定义下PMI发生率。
SCAI定义结合大量循证医学证据,其PMI诊断阈值更高,即:(1)PCI术后48 h内CK-MB升高>10倍参考值上限和(或)cTnI升高>70倍参考值上限;(2)CK-MB升高>5倍参考值上限和(或)cTnI升高>35倍参考值上限伴心电图上2个连续导联新发病理性Q波或左束支传导阻滞。采用这一定义后,PMI发生率明显下降,目前已有多项大型临床试验验证了SCAI定义的PMI与患者远期不良预后关系更为密切[4,13-14]。
2021年,CTO-ARC参考大量围绕CTO-PCI开展的相关临床试验,在SCAI定义基础上,将hs-TnI纳入诊断标准[9]。与其他诊断标准相比,CTO-ARC在临床应用中更为灵活,更能满足临床科研需要,在围术期动态检测CK-MB、cTnI或hs-TnI任意一项都可作为诊断PMI的依据。然而CTO-ARC并未说明诊断PMI的首选心肌标志物。Wang等[15]在左主干PCI的队列中发现CK-MB对患者远期预后的预测价值优于cTnI,更推荐使用CK-MB诊断PMI。在CTOPCI中,对于CK-MB及cTnI二者中谁作为诊断PMI的首选心肌标志物,未来仍需进一步研究。
3. 2 CTO病变血运重建后PMI发生机制
PMI可由血流减低、微血管功能障碍、血管收缩等引起,最终导致的心肌血流灌注不足是PMI发生的共同机制[16]。
CTO-PCI手术操作复杂,与非CTO-PCI相比,PMI发生率更高[17]。CTO-PCI经常使用的重回真腔技术需要导丝等器械进入血管内膜下,跨越闭塞段后重回真腔。然而,该类技术虽然能够提升手术成功率,却可导致冠状动脉内夹层和血肿,压迫边支血管开口,进而导致边支血管丢失。另一方面,CTO病变通常弥漫、斑块负荷重且容易累及边支血管,在手术中往往需要多次以高压力释放球囊,可引起血管夹层,导致边支血管损伤的风险增加。球囊扩张时,斑块可沿血管长轴方向发生移位,移位的斑块可影响边支血管血流,甚至能造成分支血管闭塞[18]。供血血管闭塞是CTO病变血运重建PMI发生的重要原因。在CTO-PCI中,若操作不当导致供血血管闭塞,不仅导致其原供血区域缺血,还使得CTO病变区域血流受到影响,若处理不及时,可导致梗死区域迅速扩大,造成PMI。术后TIMI血流分级<Ⅲ级是PMI发生的危险因素。由于夹层、血肿以及分支血管丢失,使得原闭塞段开通后血流减低,无法为相关供血区域提供充足的灌注,诱发PMI。
另外,本队列研究还发现支架长度与PMI密切相关。既往研究发现,CTO-PCI中置入支架总长度通常超过病变总长度[19]。在CTO-PCI中,需要增加支架长度来覆盖夹层、血肿,因此支架越长,提示靶血管夹层、血肿情况可能越严重,PMI发生风险就越高。
3. 3 CTO病变血运重建后PMI预防措施
CTO病变合并分叉病变在临床中十分常见。既往研究已证实,边支血管无保护可有力地预测分支闭塞。因此,当CTO病变合并分叉病变时,可使用拘禁导丝或球囊技术保护分支[18],避免非CTO血管损伤。CTO-PCI应尽可能采取对侧造影,避免正向推注对比剂引起血肿形成或扩大。手术中尽可能减少夹层以及血肿形成,缩短内膜下路径长度,还可使用腔内影像学技术帮助寻找血管真腔。
另外,充分的围术期抗凝以及抗血小板方案对预防PMI至关重要。手术中应监测激活凝血时间,有研究建议,应用逆向策略时激活凝血时间应>350 s,正向策略时激活凝血时间>300 s,以降低冠状动脉内和手术器械血栓形成的风险[17]。在术前检测血小板聚集率或抑制率,若不达标则及时更换抗血小板方案。 若术中出现血栓、慢血流等情况,建议应用糖蛋白Ⅱb/Ⅲa抑制剂减低缺血风险[20]。另外,既往研究证实在围术期强化他汀类药物治疗、强化抗炎和抗血小板聚集,可减少PMI风险[16]。
3. 4 本研究的局限性
本研究病例数相对少,但仍然是目前关于CTO PMI病例数最多的研究之一。本研究为单中心回顾性队列分析,患者选择的偏倚无法完全排除,很多患者由于缺少术后心肌酶的测定而未能入选队列。此外,研究并未纳入手术失败、支架内闭塞及冠状动脉旁路移植术术后等非De Novo病变。这些特殊病例可能也会影响结果的准确性。因此,本研究得出的结论具有一定局限性。
应用CTO-ARC关于PMI的最新定义,本队列研究发现,CTO病变在完成血运重建后PMI发生率为4.8%,供血血管闭塞、边支血管损伤、术后TIMI血流分级<Ⅲ级及支架长度与CTO病变血运重建后PMI密切相关。在未来,仍需要更大样本量的研究验证这一定义下PMI与远期预后的关系。
利益冲突所有作者均声明不存在利益冲突
