房间隔缺损封堵器在卵圆孔未闭合并房间隔瘤中的有效性及安全性研究
2022-09-05官政燕郑璐璐方晗孙泽琳裴志芳刘凤姣邹隽麟吴婷婷钟旭陈晓彬
官政燕 郑璐璐 方晗 孙泽琳 裴志芳 刘凤姣 邹隽麟 吴婷婷 钟旭 陈晓彬
卵圆孔未闭(patent foramen ovale,PFO)是出生后原发隔与继发隔未完全融合形成的裂隙样通道,存在于2 5%左右的成年人群中,是成人右向左分流(right-to-lef t shunt,RLS)最常见的原因[1]。越来越多的证据表明,PFO可导致反常栓塞,后者与不明原因卒中、偏头痛等疾病的发生相关。介入封堵PFO通过阻断该途径,使患者获益[2-3],尤其是高危PFO患者[4]。房间隔瘤(atrial septal aneurysm,ASA)是房间隔形成的囊袋状膨出,PFO合并ASA时通常分流量更大[5]。研究发现ASA是PFO相关卒中复发的预测因子[6],PFO封堵后残余右向左分流(residual right-to-lef t shunt,rRLS)与卒中复发风险增加[7]及偏头痛负担不减轻[8]相关。Amplatzer PFO 封堵器是目前最安全、有效的封堵器[9]。研究发现国产Cardi-O-f ix PFO封堵器疗效与Amplatzer PFO封堵器类似[10-11]。刘文娟等[12]研究发现,使用PFO封堵器治疗的PFO患者中,合并ASA的患者完全封堵率低于单纯PFO患者。相关指南也推荐,对于复杂高危PFO,可选择房间隔缺损封堵器(atrial septal defect occluder,ASDO)进行封堵[13]。已有研究结果显示国产特制小腰大边型ASDO在房间隔缺损(atrial septal defect,ASD)合并ASA患者中的有效性及安全性[14],但截至目前,ASDO在PFO合并ASA患者中应用的相关研究报道仍较少。因此,本研究旨在比较Cardi-O-f ix PFO封堵器与国产小腰大边型ASDO在PFO合并ASA患者中的有效性及安全性。
1 对象与方法
1. 1 研究对象
回顾性分析2019年1月至2020年12月在中南大学湘雅医院心内科行经导管介入封堵治疗的PFO合并ASA患者共70例。纳入标准:(1)经胸超声心动图(transthoracic echocardiography,TTE)及经食管超声心动图(t ra nsesophageal echocardiography,TEE)明确诊断为PFO合并ASA或房间隔摆动>10 mm;(2)右心声学造影阳性,可见中-大量分流。排除标准:(1)随访资料不全的患者;(2)有抗血小板或抗凝治疗禁忌证;(3)生理期或妊娠期女性;(4)发生急性卒中2周内。
1. 2 检查方法
所有患者术前均行TTE和经胸超声心动图声学造影(contrast transthoracic echocardiography,c-TTE)检查,并行TEE证实为PFO合并ASA,排除ASD。采用飞利浦IE33超声心动图诊断仪,TTE探头频率2~4 MHz,TEE探头频率4~7 MHz。由经过专门培训的超声心动图医师完成操作。多切面探查PFO形态、大小及结构特征,排除明显心脏异常,确定是否合并ASA。超声心动图诊断ASA标准:心动周期中原发隔向左或右摆动偏离中线>10 mm,且基底直径>15 mm[15]。右心声学造影检查时TTE选择心尖四腔心切面,指导患者做有效的Valsalva动作,经左侧肘正中静脉“弹丸式”注射激活生理盐水(1 ml空气+1 ml患者自体血+8 ml生理盐水混合),分别观察静息状态下及Valsalva动作后左心微气泡显影情况。根据左心微气泡数量对RLS分级:无RLS,左心房内无显影;少量RLS,左心房内可见<10个微气泡;中量RLS,左心房内微气泡≥10个且<30个;大量RLS,左心房内可见≥30个微气泡,或左心充满微气泡[16]。左心显影在右心显影后3~5个心动周期内,则RLS多来源于PFO,若超过5个心动周期多考虑来源于肺动静脉瘘[17]。本研究中进一步行PFO封堵治疗的患者均在c-TTE检查下为大量RLS。根据第三版国际头痛疾病分类诊断偏头痛,不明原因卒中通过计算机断层显像、磁共振成像或脑血管造影等影像学检查和神经病学专家诊断。
1. 3 封堵器及介入治疗方法
本研究选用 Cardi-O-Fix PFO封堵器(北京华医圣杰医疗公司生产)或 ASDO(上海形状记忆合金材料有限公司生产)。Cardi-O-Fix PFO封堵器金属网的材料为镍钛合金,阻流体的材料为100%聚酯无纺布,缝合线材料为涤纶,具有18/25 mm、25/35 mm、30/30 mm等直径型号。ASDO为特制型小腰大边ASD封堵器,由镍钛合金材料丝编织,内由聚四氟乙烯补片制成,具有8 mm、10 mm、12 mm、14 mm、16 mm、18 mm、20 mm、22 mm、24 mm等直径型号。封堵器选择主要综合PFO大小、菲薄卵圆窝长度、ASA基底部大小及毗邻结构等因素,选用尽可能完全覆盖ASA宽大的基底部且对毗邻结构未造成影响的封堵器。
所有的封堵器置入由同一经验丰富的心脏介入医师实施。患者术前48 h口服阿司匹林3~5 mg/kg、每日1次,氯吡格雷50~75 mg、每日1次。局部麻醉后行股静脉穿刺,送入动脉鞘管,推注肝素后右心导管行右心房或卵圆窝造影,了解PFO形态、大小,同时定位,在X线透视和超声心动图监测下置入封堵器并观察有无RLS,观察封堵器不影响房室瓣的关闭,无心包积液及房室传导阻滞,手术成功后撤出鞘管,压迫止血。术后预防性使用抗生素,低分子肝素100 U/kg皮下注射、每12 h给药1次预防栓塞。术后根据体重继续口服阿司匹林和氯吡格雷(每日1次),维持6个月。
1. 4 随访
术后1个月、3个月、6个月、12个月均门诊复诊行c-TTE及心电图检查,评估rRLS及心律失常情况;通过电话及门诊随访记录患者术后不良事件(卒中、死亡)、术后手术并发症发生率及其他健康情况等。有效封堵定义为随访c-TTE无rRLS或少量rRLS[3]。
1. 5 统计学分析
所有数据采用 SPSS 22.0统计软件进行分析。符合正态分布的连续性变量应用(±s)表示,组间比较采用独立样本t检验。计数资料以构成比表示,组间比较采用卡方检验或 Fisher 确切概率法。PFO的RLS程度比较采用非参数的秩和检验(Mann-WhitneyU检验)。以P<0.05为差异有统计学意义。
2 结果
2. 1 基线临床资料(表1)
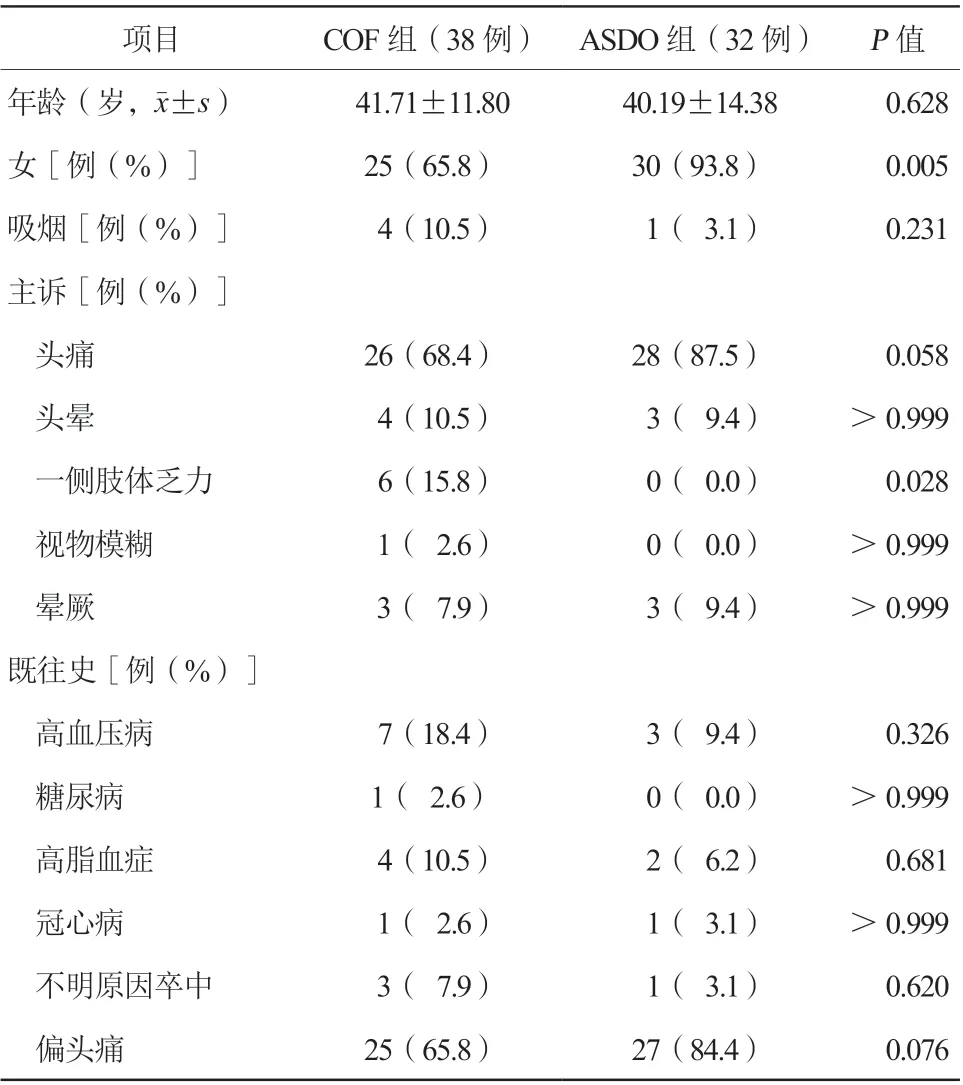
表1 两组患者基本临床资料的比较
70例接受PFO封堵术的患者,其中女55例(78.6%),平均年龄(41.01±12.97)岁,分别置入Cardi-O-fix PFO封堵器(COF组,38例)或ASDO(ASDO组,32例)。两组患者在年龄、吸烟、既往史等方面比较,差异均无统计学意义(均P>0.05)。
2. 2 基线超声特征及介入封堵术情况(表2)

表2 两组患者的基线超声特征和手术情况
38例置入Cardi-O-fix PFO封堵器,其中11例型号为18/25 mm,23例型号为25/35 mm,4例型号为30/30 mm;32例置入ASDO,其中1例型号为8 mm,5例型号为10 mm,8例型号为12 mm,10例型号为14 mm,5例型号为16 mm,1例型号为18 mm,1例型号为20 mm,1例型号为24 mm。术前有静息分流在COF组与ASDO组患者中分别为16例(42.1%)和14例(43.8%),差异无统计学意义(P=0.966),COF组患者ASA基底部直径小于ASDO组,差异有统计学意义[TEE:(21.46±4.87)mm比(25.09±3.68)mm,P<0.0 0 1;T T E:(2 2.1 4±5.1 4)m m 比(24.88±3.42)mm,P=0.010)]。在封堵适应证方面,两组患者不明原因卒中的差异有统计学意义(21.1%比3.1%,P=0.027)。70例患者均达到手术成功。1例应用Cardi-O-fix PFO封堵器(型号:25/35 mm)的患者出现术后短暂头晕加重,另1例术后短暂头痛加重;2例应用ASDO(型号:A12B8 12 mm)的患者出现穿刺点血肿。两组均无动静脉瘘、假性动脉瘤、心包积液、心脏压塞、封堵器移位脱落等手术并发症发生。
2. 3 两组患者的随访情况(表3)
70例患者中,55例患者完成1个月随访,47例患者完成3个月随访,58例患者完成6个月随访,49例患者完成12个月随访。其中,ASDO组发生房性早搏及室性早搏各1例,均为偶发性早搏。随访期间无复发性卒中及死亡事件发生,两组均未发生心房颤动、心房扑动、封堵器脱落、移位、侵蚀等并发症。COF组术后1个月、3个月、6个月和12个月的有效封堵率分别为62.1%、84.0%、86.7%、92.6%,ASDO组分别为42.3%、77.3%、92.8%、90.9%,两 组患者在术后1、3、6和12个月的有效封堵率及rRLS发生率的比较差异均无统计学意义(均P>0.05,表3、图1)。ASDO组术后12个月有2例患者行c-TTE显示大量rRLS,均行TEE提示封堵器贴壁不良,无ASD及封堵器导致房间隔破裂等情况。

图1 两组患者有效封堵率(A)及残余分流率(B)的比较

表3 两组患者术后残余分流随访情况[例(%)]
3 讨论
PFO封堵术显示了良好的有效性及安全性,但多达25%的患者在PFO封堵术后可观察到rRLS,近10%的患者表现为中至大量rRLS[18-19]。有证据表明:PFO封堵后的rRLS与卒中复发的风险增加相关[7];在偏头痛患者中,有rRLS者偏头痛症状改善程度低于无rRLS者[8]。PFO合并ASA或PFO≥8 mm是高危PFO的常见类型[20],高危PFO封堵术是介入治疗的一个难点。若封堵器选择不合适,则可能导致封堵器贴壁不良,或封堵器不能完全覆盖膨出瘤,造成封堵器与房间隔存在夹角及房间隔摆动,不利于封堵器内皮化,使rRLS[21]、封堵器移位脱落[22]和二次手术风险增加[23]。有研究表明,在使用PFO封堵器的患者中,PFO合并ASA的患者术后rRLS发生率高于单纯PFO的患者[12,21]。另有研究报道在PFO封堵术后有rRLS的患者中,29.2%患者因合并ASA或原发间隔活动度过大,选择了PFO 18/25 mm封堵器而产生了封堵器边缘rRLS[24]。亦有病例报道显示,PFO合并ASA患者使用25 mm和35 mm PFO封堵器后出现房间隔切割,导致继发型ASD[25]。
在进行PFO封堵时应使封堵器左右盘面尽量完全覆盖并固定ASA基底部及菲薄摆动区,力求封堵器贴壁良好。本研究表明,ASA基底部较宽时,用PFO封堵器可能不一定能完全覆盖ASA左心房面,导致未被封堵器固定的ASA部分仍会摆动,封堵器难以与摆动的ASA完全愈合并可能出现封堵器边缘切割房间隔导致房间隔破裂和术后rRLS。本研究中当ASA基底部较宽及术中初次选用PFO封堵器但封堵器左盘偏小无法完全覆盖ASA的左心房面时,选用小腰大边型ASDO进行PFO封堵。本研究结果显示,ASDO组ASA基底部直径无论是在TTE还是TEE方法检测时,均大于COF组,差异有统计学意义(P≤0.01);ASDO通过封堵器腰部直径来封堵缺损,在本研究中,ASDO腰部的直径即为PFO实际大小(9.57±2.72)mm,本研究中有68.8%的ASDO腰部直径≥8 mm,表明ASA往往合并较大的PFO。因此,PFO封堵器细小的腰部与较大的PFO可能不匹配,而国产小腰大边型ASDO左右盘面展开直径均大于腰部,使其既能满足较大的PFO,又能用较宽的封堵器左盘面覆盖ASA的基底部,而且封堵器腰部支撑力的存在,能最大程度闭合PFO隧道,减少原发隔和继发隔不同频率的摆动,从而加速内皮化。且已有研究表明国产小腰大边型ASDO在ASA合并ASD/PFO患者的封堵中疗效满意[14]。本研究结果还显示,对于ASA基底部不大的PFO患者,用PFO封堵器也可以覆盖及固定ASA,表明对基底部较窄的ASA合并PFO患者,用常规的PFO封堵器是适合的。
本研究中,ASDO组术后12个月有2例患者仍有大量rRLS,TEE检查提示封堵器贴壁不良,2例患者所用封堵器型号分别为A12B8 18 mm和A12B8 16 mm,封堵器腰部直径分别为10.9 mm和13.2 mm,表明2例患者PFO偏大,所选ASDO型号也偏大。对于此类患者,建议密切关注术后封堵器贴壁问题。这也可能提示,只要封堵器左盘面能覆盖住ASA的左心房面,选ASDO不宜过大,避免导致封堵器贴壁不良。此外,本研究发现有部分患者临床表现为顽固性头晕,这类患者在封堵后头晕症状均得到不同程度改善,提示对于头晕为主诉的患者,在原因未明确时,应注重ASA及PFO的筛查。本研究结果显示,两组患者的rRLS均随着随访时间的延长逐渐较少,这和大多数研究结果一致[3,12]。术后12个月的有效封堵率均达90%以上,残余分流率均低于文献报道的25%左右[18],表明封堵器选择合适,在合理选择封堵器的情况下,两种封堵器具有相似的有效性。随访期间两组患者均无复发性卒中及死亡事件发生,未发生封堵器脱落、移位、侵蚀等并发症,安全性良好,但由于缺乏动态心电图,所以无法评估是否有阵发性心房颤动等心律失常情况的发生。此外,在本研究中,两组患者的性别比例存在差异,有可能是回顾性研究,非随机入组且样本量较小导致。
本研究局限性:(1)回顾性研究;(2)纳入的病例数量较少;(3)随访时间过短。对于PFO合并ASA的患者,ASDO疗效不劣于PFO封堵器,PFO合并ASA时往往PFO较大,对于ASA基底部较大、常规PFO封堵器无法覆盖固定整个ASA时,选用小腰大边型ASDO可能更合适,但封堵器型号也不宜过大。对于ASA基底部较小的,常规PFO封堵器能完全覆盖ASA左心房面时,选用PFO封堵器可能更合适。ASDO封堵PFO合并ASA的远期疗效有待进一步确认。
利益冲突所有作者均声明不存在利益冲突
