评价血管内冲击波碎石术在小型猪冠状动脉中应用的安全性
2022-09-05王菁马墩亮钟志安张斌
王菁 马墩亮 钟志安 张斌
冠心病患者的冠状动脉钙化十分常见,其检出率在冠状动脉造影中占38%,应用血管内超声(intravascular ultrasound,IVUS)检出率可高达73%[1-2]。中重度冠状动脉钙化病变常导致支架贴壁不良、冠状动脉穿孔等并发症发生并增加远期不良心血管事件[3-6]。体外冲击波碎石术成功治疗泌尿系结石有三十余年的临床经验。美国Shockwave Medical公司基于该技术原理研发了血管内冲击波碎石术(intravascular lithotripsy,IVL),利用冲击波圆周式、非聚焦的作用特点,对血管浅表、深层钙化或同心、偏心钙化均可有效震裂、松解钙化血管,达到球囊有效扩张,且不产生钙化碎屑堵塞远端微循环,在已完成的临床试验中取得了良好效果[7-9]。田峰等[10]在国内率先做了相应的个案报道,显示了IVL对冠状动脉钙化病变的显著疗效。目前该技术在国内尚属空白,深圳市赛禾医疗技术有限公司自主研发的冠状动脉冲击波碎石系统(图1 A),在体外实验结果已证实可碎裂石膏模型且不损伤正常人体组织(图1 B~D)。本研究旨在评价该国产冠状动脉冲击波碎石系统在正常小型实验猪冠状动脉中应用的安全性。

图1 冠状动脉冲击波碎石系统及体外测试 A. 冠状动脉冲击波碎石系统(①主机,②手柄,③冲击波冠状动脉球囊导管);B.冲击波冠状动脉球囊释放脉冲产生微泡;C.冲击波冠状动脉球囊释放脉冲碎裂石膏模型;D.冲击波冠状动脉球囊释放脉冲时对人体软组织无损伤
1 材料与方法
1. 1 实验动物
正常巴马小型猪(实验猪)12头,雌雄不限,每头体质量为35~55 kg,由东莞松山湖明珠实验动物科技有限公司[实验猪生产许可证号:SCXK(粤)2017-0030]提供。动物实验方案已得到广东省人民医院医学研究伦理委员会通过(伦理号:KY-D-2021-359-01),实验猪均享受动物福利。
1. 2 实验场地及合作单位
动物实验场地在深圳市领先医疗服务有限公司的动物实验中心介入导管室。合作单位为深圳市赛禾医疗技术有限公司。
1. 3 实验用球囊
实验用球囊包括两种类型:LiqMagic C14冲击波冠状动脉球囊和雅培NC TREK RX 冠状动脉球囊。冠状动脉冲击波碎石系统由深圳市赛禾医疗技术有限公司提供。
1. 4 动物分组
12头实验猪的36支冠状动脉随机平均分为两组,实验组和对照组分别有3支和7支冠状动脉因直径小于2.5 mm而放弃,最后入选实验组(冲击波冠状动脉球囊组)和对照组(雅培非顺应性球囊组)的冠状动脉分别为15支和11支。12头实验猪按1∶1∶1分为三组,每组4头,分别于术后0 d、7 d和28 d复查冠状动脉造影,并处以安乐死后解剖取材(表1)。
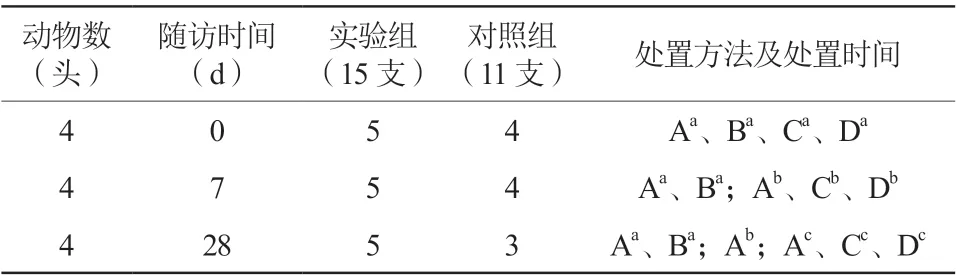
表1 实验分组、随访、处置方法及处置时间
1. 5 手术过程
术前3 d起,每头实验猪饲喂氯吡格雷(75 mg、每日1次)和阿司匹林(100 mg、每日1次)。手术当天采用舒泰50(每瓶含替来他明125 mg和唑拉西泮125 mg)肌内注射麻醉(5 mg/kg)。常规消毒铺巾,穿刺右股动脉,置入6 F血管鞘,耳缘静脉给予肝素钠200 IU/kg。经鞘管送入6 F JL、JR指引导管进行左冠状动脉及右冠状动脉造影,送入工作导丝至靶血管,于冠状动脉内注射200 μg硝酸甘油后沿导丝送入IVUS导管测量血管各项指标,根据血管直径选择1∶1大小的两组球囊。
实验组球囊操作步骤:打开主机电源,将冲击波冠状动脉球囊导管与主机连接,主机显示屏显示导管规格和剩余放电次数,使用压力泵抽取稀释的对比剂(生理盐水和对比剂比例为1∶1)对球囊进行充分排气,随后球囊保持负压沿导丝输送至冠状动脉内,以4 atm(1 atm=101.325 kPa)扩张球囊,先按下主机的治疗键,再按住手柄的控制键,主机开始发放脉冲(1 Hz),10次脉冲为1个周期,每2个周期有10 s间隔,每轮脉冲周期结束后需对球囊充分排气,重复上述操作直至完成80次脉冲发放。
对照组球囊沿工作导丝送至目标位置,110%原始大小扩张,持续30 s;两组球囊扩张时行冠状动脉造影,确认球囊远端无血流通过;撤出后再次使用IVUS记录相应数据,并再次进行冠状动脉造影确认无血管夹层、穿孔、血栓形成且前向血流心肌梗死溶栓治疗试验(thrombolysis in myocardial inf arction,TIMI)血流分级Ⅲ级。每头实验猪术后3 d 给予头孢噻呋钠预防感染(5 mg/kg),并继续饲喂阿司匹林(100 mg、每日1次)和氯吡格雷(75 mg、每日1次)至随访终点。
1. 6 IVUS检查
采用i L a b 血管内超声显像系统(美国,波士顿科学公司),I V U S 导管为机械旋转型的OptiCross导管,以30帧/秒的速度成像,采用自动回撤IVUS导管(0.5 mm/s)。球囊扩张前后均使用IVUS测量靶血管直径、内弹力膜面积和外弹力膜面积。所有IVUS影像资料均记录保存由独立分析人员进行分析。
1. 7 病理形态学检查
标本取样后石蜡包埋,用Leica公司2135型切片机切片,切片厚度为4~5 μm。标本分别用苏木素-伊红(hematoxylin-eosin,HE)染色、弹力纤维(维多利亚蓝)染色、Masson染色和AB-PAS染色四种方法进行观察。采用Image Pro Plus 6.0软件分别测量外弹力膜面积、内弹力膜面积和管腔面积,血管内膜面积与中膜面积的比值通过公式计算:内膜面积/中膜面积=(外弹力膜面积-管腔面积)/(外弹力膜面积-内弹力膜面积),以此评价术后血管内膜增生情况。通过损伤积分来判断血管损伤程度:0分,无损伤;1分,内皮脱落、中膜及内外弹力膜完整;2分,内皮脱落及内弹力膜断裂,中膜及外弹力膜完整;3分,内皮脱落、内弹力膜及中膜断裂,外弹力膜完整;4分,内皮脱落、中膜及内外弹力膜断裂[11]。
1. 8 扫描电子显微镜检查
标本取样后,使用2.5%戊二醛固定后梯度乙醇脱水,然后使用临界点干燥仪干燥,在血管表面喷涂铂金,放至扫描电子显微镜下观察血管内皮细胞。
1. 9 统计学分析
实验数据采用SPSS 26.0进行统计学分析。连续型变量数据均以均数±标准差表示,参数数据组间比较采用双侧t检验。以P<0.05为差异有统计学意义。
2 结果
2. 1 冠状动脉造影结果
所有实验猪术后均正常存活至随访终点。两组靶血管术中造影未见血栓、夹层及穿孔发生,于各自随访终点复查冠状动脉造影,结果显示所有实验猪冠状动脉管腔通畅,未见夹层、穿孔、狭窄或闭塞发生,前向血流TIMI血流分级Ⅲ级(图2)。
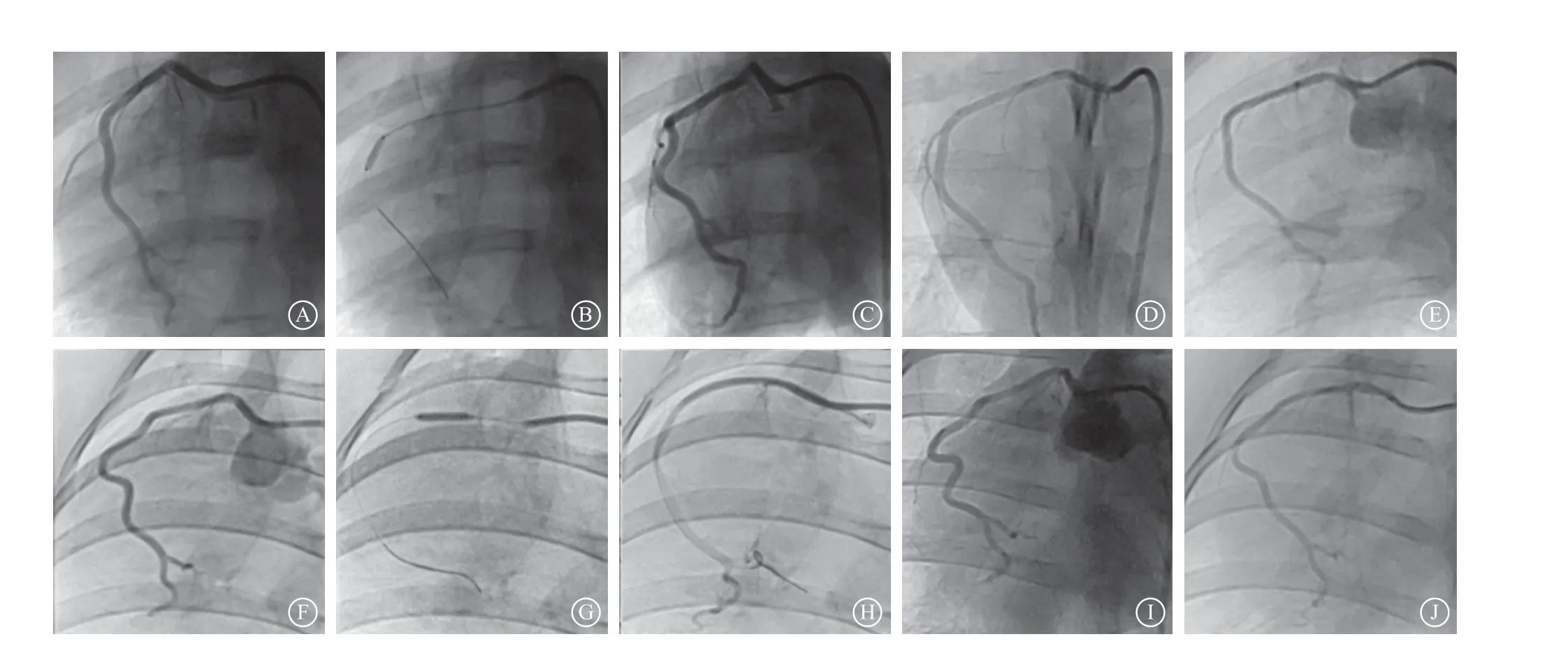
图2 实验组和对照组冠状动脉手术过程及术后各时期随访冠状动脉造影结果 A~E.实验组(A. 术前冠状动脉造影,B. 使用冲击波冠状动脉球囊造影,C. 球囊释放脉冲后造影,D. 术后7 d 冠状动脉造影,E. 术后28 d 冠状动脉造影);F~J.对照组(F. 术前冠状动脉造影,G. 使用普通球囊造影,H. 球囊扩张后造影,I. 术后7 d 冠状动脉造影,J. 术后28 d 冠状动脉造影)
2. 2 实验组心电图及血压变化情况
冲击波冠状动脉球囊释放脉冲时可见在正常心电节律下规律性地出现插入性脉冲波,未见诱发心律失常,结束释放脉冲后心电图恢复正常节律,整个过程血压无变化。
2. 3 IVUS检查结果及定量分析
两组靶血管在球囊扩张前后IVUS检查均未见冠状动脉夹层、穿孔、血肿及血栓发生(图3)。由IVUS定量分析结果可见,球囊扩张前实验组和对照组血管直径[(2.82±0.45)mm比(2.81±0.30)mm,P=0.429]和球囊直径[(2.80±0.25)mm比(2.73±0.26)mm,P=0.642]比较,差异均无统计学意义。球囊扩张后,实验组和对照组内弹力膜面积[(6.36±1.61)mm2比(6.04±1.60)mm2,P=0.843]、外 弹 力 膜 面 积[(6 . 9 0±1. 7 1)m m2比(6.54±1.67)mm2,P=0.769]、内弹力膜面积/外弹力膜面积[(0.92±0.02)比(0.92±0.02),P=0.828]比较,差异均无统计学意义(表2)。
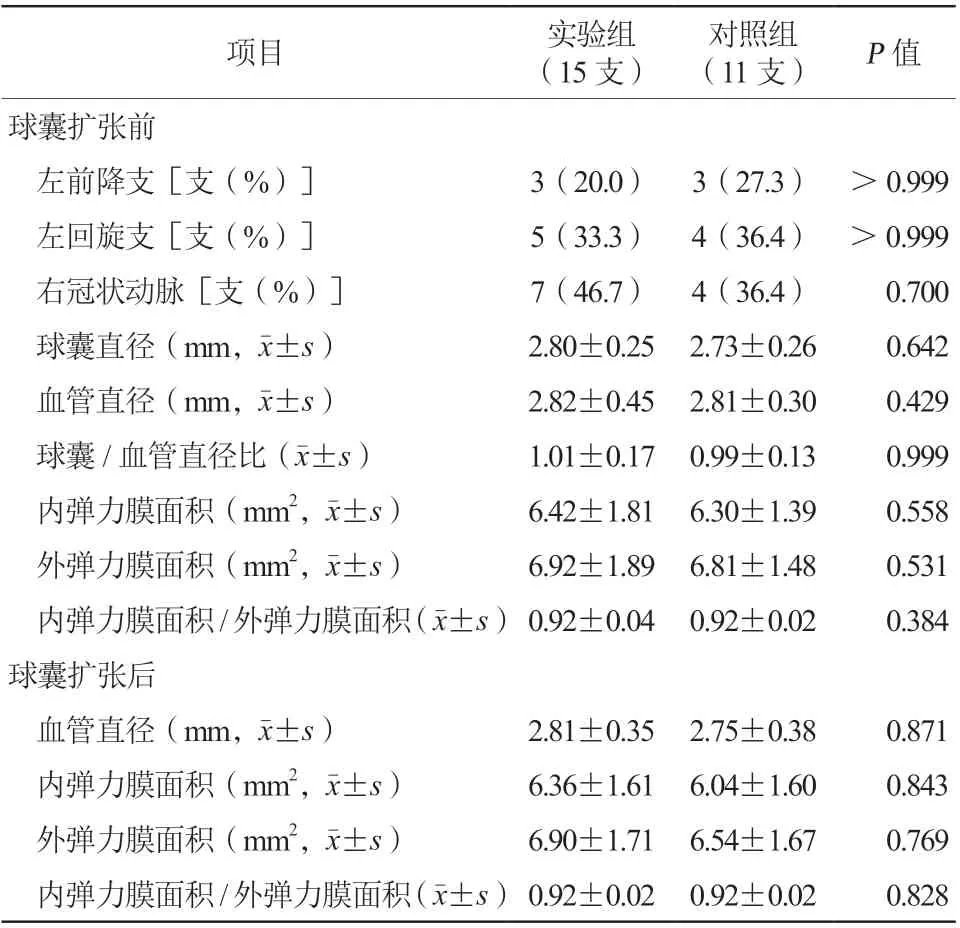
表2 血管内超声检查和定量分析
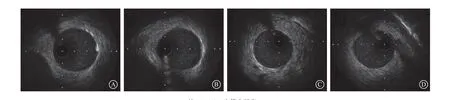
图3 两组靶血管术前和术后IVUS 结果 A~B.实验组术前IVUS 及术后IVUS;C~D.对照组术前IVUS 及术后IVUS
2. 4 病理形态学检查
实验组和对照组分别于术后0 d、7 d和28 d取材,标本行病理学检查示:两组均可见内皮细胞脱落,部分标本内弹力膜和部分中膜肌纤维断裂,损伤处可见黏液聚集和胶原纤维增生,未见炎症细胞浸润、血栓形成、壁间血肿和外弹力膜断裂(图4~7)。术后0 d实验组病理损伤积分显著高于对照组[(1.80±1.10)分比(1.00±0.00)分,P<0.01];实验组和对照组损伤积分在术后7 d[(2.00±1.15)分比(2.25±0.96)分,P=0.271]和28 d[(1.60±0.89)分比(1.67±1.15)分,P=0.567]比较,差异均无统计学意义;所有实验组(15支)和对照组(11支)的病理损伤积分进行对比[(1.83±0.99)分比(1.64±0.92)分,P=0.323],差异无统计学意义。实验组管腔面积在术后28 d较对照组小[(0.28±0.15)mm2比(0.31±0.04)mm2,P=0.032],而内膜面积在术后7 d较对照组大[(0.07±0.06)mm2比(0.05±0.02)mm2,P=0.019](表3)。
表3 病理形态学定量分析(±s)
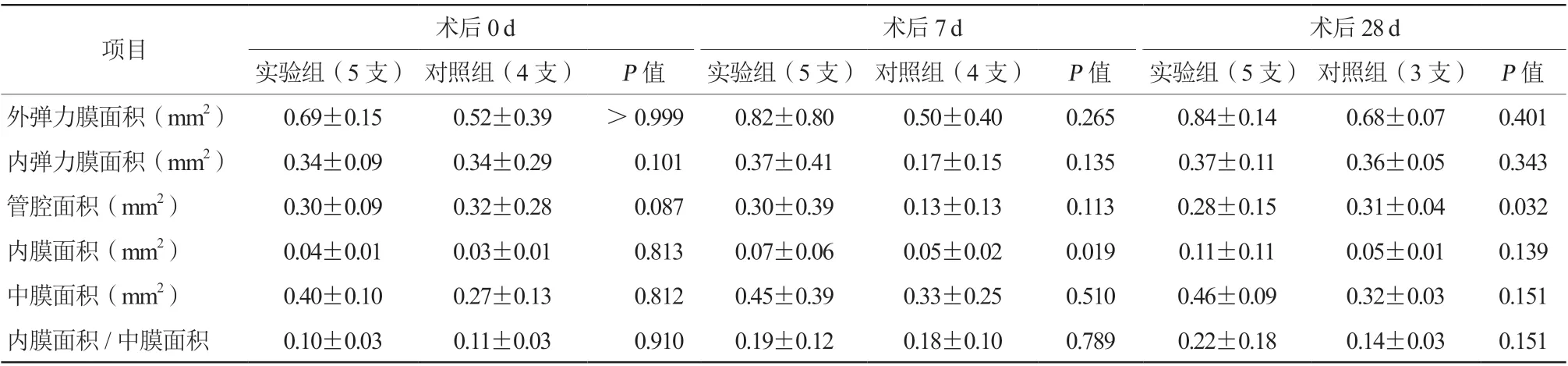
表3 病理形态学定量分析(±s)
项目 术后0 d 术后7 d 术后28 d实验组(5 支) 对照组(4 支) P 值 实验组(5 支) 对照组(4 支) P 值 实验组(5 支) 对照组(3 支) P 值外弹力膜面积(mm2) 0.69±0.15 0.52±0.39 >0.999 0.82±0.80 0.50±0.40 0.265 0.84±0.14 0.68±0.07 0.401内弹力膜面积(mm2) 0.34±0.09 0.34±0.29 0.101 0.37±0.41 0.17±0.15 0.135 0.37±0.11 0.36±0.05 0.343管腔面积(mm2) 0.30±0.09 0.32±0.28 0.087 0.30±0.39 0.13±0.13 0.113 0.28±0.15 0.31±0.04 0.032内膜面积(mm2) 0.04±0.01 0.03±0.01 0.813 0.07±0.06 0.05±0.02 0.019 0.11±0.11 0.05±0.01 0.139中膜面积(mm2) 0.40±0.10 0.27±0.13 0.812 0.45±0.39 0.33±0.25 0.510 0.46±0.09 0.32±0.03 0.151内膜面积/中膜面积 0.10±0.03 0.11±0.03 0.910 0.19±0.12 0.18±0.10 0.789 0.22±0.18 0.14±0.03 0.151
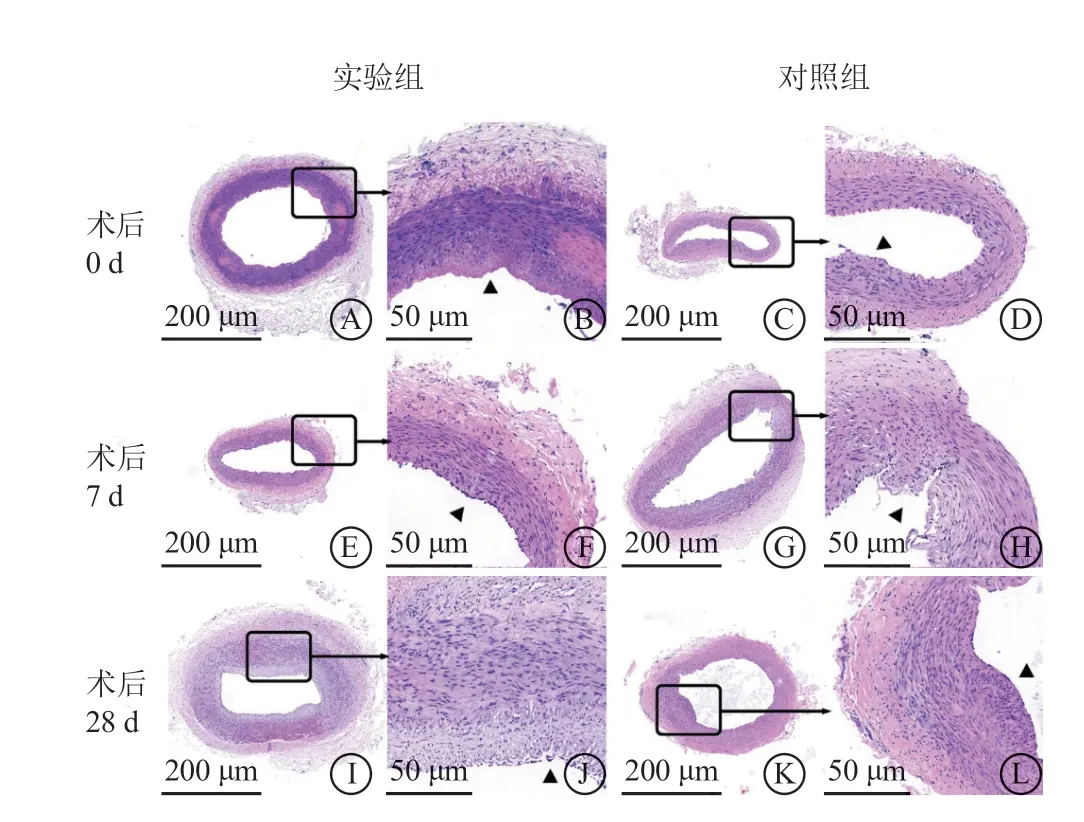
图4 两组靶血管各时期的苏木素-伊红染色结果(低倍×100,高倍×400) A~B.术后0 d 实验组内膜完全脱落(图B 黑三角所示),局部中膜增厚,外膜完整;C~D.术后0 d 对照组内膜完全脱落(图D黑三角所示);E~F.术后7 d 实验组管腔可见新生内皮细胞(图F 黑三角所示);G~H.术后7 d 对照组管腔内可见新生内皮细胞,局部内膜和部分中膜肌纤维断裂(图H 黑三角所示),外膜完整;I~J.术后28 d 实验组管腔变小,内膜和中膜明显增厚(图J 黑三角所示);K~L.术后28 d对照组内膜增生不明显,局部中膜增厚(图L黑三角所示)
2. 5 扫描电子显微镜检查结果
两组在术后0 d均出现血管内皮细胞脱落,少许血小板聚集;术后7 d和28 d两组血管内皮细胞新生,内膜完整,未见血小板聚集(图8)。
3 讨论

图6 两组靶血管各时期的Masson 染色结果(低倍×100,高倍×400) A~B.术后0 d 实验组内膜下局部黏液聚集(图B 黑三角所示);C~D.术后0 d 对照组内膜下少量黏液(图D 黑三角所示);E~F.术后7 d 实验组管壁全层未见明显胶原纤维增生(图F 黑三角所示);G~H.术后7 d 对照组部分内膜和中膜肌纤维断裂,部分中膜胶原纤维增生(图H 黑三角所示);I~J.术后28 d 实验组中膜肌纤维间胶原纤维增生明显,中膜与外膜间可见蓝色新月形胶原纤维增生(图J黑三角所示);K~L.术后28 d 对照组局部中膜肌纤维间可见胶原纤维少量增生(图L 黑三角所示)

图7 两组靶血管各时期的Masson 染色结果(低倍×100,高倍×400) A~B.术后0 d 实验组内膜下局部黏液聚集(图B 黑三角所示);C~D.术后0 d 对照组内膜下少量黏液(图D 黑三角所示);E~F.术后7 d 实验组管壁全层未见明显胶原纤维增生(图F 黑三角所示);G~H.术后7 d 对照组部分内膜和中膜肌纤维断裂,部分中膜胶原纤维增生(图H 黑三角所示);I~J.术后28 d 实验组中膜肌纤维间胶原纤维增生明显,中膜与外膜间可见蓝色新月形胶原纤维增生(图J 黑三角所示);K~L.术后28 d 对照组局部中膜肌纤维间可见胶原纤维少量增生(图L 黑三角所示)
本研究为评价IVL在活体动物中应用的安全性及可行性,研究表明:(1)IVL不破坏正常血管壁外膜,对内膜及中膜可造成一定损伤,术后可自行修复愈合;(2)冲击波冠状动脉球囊在发放脉冲时,心电图可见插入性干扰波,但未见诱发心律失常及血压变化。多项基于光学相干断层成像(optical coherence tomography,OCT)的结果提示,国外IVL设备能有效裂解冠状动脉钙化病变,扩大狭窄管腔,在不损伤正常血管的情况下,显著提高手术即刻效果[7-8]。本研究使用的IVL设备在体外实验提示类似有效性,但在体内应用的安全性仍缺乏相关数据。因此,本研究以正常活体猪的冠状动脉为研究对象,探讨IVL对正常组织的影响。考虑到使用OCT检查过程中需要通过对比剂成像,有扩大夹层的风险,影响实验结果,故而选择IVUS进行评估。手术即刻IVUS影像结果提示:两组靶血管未见冠状动脉夹层和穿孔表现,手术前后实验组和对照组血管直径和球囊直径差异亦无统计学意义。实验结果提示同等血管管腔下,冲击波冠状动脉球囊并不增加血管并发症的发生率,具备一定安全性。
在本研究中可观察到实验组和对照组冠状动脉有不同程度的内弹力膜撕裂和部分中膜肌纤维断裂。实验组冠状动脉内膜增生和中膜胶原纤维增生较对照组明显,管腔面积有一定程度缩小,但外膜完整,且无1例出现冠状动脉夹层和穿孔。病理损伤积分组间比较显示术后0 d实验组显著高于对照组(P<0.01);但两组损伤积分在术后7 d和28 d差异均无统计学意义。考虑血管损伤后的病理改变不随时间消失,为减少统计差异,将实验组和对照组所有靶血管的病理损伤积分进行比较,差异无统计学意义(P=0.323)。实验组冠状动脉病理标本可见内、外弹力膜完整,与外膜邻近的中膜可见部分肌纤维断裂,断裂处红色新月形胶原纤维增生(图5 J),这种现象可能与冲击波的特殊作用原理有关。由于两组靶血管标本在球囊扩张后未置入支架,标本的制备过程需要脱水,故导致血管标本体积缩小,测得数据较IVUS有一定差异,但不影响组间病理数据比对。实验组管腔面积在术后28 d较对照组小(P=0.032);内膜面积在术后7 d较对照组大(P=0.019)。既往的动物实验和尸检研究早已发现,经皮冠状动脉球囊扩张术后可导致血管内膜脱落和中膜撕裂,在修复过程中,新生内膜由于血管平滑肌细胞的增生可导致管腔狭窄[11-14]。因此,在球囊扩张病变后通常置入冠状动脉药物洗脱支架,保持血管通畅,抑制内膜增生[15]。
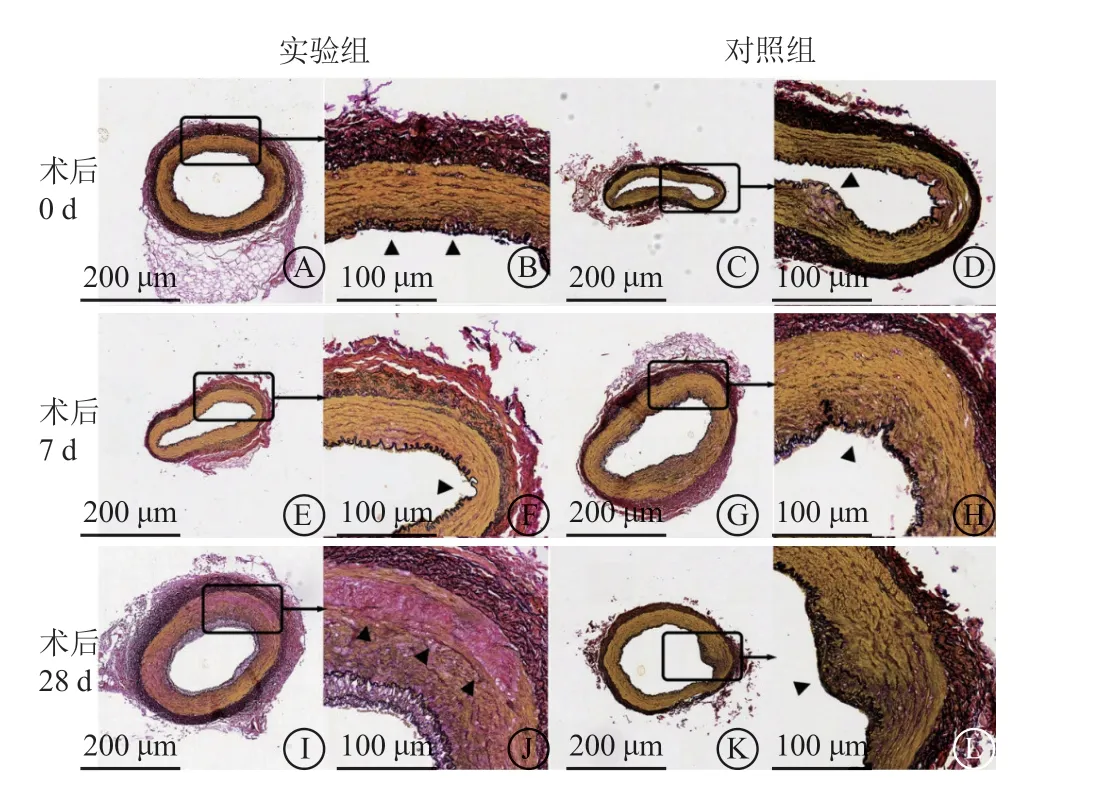
图5 两组靶血管各时期的弹力纤维染色结果(低倍×100,高倍×400) A~B.术后0 d实验组内弹力膜部分断裂(图B黑三角所示),外弹力膜完整;C~D.术后0 d 对照组内弹力膜局部褶皱减少断裂,局部中膜黏液聚集水肿(图D 黑三角所示),外弹力膜完整;E~F.术后7 d 实验组内弹力膜局部褶皱减少(图F 黑三角所示),外弹力膜完整;G~H.术后7 d 对照组内弹力膜局部排列紊乱,相对完整(图H 黑三角所示);I~J.术后28 d 实验组内、外弹力膜完整,与外膜邻近的中膜可见部分肌纤维断裂,红色新月形胶原纤维增生(图J 黑三角所示);K~L.术后28 d 对照组内弹力膜局部断裂,向中膜迁移(图L 黑三角所示),中膜局部增厚,外弹力膜完整(由广州医科大学附属第三医院病理科江庆萍医生提供)
一些个案报道IVL在应用中可诱发室性心律失常,这可能与机电耦合相关,在静息心率低于65次/分时容易诱发[16-17]。由于冲击波冠状动脉球囊发放的脉冲具有去极化功能,在右冠状动脉内应用时可能诱发心房颤动[18]。Disrupt CAD Ⅲ纳入了431例受试患者,其中植入起搏器的患者共27例,所有受试患者均未出现冲击波诱导的心律失常[8]。在本研究中可观察到冲击波冠状动脉球囊在释放脉冲时实验猪未见诱发心律失常,且血压无明显变化。

本研究存在一定局限性:首先,样本量较少;其次,缺乏冠状动脉钙化的动物模型进行有效性研究。本团队后续计划建立合适的动物冠状动脉钙化模型验证其有效性,但动物冠状动脉钙化模型的建立有一定难度,目前尚未成功。本实验结果达到预期,所有小型猪均正常存活,未发生手术相关并发症,说明冲击波冠状动脉球囊在正常小型实验猪冠状动脉中应用是安全可行的,为今后冲击波冠状动脉球囊开展临床研究提供了安全依据。
利益冲突所有作者均声明不存在利益冲突
