国产冠状动脉介入手术机器人在分叉病变中的临床应用与探讨
2022-09-05王鸣关韶峰干倩翟馨蓉谢晓亮刘市祺侯增广方唯一曲新凯韩文正
王鸣 关韶峰 干倩 翟馨蓉 谢晓亮 刘市祺 侯增广 方唯一 曲新凯 韩文正
随着我国居民生活方式日益变化,心血管疾病发病率逐年升高。据2021年《〈中国心血管健康与疾病报告〉概要》,2019年中国城市居民冠心病死亡率为121.59/10万,农村为 130.14/10万,2020年中国冠心病介入例数为1 014 266例[1],提示心血管防治任务极其严峻[2-3]。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是目前治疗冠心病的主要手段,其操作方式在过去40年来没有变化,介入医护人员一直处在放射暴露下用物理接触的方式操作各类导管、导丝,长时间射线下的暴露带来的电离辐射会给医护人员带来多方面的影响。有研究显示,介入辐射会引起放射性损伤,诸如白内障,脊柱、关节疾病,恶性肿瘤等[4]。为减少介入暴露带来的辐射,Beyar等[5]首先提出机器人辅助PCI的概念,并于2006年开启临床研究。其中PRECISE研究[6]首次采用CorPath 200冠状动脉介入手术机器人(Corindus Vascular Robotic,Natick,USA)辅助PCI,其操作成功率高达98.8%。研究证实机器人辅助PCI可显著缩短曝光时间,减少对介入医护人员的辐射剂量,基本实现PCI的有效操作。但由于机械结构的问题在需要强支撑或是多器械协同操作情况下仍然需要人为辅助完成手术。因此最新2代CorPath GRX介入机器人通过对指引导管的操控进一步加强了机器人辅助手术时各类器械递送过程中的支撑力。
虽然CorPath系统通过增加指引导管操作增强了支撑力,但只能操作一根导管、一根导丝,不能同时操作两根导管、两根导丝,无法适用于复杂性病变,例如分叉病变。目前国内尚无类似冠状动脉介入手术机器人系统。本课题组结合前期工作研发了一套可协同操作多器械的介入手术机器人以满足临床需求,并在功能上进行迭代[7-8]。本研究通过体外仿真冠状动脉模型及动物在体研究,比较冠状动脉介入手术机器人多器械递送操作(机器人组)与人工操作(人工组)在分叉病变中器械操作的可行性、有效性,同时研究该机器人在分叉病变中的应用前景。
1 材料与方法
1. 1 体外模型(图1)

图1 冠状动脉介入机器人辅助PCI 在体外模型中的验证 A.体外RCA 远段双支架;B. 3D 硅胶打印冠状动脉模型;C. RCA 远段双支架在冠状动脉模型的分布
1. 1. 1 实验对象 采用3D打印的断裂拉伸率为300%高透明软硅胶冠状动脉模型(型号PLXG1001,上海璞临医疗科技)为研究对象。模型内注入润滑液作为仿真血液,实验时加温至37℃,模拟人体内血液情况。
1. 1. 2 实验方法 将硅胶模型置于水平面的操作台上, 以右冠状动脉(right coronary artery,RCA)为靶血管,分别标记RCA近段(p-RCA)、中段(m-RCA)、远段(d-RCA),后降支(posterior descending branches,PD)中段(m-PD),左心室后支(posterior branches of left ventricular,PL)中段(m-PL)。术中时间定义:(1)导丝操控时间,即第1根导丝头端从p-RCA到m-PD的时间与第2根导丝头端从p-RCA到m-PL的时间之和,旨在评估导丝在单支无分叉血管的通过性,即导丝操控性;(2)导丝通过分叉时间,即第1根导丝头端从d-RCA到m-PD的时间与第2根导丝头端从d-RCA到m-PL的时间之和,旨在评估导丝在分叉病变中的通过性,即导丝分叉通过性;(3)导丝装配时间(第2根导丝),即自第1根导丝到达m-PD计时开始,手动装配第2根导丝,至第2根导丝到达RCA开口的时间,即导丝装配难易度;(4)器械装配时间,即第1枚支架穿第1根导丝末端至到达RCA开口的时间与第2枚支架穿第2根导丝末端至到达RCA开口的时间之和,即器械装配难易度;(5)器械到位时间,即第1枚支架从RCA开口到m-PD的时间与第2枚支架从RCA开口到m-PL的时间之和;(6)操作总时间,定义为第1根导丝头端从p-RCA开始计时到两枚支架分别到达m-PD、m-PL所有时间之和,即导丝操控、导丝装配、通过分叉、器械装配、器械到位的时间之和。人工组操作过程:(1)人工将6 F JR 4.0指引导管送入RCA开口,并调整至最佳位置;(2)人工将第1根导丝从指引导管开口送至PD远端,并依次记录导丝经过p-RCA、m-RCA、d-RCA、m-PD的时间;(3)接着将第2根导丝装配送至指引导管开口,调整好位置,依次记录导丝经过p-RCA、m-RCA、d-RCA、m-PL的时间;(4)穿第1根导丝将第1枚支架装载送至指引导管开口,记录时间,送至PD与PL分叉处;(5)再穿第2根导丝将第2枚支架装载并调整送至指引导管开口处,记录时间,送至分叉处,记录双支架到位时间,回撤全部器械。机器人组操作过程:(1)术者在机器人系统辅助下将6 F JR 4.0指引导管送入RCA开口,并调整至最佳位置;(2)人工将第1根导丝装载至机器人导丝轨道上,记录时间;(3)通过机械手柄将第1根导丝从指引导管开口送至PD远段,并依次记录导丝经过各标记点时间;(4)人工将第2根导丝装载至机器人导丝轨道上;(5)通过机械手柄操控将第2根导丝装配送至指引导管开口,调整好位置,送至PL远段,依次记录导丝经过各标记点时间;(6)人工给机器人导丝装载第1枚支架并送至指引导管开口,记录时间;(7)通过手柄将支架送至PD与PL分叉处;(8)人工装载第2枚支架,用手柄送至分叉处,记录双支架到位时间,回撤全部器械。人工组和机器人组均由两位高年资介入医师各自操作5次,依次记录操作时间。操作过程中机器人主端结构位于导管室操控室内,通过有线信号传输进行从端控制,从端操作结构位于模型右侧,其中器械装配过程由人工完成,包括将导丝固定于从端递送结构、将器械固定于导丝。
1. 2 在体动物实验(图2)
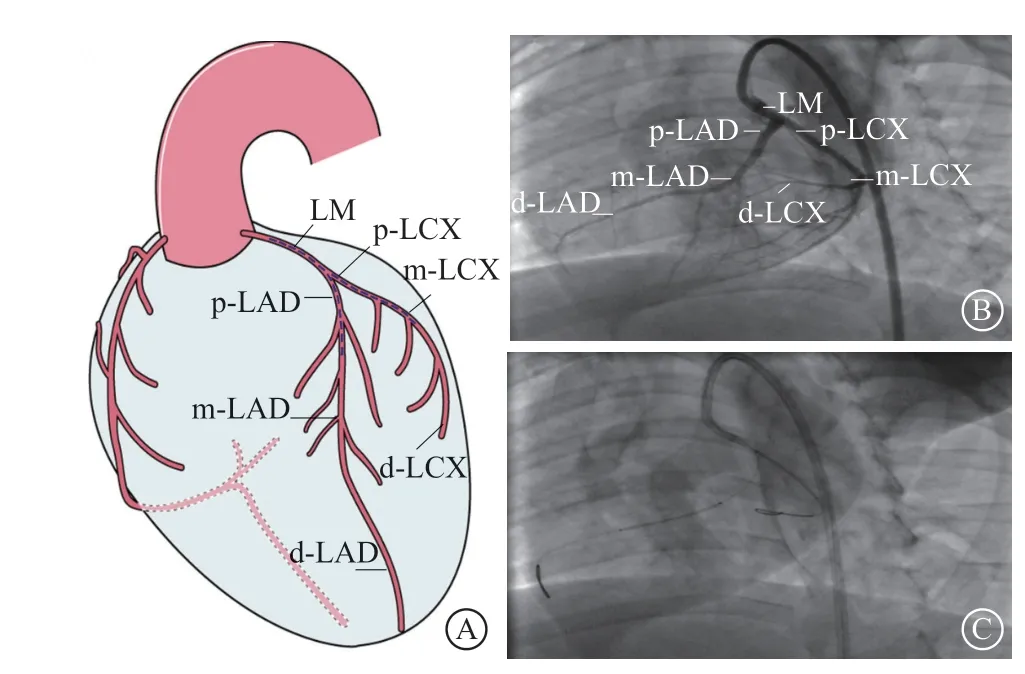
图2 冠状动脉介入机器人辅助PCI 在体内模型中的验证 A.体内LM 分叉双支架;B.小型猪冠状动脉造影模型;C. LM 分叉双支架到位,LAD 支架到位,LCX 支架到位
1. 2. 1 实验对象 3月龄健康小型猪2头(上海安助医疗科技有限公司),雄性,体质量(23±2)kg(华东医院伦理中心批准通过)。
1. 2. 2 实验方法 实验猪肌内注射氯胺酮首剂麻醉,手术过程中经耳缘静脉给予地西泮维持麻醉状态。术前静脉给予肝素500 U/kg。经由股动脉路径选择合适指引导管到达左冠状动脉开口处进行冠状动脉造影。以左侧冠状动脉为靶血管,分别对左前降支(lef t anterior descending,LAD)近段( p-LAD)、中段(m-LAD)、远段(d-LAD),左回旋支(lef t circumf lex artery,LCX)近段(p-LCX)、中段(m-LCX)、远段(d-LCX)进行标记。术中时间定义:(1)导丝操控时间,第1根导丝头端从p-LAD到d-LAD的时间与第2根导丝头端从p-LCX到d-LCX的时间之和;(2)导丝通过分叉时间,第1根导丝头端从左主干开口到m-LAD的时间与第2根导丝头端从左主干开口到m-LCX的时间之和;(3)导丝装配时间(第2根导丝),自第1根导丝到达d-LAD计时开始,手动装配第2根导丝,至第2根导丝至左主干开口的时间,即导丝装配难易度;(4)器械装配时间,第1枚支架穿第1根导丝末端开始,送至左主干开口的时间与第2枚支架穿第2根导丝末端开始,送至左主干开口的时间之和,即器械装配难易度;(5)器械到位时间,第1枚支架从左主干开口到m-LAD的时间与第2枚支架从左主干开口到m-LCX的时间之和;(6)操作总时间,第1根导丝头端从p-LAD开始计时到两枚支架分别到达d-LAD、d-LCX所有时间之和,即导丝操控、导丝装配、通过分叉、器械装配、器械到位的时间之和。人工组操作过程:(1)人工将7 F AL 1.0指引导管送入左主干开口,并调整至最佳位置;(2)人工将第1根导丝从指引导管开口送至LAD远段,并依次记录导丝经过p-LAD、m-LAD、d-LAD的时间;(3)再将第2根导丝装配送至指引导管开口,调整好位置,依次记录导丝经过p-LCX、m-LCX、d-LCX的时间;(4)穿第1根导丝将第1枚支架装载送至指引导管开口,记录时间,送至m-LAD;(5)再穿第2根导丝将第2枚支架装载并调整送至指引导管开口处,记录时间,送至m-LCX,记录双支架到位时间,回撤全部器械。机器人组操作过程:(1)术者在机器人系统辅助下将7 F AL 1.0指引导管送入左主干开口,并调整至最佳位置;(2)人工将第1根导丝装载至机器人导丝轨道上,记录时间;(3)通过机械手柄将第1根导丝从指引导管开口送至LAD远端,并依次记录导丝经过各标记点时间;(4)人工将第2根导丝装载至机器人导丝轨道上;(5)通过机械手柄操控将第2根导丝装配送至指引导管开口,调整好位置,送至LCX远段,依次记录导丝经过各标记点时间;(6)人工给机器人导丝穿第1枚支架并送至指引导管开口,记录时间;(7)通过手柄将支架送至m-LAD;(8)人工装载第2枚支架,用手柄送至m-LCX,记录双支架到位时间,回撤全部器械。人工组和机器人组均由两位介入高年资医师各自操作5次,依次记录操作时间。操作过程中机器人主端结构位于复旦大学附属华东医院导管室操控室内,从端操作机构位于上海微创动物实验室。两地直线距离约18.3 km(高德地图导航软件),通过5G传输数据流信号进行远程操控及图像传输。器械装配过程由人工完成,其中包括将导丝固定于从端递送机构、将器械固定于导丝。
1. 3 统计学分析
采用SPSS 22.0软件对数据进行统计学分析。计量资料均符合正态分布,以均数±标准差(±s)表示,组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2. 1 机器人组与人工组在体外模型中的应用比较
两组在体外模型的器械到位率均为100%。其中在体外模型中,人工组导丝通过分叉时间[(35.80±18.18)s比(64.70±25.54)s,P<0.001]、导丝装配时间[(49.70±9.99)s比(96.70±21.13)s,P<0.001]、器械装配时间[(51.00±10.72)s比(119.50±17.99)s,P<0.001]、器械到位时间[(86.90±22.89)s比(182.00±23.74)s,P<0.001)]、操作总时间[(241.50±48.01)s比(500.10±61.57)s,P<0.001)]显著优于机器人组,差异均有统计学意义。但两组导丝操控时间[(21.90±3.19)s比(27.50±14.89)s,P=0.276]差异无统计学意义(表1~2,图3)。
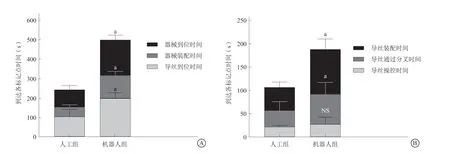
图3 机器人组与人工组在体外模型中到达各标记点时间 A. 两组在体外模型中器械到位时间、器械装配时间、导丝到位时间的比较;B.两组在体外模型中导丝装配时间、导丝通过分叉时间、导丝操控时间的比较
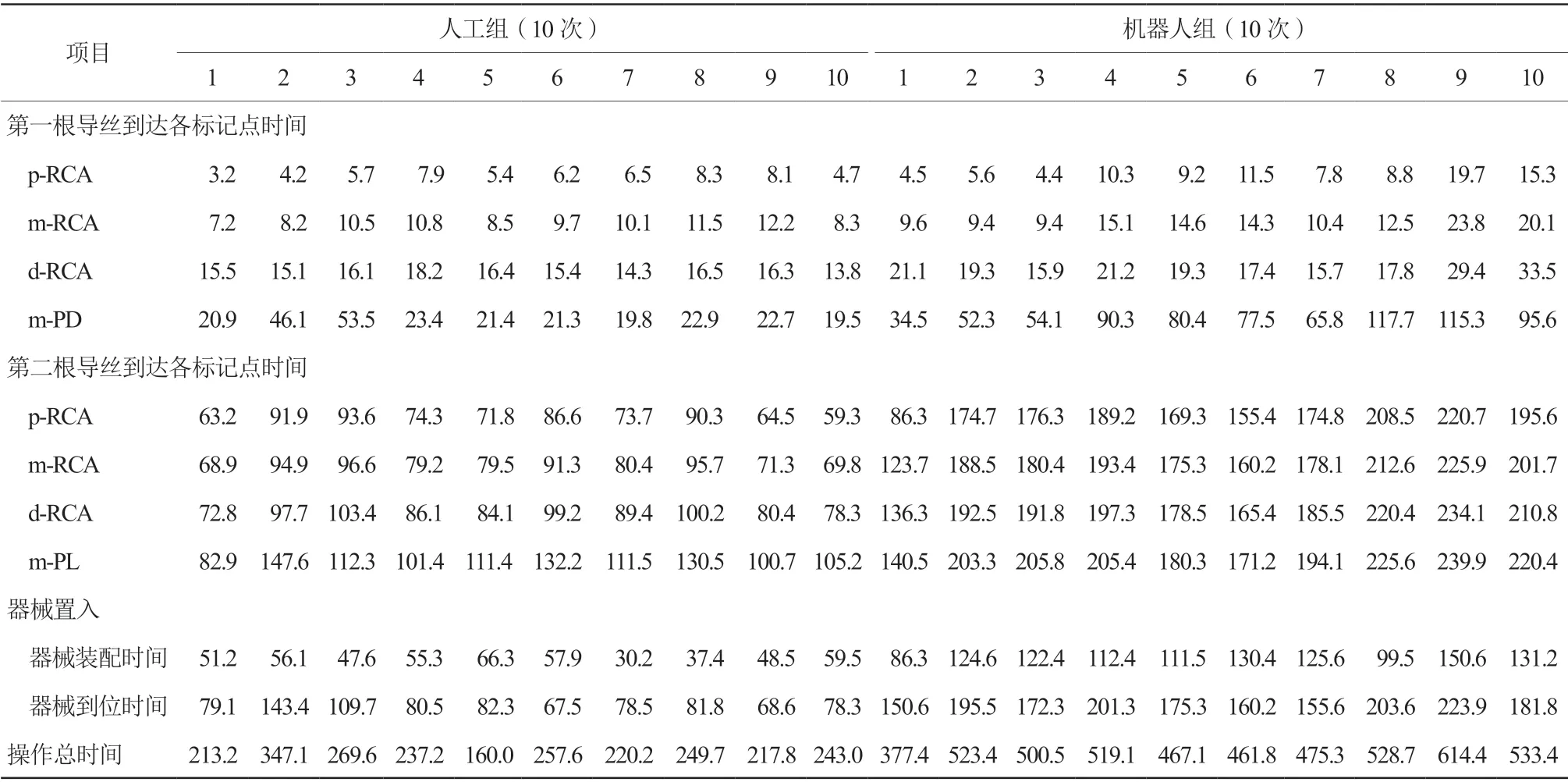
表1 机器人组与人工组在体外模型中的操作时间(s)
2. 2 机器人组与人工组在在体动物实验中的应用比较
两组在体动物实验的器械到位率均为100%。人工组导丝操控时间[(27.90±13.73)s比(51.00±22.86)s,P=0.014]、导丝通过分叉时间[(16.80±7.01)s比(89.80±48.08)s,P<0.001]、导丝装配时间[(12.10±6.54)s比(85.2 0±4 6.9 5)s,P<0.0 01]、器械装配时间[(38.50±5.33)s比(114.50±40.12)s,P<0.001]、器械到位时间[(49.90±6.97)s比(121.30±39.43)s,P<0.001]、操作总时间[(133.20±19.06)s比(376.60±101.85)s,P<0.001]均显著优于机器人组,差异均有统计学意义(表3~4,图4)。

图4 机器人组与人工组在体内模型中到达各标记点时间 A. 两组在体内模型中器械到位时间、器械装配时间、导丝到位时间的比较;B.两组在体内模型中导丝装配时间、导丝通过分叉时间、导丝操控时间的比较

表3 机器人组与人工组在体内模型中的操作时间(s)
3 讨论
在心脏领域,达芬奇机器人系统最早应用于心脏外科,法国的Carpentie以及德国的Loulmet教授首次在达芬奇机器人辅助下完成二尖瓣成形术及冠状动脉旁路移植术[9]。与人工操作比较,机器人提供高分辨率三维图像,同时避免人的生理性颤抖,显著提高手术的稳定性和精细度,因而得以广泛应用。目前市场上主要存在两款冠状动脉介入机器人,分别是CorPath 200和CorPath GRX两代产品,而CorPath GRX机器人系统对器械的操控更加精细,达到亚毫米级,同时增加了TechnIQ技术(包括RoR、Wiggle、Spin等模式)[10]。国内尚无可临床应用的冠状动脉机器人[11],我院与中国科学院自动化研究所合作共同研制的冠状动脉机器人,已成功应用于动物实验[7-8],但尚未进入临床应用。
国外已开展多项CorPath机器人辅助PCI的研究。Harrison等[12]采用CorPath 200完成108例B2/C型病变,成功率为91.7%,但有18.5%的患者需人工干预,其中7.4%转化为人工组。随后Hirai等[13]采用CorPath GRX完成95例冠状动脉慢性完全闭塞病变单中心小样本试验,结果表明,与人工组相比,机器人组成功率高,无主要不良心血管事件发生,但病变相对简单,操作相对简单,同时逆向造影还需人工参与。而CORA-PCI研究[14]采用二代CorPath GRX机器人共完成315例复杂冠状动脉病变,机器人成功率达91.7%,其中人工协助率高达11.1%,而转化为人工组高达7.4%。两代CorPath机器人虽然均可处理单支血管病变,但需要人工干预率或转为人工组比例均高,然而对于分叉病变,两代机器人产品均无法应用。目前冠状动脉分叉病变占所有冠状动脉病变的15%~20%[15-16],在实际应用中,不管是双支架处理分叉病变,还是采取主支单支架治疗,分支保护包括各类拘禁导丝技术、拘禁球囊技术,均需要同时处理两支病变。本研究自主研发的冠状动脉介入机器人可用于分叉病变,其主要分为床旁从端机械操作平台和远程主端控制平台。床旁机械操作平台主要包括可移动机械臂和可消毒式无菌导管操纵盒。远程控制平台包括操纵面板、心电监护仪、血流动力学监护仪、脚踏板。导管操纵平台可同时操纵两根导丝/球囊/支架,分支使用导丝或者球囊保护,或者行DK-crush术式(图5)。

图5 国产冠状动脉介入手术机器人系统概述 A.自主研制冠状动脉介入手术机器人在导管室的分布图(f 为机器人从端操作结构);B.机器人主端结构操纵面板(a 为电源开关,b 为球囊/支架导管操纵杆,c 为导丝操纵杆,d 为指引导管操纵杆,e 为紧急停止按钮)
表2 机器人组与人工组在体外模型中各项操作时间的比较(s,±s)
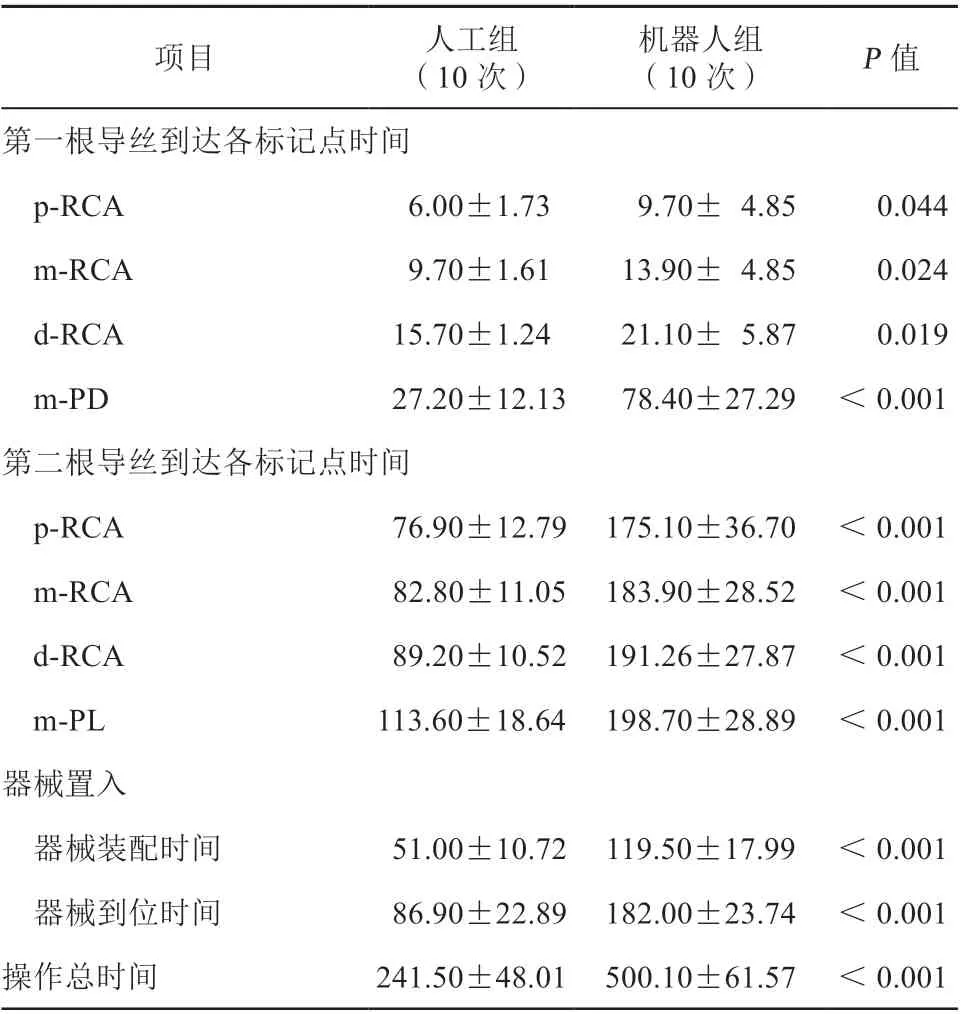
表2 机器人组与人工组在体外模型中各项操作时间的比较(s,±s)
注:p-RCA,右冠状动脉近段;m-RCA,右冠状动脉中段;d-RCA,右冠状动脉远段;m-PD,后降支中段;m-PL,左心室后支中段。
项目 人工组(10 次)机器人组(10 次) P 值第一根导丝到达各标记点时间p-RCA 6.00±1.73 9.70± 4.85 0.044 m-RCA 9.70±1.61 13.90± 4.85 0.024 d-RCA 15.70±1.24 21.10± 5.87 0.019 m-PD 27.20±12.13 78.40±27.29 <0.001第二根导丝到达各标记点时间p-RCA 76.90±12.79 175.10±36.70 <0.001 m-RCA 82.80±11.05 183.90±28.52 <0.001 d-RCA 89.20±10.52 191.26±27.87 <0.001 m-PL 113.60±18.64 198.70±28.89 <0.001器械置入器械装配时间 51.00±10.72 119.50±17.99 <0.001器械到位时间 86.90±22.89 182.00±23.74 <0.001操作总时间 241.50±48.01 500.10±61.57 <0.001
本研究发现,与单纯人工PCI相比较,冠状动脉介入手术机器人具有以下几大优势。(1)亚毫米级准确定位,精准放置支架。通过计算导丝穿过病变的时间和速度,可测量亚毫米级病变长度,避免肉眼下的估算误差,帮助术者选择合适的支架,保证支架充分覆盖病变,从根本上解决支架覆盖病变不完全的问题。本研究中机器人组的在体和离体模型验证,通过介入机器人对病变测量估算,可达到支架精准到位及充分覆盖病变的效果。(2)缩短手术时间,降低医患辐射剂量。理论上机器人标准化操作可明显缩短平均手术时间,显著降低医患辐射剂量,减少对比剂的使用量,保护医患双方[5,14,17-19]。然而,在本次研究中,机器人组与人工组相比,在体内[(376.60±101.85)s比(133.2 0±19.0 6)s,P<0.0 01]及体外模型[(500.10±61.57)s比(241.50±48.01)s,P<0.001]中操作总时间均显著超过人工组。其中导丝装配及器械装配时间分别占总时间的1/3(表1~4,图3~4),这主要由于介入医护人员对机器人操作不熟练、支架装配工艺不成熟、机器人算法不够优化以及触觉力学反馈灵敏度低。(3)实现介入治疗的标准化。机器人可克服人手操作的缺陷,使操作更加清晰与规范,同时机器人亚毫米级操作可实现对手术中各个环节的精确量化,从而提升手术的标准化程度。(4)远程操作。在特定场景下的隔离操作,尤其针对新型冠状病毒肺炎或其他接触传染类疾病的患者,机器人可有效减少术者与感染源的接触,降低暴露风险[20]。Tabaza等[21]首先报道了操作者在相邻的房间操纵机器人系统完成手术的案例,随后该团队将远程操作距离增加到了161 km以上。而本次在体内模型中,将机器人主端结构安装在复旦大学附属华东医院导管室操控室内,从端操作机构安装在上海微创动物实验室,两地距离约18.3 km,采用5G网络信号进行远程操控及图像传输,实现异地远程实施机器人辅助PCI。
表4 机器人组与人工组在体内模型中各项操作时间的比较(s,±s)

表4 机器人组与人工组在体内模型中各项操作时间的比较(s,±s)
注:p-LAD,左前降支近段;m-LAD,左前降支中段;d-LAD,左前降支远段;p-LCX,左回旋支近段;m-LCX,左回旋支中段;d-LCX,左回旋支远段。
项目 人工组(10 次)机器人组(10 次) P 值第一根导丝到达各标记点时间p-LAD 4.60±1.02 4.60±2.12 0.979 m-LAD 8.60±2.11 16.90±7.67 0.008 d-LAD 13.50±3.33 29.10±15.32 0.011第二根导丝到达各标记点时间p-LCX 25.60±8.14 114.30±38.80 <0.001 m-LCX 35.20±7.73 127.60±36.59 <0.001 d-LCX 44.70±12.33 140.80±36.21 <0.001器械置入器械装配时间 38.50±5.33 114.50±40.12 <0.001器械到位时间 49.90±6.97 121.30±39.43 <0.001操作总时间 133.20±19.06 376.60±101.85 <0.001
机器人辅助冠状动脉介入具有辐射小、操作精准稳定等优点,但也存在着费用高、无法处理特殊病变如严重钙化病变、迂曲病变、慢性闭塞病变等缺点。两代CorPath机器人已在多项研究中证明其安全性与有效性,但临床数据还不够丰富,而国内较少开展此类技术。身处5G通信技术、大数据、人工智能时代,机器人辅助PCI有望与腔内影像设备进行一体化融合,走入临床一线,为精准PCI提供更为广阔的前景。未来成熟的冠状动脉辅助介入机器人需具备以下功能:适用于商品化的腔内介入器械;能完成大部分人工手术动作,包括导丝、导管的前进、后退、旋转,球囊的前进、后退、收放,支架的输送与释放等;具备一定的力触觉与视觉反馈功能。要满足以上条件,就必须要医、工、研、商及多学科团队的密切合作。
本研究尚有一定的局限性,需要更多动物实验数据及临床数据来验证。本研究首次采用自主合作研制的冠状动脉介入机器人,通过体内小型猪模型与体外模型验证了机器人辅助PCI在分叉病变及异地远程控制上的可行性、安全性和有效性。
利益冲突所有作者均声明不存在利益冲突
