负载分子信标的生物矿化纳米载体用于检测microRNA
2022-09-05吴玉婷王彩霞刘志洪
吴玉婷,王彩霞†,刘志洪,2†
1. 湖北大学化学化工学院/有机化工新材料湖北省协同创新中心/有机功能分子合成与应用教育部重点实验室,湖北 武汉430062;2. 武汉大学 化学与分子科学学院,湖北 武汉430072
0 引 言
微小核糖核酸microRNA(简称miRNA)是一类长度为19~23 个核苷酸的短单链非编码RNA,其异常表达与肿瘤的发生和发展密切相关,因此miRNA 作为肿瘤标志物和治疗靶点的研究受到了广泛关注[1,2]。逆转录聚合酶链反应(RT-PCR)是基因检测中最常用的miRNA 检测方法,但由于设备昂贵、检测过程复杂,只能用于体外检测,不能满足在活细胞中检测miRNA 的需求。分子信标(molecular beacon,MB)作为最常用的核酸探针具有高生物相容性和高选择性,且易于合成、可设计性强,在基因检测方面表现出很大优势[3~5]。MB 是一类具有茎环(stem-loop)发夹结构的单链核酸分子,识别序列位于环路区域,其茎区域荧光团的荧光易被附近的猝灭基团猝灭[4];当遇到特定RNA时,MB 的发夹结构与其形成稳定的杂化双链而打开,可使荧光恢复[6,7]。因此,可以利用体系中MB荧光信号的变化来检测目标RNA。但通常情况下,游离的MB 不易被活细胞摄取,而易被细胞内的核酸酶降解,导致假阳性信号的产生,从而影响MB 的检测效果[8]。为了实现活细胞内高灵敏度检测miRNA,迫切需要设计一种能将MB 高效递送至细胞内的纳米载体。用于递送MB 的无机纳米载体主要有金属及其化合物[9,10]、金属-有机框架[11]、碳基材料[12]等。但这些材料存在难以降解的问题,可能导致生物毒性。使用不同的生物模板(如蛋白质和多肽)修饰无机物,可以得到生物矿化纳米载体,制备方法简单、降解性能好,且易于修饰,具有广阔的临床应用前景[13,14]。磷酸钙、碳酸钙、硅酸钙等是生物硬组织的主要无机成分,可以在酸性环境下降解成无毒的离子,参与生命体的正常代谢。因此,基于磷酸钙、碳酸钙、硅酸钙等的生物矿化纳米材料具有良好的生物相容性和降解性能,可用于递送蛋白质、多肽和药物,广泛用于疾病的诊断与治疗[15~18]。
牛血清白蛋白(bovine serum albumin,BSA)作为一种生物矿化相关蛋白,其分子中的酸性残基可以螯合过饱和亚稳态溶液中的Ca2+形成成核位点,不断浓缩Ca2+以增加局部过饱和度,随后在磷酸盐参与下,自发形成磷酸钙(CaP)[19,20]。基于以上研究,本文以白蛋白为生物模板,表面矿化磷酸钙,得到一种生物矿化纳米载体BSA/CaP,再通过Ca2+与MB 的静电相互作用负载MB,得到纳米探针MB@BSA/CaP,并将其用于检测肿瘤细胞中过表达的标志物miRNA-155。
1 实验部分
1.1 试剂及仪器
仪 器:RF-6000 型 荧 光 光 谱 仪(Shimadzu 公司),Nicolet iS10 型Fourier 转换红外光谱仪(FTIR,Thermo Scientific 公司),JEM-2100 型透射电子显微镜(TEM,JEOL 公司),ZS90 型纳米粒度电位仪(DLS,马尔文公司),LSM-880 型多光子共聚焦荧光显微镜(CLSM,Zeiss 公司)。
试剂:氯化钙、BSA 均为国产分析纯试剂;噻唑蓝(MTT)、细胞核染色剂(Hoechst 33342)均为国产生化纯试剂;脱氧核糖核酸酶(DNase Ⅰ)购自宝生物工程(大连)有限公司;Dulbecco 改良培养基(DMEM)和商用脂质体载体(Lipofectamine 2000)均来自赛默飞世尔科技公司;DNA 寡核苷酸和miRNA 购于上海生工生物工程公司,详细序列见表1;实验用水均为超纯水。

表1 DNA 寡核苷酸和miRNA 序列Table 1 Sequences of DNA oligonucleotide and miRNA
1.2 合成方法
1.2.1 BSA/CaP 纳米载体的合成
根据文献方法[19]制备纳米载体。将10 mg BSA加入到1 mL DMEM(含有0.9 mmol/L PO43-)培养基中,用封口胶密封,在37 ℃培养箱中静置孵育24 h后,加入10 μL CaCl2(1 mol/L)溶液,继续孵育24 h,13 300 r/min 离心15 min,用超纯水清洗干净,得到BSA/CaP 纳米载体。将BSA/CaP 在超纯水中分散,配制1 mg/mL 分散液,于-20 ℃保存备用。
1.2.2 MB@BSA/CaP 纳米探针的合成
将10 mg BSA 加入到1 mL DMEM 培养基中,用封口胶密封,在37 ℃培养箱中静置孵育24 h。将10 μL CaCl2(1 mol/L)分别与不同浓度的MB 分散液(100~400 nmol/L)混合,振荡2 h,加入到上述体系中,继续孵育24 h,13 300 r/min 离心15 min,用超纯水清洗干净,得到MB@BSA/CaP 纳米探针。将MB@BSA/CaP 在超纯水中分散,配制1 mg/mL 分散液,于-20 ℃保存备用。
另外,将商用脂质体载体Lipofectamine 2000(1 mg/mL, 2 μL)与MB 分散液(100 μmol/L,1 μL)混合,加 入100 μL 培 养 基,静 置20 min,得 到Lipofectamine 2000/MB,用作细胞实验的对照组。
1.3 检测方法
测试MB 的选择性。将100 nmol/L 的miRNA-10b、miRNA-27a、miRNA-21、miRNA-221、miRNAlet 7a、miRNA-155 与100 nmol/L 的MB 在pH 为7.40 的Tris-HCl 杂 交 缓 冲 溶 液(含1 mmol/L 的MgCl2和100 mmol/L 的KCl)中 共 孵 育40 min,用荧光光谱仪测试体系的荧光光谱,考察MB 的选择性。 此MB 的荧光基团是FAM,猝灭基团是BHQ1。
使用仅修饰荧光团FAM 的MB-FAM 测试在BSA/CaP 纳米载体中的负载量。将10 μL 1 mol/L CaCl2溶 液 分 别 与 不 同 浓 度(100、200、300、400 nmol/L)的MB-FAM 混合,振荡2 h。样品用超纯水多次离心、洗涤,除去未负载的MB-FAM。根据MB-FAM 荧光标准曲线,计算负载量和包封率。
测试纳米载体的保护性能。将不同MB 负载量的MB@BSA/CaP 纳米探针在超纯水中分散,使MB 的终浓度均为100 nmol/L。在MB 分散液和不同MB 负载量的MB@BSA/CaP 分散液中分别加入10 μL 的100 U/mL DNase Ⅰ,于摇床中37 ℃振荡30 min,测试体系的荧光光谱。同时检测相同条件下不加DNase Ⅰ的体系的荧光光谱。此实验中使用的MB 荧光基团是FAM,猝灭基团是BHQ1。
1.4 细胞内检测miRNA-155
人源乳腺癌细胞(MCF-7 细胞)和鼠源脑微血管内皮细胞(bEnd.3 细胞,武汉普诺赛生命科技有限公司)的培养:将细胞置于含10%胎牛血清、1%抗生素(100 U/mL 青霉素和100 μg/mL 链霉素)的DMEM 培养基中,于37 ℃、5% CO2的湿润环境中培养。
为了检测细胞内miRNA-155,首先将MCF-7细胞(或bEnd.3 细胞)接种于35 mm 玻璃底培养皿中,每皿的接种密度为1×105个细胞,于培养箱中37 ℃孵育24 h,移去培养基,再加入含有Lipofectamine 2000/MB 或MB@BSA/CaP 的新鲜培养基,MB 的终浓度为100 nmol/L,再次孵育6 h,用磷酸盐缓冲溶液(PBS)清洗3 次,加入细胞核染色剂Hoechst 33342(终浓度7.5 μg/mL)与细胞共培养10 min,标记细胞核,最后用共聚焦荧光显微镜进行细胞成像分析。此实验中使用的MB 荧光基团是Cy5,猝灭基团是BHQ2。
2 结果与讨论
2.1 BSA/CaP 纳米载体的表征
本文制备了BSA/CaP 纳米载体,并通过多种测试手段对其表征,如图1 和图2(a)~(d)所示。从CaP、BSA 和BSA/CaP 的FT-IR 图(图1)可以看出,BSA/CaP 的谱中同时观察到BSA 的C=O 振动特征峰(1 643 cm-1)和CaP 的P—O 振动特征峰(1 036 cm-1),证明BSA/CaP 纳米载体成功合成。从BSA/CaP 的TEM 图(图2(a))可以看出,BSA/CaP 纳米载体为中空球型结构,平均尺寸约60 nm;BSA/CaP 的DLS 图(图2(b))显示,BSA/CaP 的水合粒径为118 nm,分散系数(PDI)为0.119,具有良好的分散性;BSA/CaP 的Zeta 电位图(图2(c))显示,BSA/CaP 表面带负电荷,其表面电位与BSA 的电势接近。将BSA/CaP 负载带正电荷的荧光染料Cy7,分别加入到pH 5.00 和pH 7.40 的缓冲溶液中,考察了体系的荧光强度变化。如图2(d)所示,在中性环境中(pH 7.40),体系荧光强度(激发波长λex=750 nm,发射波长λem=796 nm)较弱,说明有少量的Cy7 从载体中释放;而当pH 值为5.00 时,体系荧光信号显著增强,表明有大量Cy7 从载体中释放。这是由于BSA/CaP 纳米载体中的CaP 在酸性环境下水解生成了钙离子和磷酸根离子[15],使载体不稳定,导致大量Cy7 的释放。 纳米载体的酸响应性能有助于其在细胞溶酶体酸性环境(pH 5.00)中快速释放负载的MB,并在钙离子作用下促进MB 从溶酶体中逃逸,与细胞质中miRNA-155 反应,避免MB 在溶酶体中长时间滞留而被酶降解,从而提高探针检测miRNA-155 的灵敏度。

图1 CaP、BSA 和BSA/CaP 的FT-IR 图Fig.1 FT-IR spectra of CaP, BSA and BSA/CaP
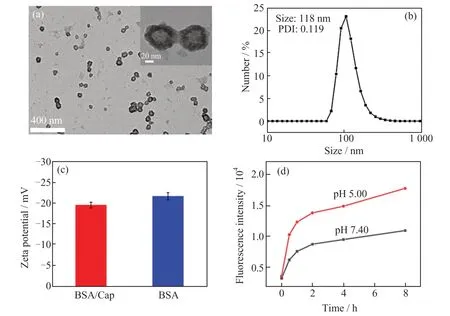
图2 BSA/CaP 的TEM 图(a)、DLS 图(b)、Zeta 电位图(c);(d)不同pH 值条件下BSA/CaP 释放Cy7 的荧光强度变化曲线Fig.2 TEM (a), DLS (b), Zeta potential(c)images of BSA/CaP;(d)the change curves of fluorescence intensity of Cy7 released from BSA/CaP at different pH conditions
2.2 MB@BSA/CaP 纳米探针的表征
对MB@BSA/CaP 纳米探针进行表征,结果如图3(a)~(c)所示。在构建MB@BSA/CaP 纳米探针之前,首先考察了MB 对miRNA-155 的选择性。此MB 的荧光基团是FAM,猝灭基团是BHQ1。如图3(a)所示,MB 与miRNA-155 共孵育40 min 后,体系的荧光强度(λex=490 nm,λem=523 nm)显著增强,增强倍数(F/F0)为25,而与miRNA-10b、miRNA-27a、miRNA-21、miRNA-221 和miRNA-let 7a 等非目标miRNA 几乎不发生反应,表明MB 对miRNA-155 表现出良好的响应能力和选择性。
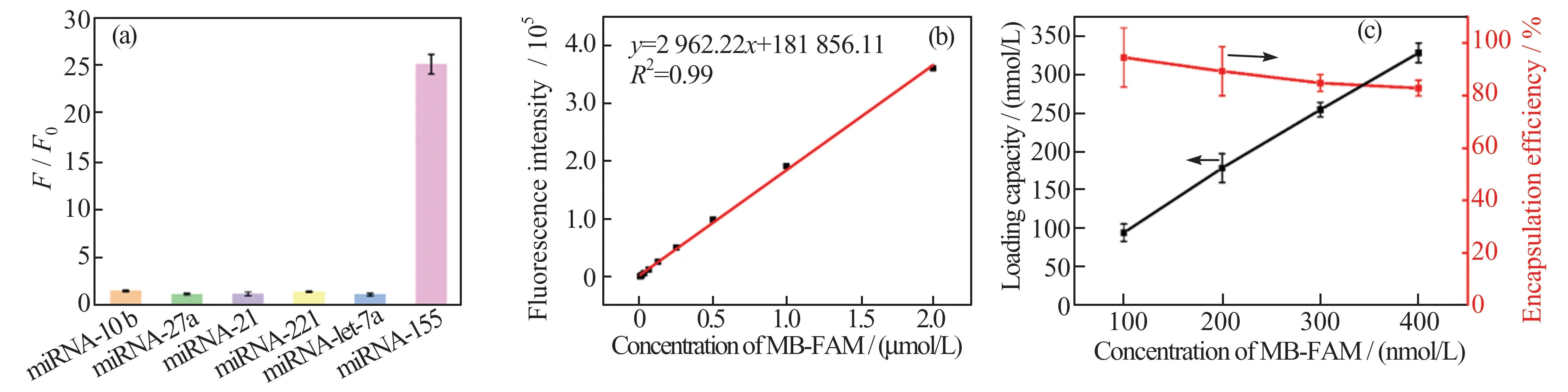
图3 (a)MB 对miRNA155 的选择性;(b)MB-FAM 荧光强度与浓度的线性关系;(c)BSA/CaP 对MB-FAM 的负载量和包封率Fig.3 (a)MB’s selectivity toward miRNA155;(b)linear relationship between MB-FAM fluorescence intensity and concentrations;(c)the loading capacity and encapsulation efficiency of MB-FAM in the BSA/CaP
将仅修饰荧光基团FAM 的MB-FAM 负载到BSA/CaP 纳米载体中,考察体系荧光强度(λem=523 nm)的变化,并根据体系荧光强度随浓度变化的标准曲线(图3(b)),计算负载量和包封率,结果如图3(c)所示。在BSA/CaP 纳米载体中加入400 nmol/L MB-FAM 时,MB-FAM的负载量为331.24 nmol/L,包封率为82.81%,表明BSA/CaP纳米载体可高效负载MB-FAM。
研究了不同MB 负载量对MB@BSA/CaP 纳米探针的粒径和形貌的影响。如图4 所示,不同MB负载量的纳米探针形貌相似,均为中空球型结构,且随着加入MB 浓度的逐渐增加,纳米探针的粒径由(57.7±3.3)nm 增加至(78.1±4.0)nm。进一步通过DLS 测得MB@BSA/CaP 纳米探针的水合粒径也是随着MB 负载量的增加而增大(表2),但其PDI 值始终在0.200 左右,表明纳米探针具有良好的分散性。

图4 不同MB 负载量的MB@BSA/CaP 的TEM 图和相应的粒径分布图(插图)Fig.4 TEM images and corresponding particle size distributions images (illustration)of MB@BSA/CaP loaded with different amounts of MB
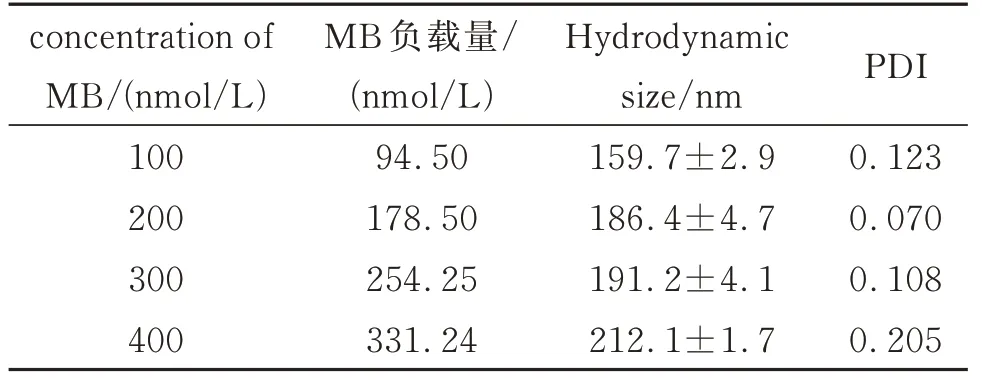
表2 不同MB 负载量MB@BSA/CaP 纳米探针的水合粒径和PDITable 2 Hydrodynamic size and PDI of MB@BSA/CaP nanoprobes loaded with different amounts of MB
2.3 MB@BSA/CaP纳米探针的抗DNase Ⅰ降解性能
研究了游离MB 和不同MB 负载量MB@BSA/CaP 纳米探针抗DNase Ⅰ(1 U/mL)降解的性能,结果如图5(a)所示。游离的MB 与DNase Ⅰ共孵育后荧光显著增强,是由于游离MB 容易在DNase Ⅰ作用下被降解,荧光基团和猝灭基团之间距离增大,荧光共振能量转移(FRET)作用消失,从而使荧光信号恢复。相比之下,不同MB 负载量MB@BSA/CaP纳米探针与DNase Ⅰ共孵育,荧光强度发生了不同程度的增强。当MB 的加入量为100 nmol/L 或200 nmol/L 时,纳米探针的荧光信号仅有微弱增强,表明纳米载体可以有效阻止MB 被DNase Ⅰ降解。当MB 的加入量为300 nmol/L 或400 nmol/L 时,荧光信号增强明显,证明MB 部分被DNase Ⅰ降解,纳米载体的保护作用有所减弱。这是因为加入MB浓度过大时,MB 会吸附至纳米载体外表面,导致纳米载体的保护作用减弱。分别将游离的MB 和不同MB 负载量MB@BSA/CaP 纳米探针与目标物miRNA-155(100 nmol/L)在杂交缓冲溶液中共孵育(如图5(b)所示),可以发现,随着MB 负载量增加,纳米探针对miRNA-155 响应的荧光信号逐渐增强,也证明了纳米载体对MB 的保护作用逐渐减弱。因此,为了提高纳米探针在细胞内检测miRNA的准确性,避免产生假阳性信号,MB 的加入量应低于200 nmol/L。
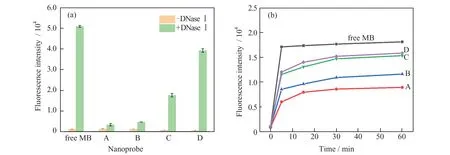
图5 游离的MB 和不同MB 负载量MB@BSA/CaP 纳米探针与DNase Ⅰ反应后的荧光强度(a)以及与目标物miRNA-155 反应后荧光强度变化曲线(b)Fig.5 Fluorescence intensity for free MB and MB@BSA/CaP nanoprobe loaded with different amount of MB reacted with DNase Ⅰ(a);plot for the fluorescence intensity of probes reacted with the target miRNA-155 and time (b)
2.4 MB@BSA/CaP 纳米探针的细胞内荧光成像
将不同用量的MB@BSA/CaP 纳米探针与MCF-7 细胞共孵育24 h 后,通过MTT(噻唑蓝)法测定细胞存活率,考察了MB@BSA/CaP 纳米探针的细胞毒性。纳米探针的用量在10~400 μg/mL 范围内,细胞存活率均大于90%,表明纳米探针细胞毒性低,具有良好的生物安全性,适用于细胞成像。
研究了MB@BSA/CaP 纳米探针对MCF-7 细胞内miRNA-155 的荧光成像。此实验中使用的MB 荧光基团是Cy5,猝灭基团是BHQ2。将游离MB、MB@BSA/CaP 和Lipofectamine 2000/MB 分别加入到MCF-7 细胞中共孵育(MB 100 nmol/L),通过共聚焦荧光显微镜观察成像效果,结果见图6。如图6(a)所示,MCF-7 细胞与游离MB 共孵育几乎无明显荧光,这是因为游离MB 很难穿透细胞膜而被细胞摄取,导致成像效果差。将商用脂质体载体Lipofectamine 2000 负 载 MB 制 备 探 针 Lipofectamine 2000/MB,加入到MCF-7 细胞中,观察到较明显的红色荧光。而在MCF-7 细胞中加入MB@BSA/CaP 纳米探针后观察到强烈红色荧光,是由于纳米探针被MCF-7 细胞摄取后,在胞内溶酶体酸性环境下释放MB 与miRNA-155 杂交,使MB 的发夹结构打开,荧光恢复。根据图6(b),MB@BSA/CaP 组的细胞平均红色荧光强度是Lipofectamine 2000/MB 组细胞的5.07 倍。这也进一步证实MB@BSA/CaP 比Lipofectamine 2000 更容易被MCF-7 细胞摄取,能够将更多的MB 递送至细胞内与miRNA-155 反应,从而提高MB 检测细胞内miRNA 的灵敏度。
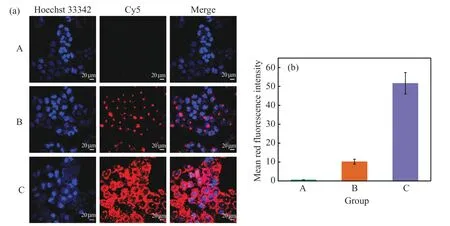
图6 (a)MCF-7 细胞与游离的MB(A)、Lipofectamine 2000/MB(B)和MB@BSA/CaP(C)共孵育后的CLSM 图像;(b)A-C 对应的平均红色荧光强度细胞核用Hoechst 33342 染色;成像条件:λex=643 nm,λem=650-754 nmFig.6 (a)CLSM images of MCF-7 cells incubated with free MB (A), Lipofectamine 2000/MB (B), and MB@BSA/CaP nanoprobe (C);(b)mean red fluorescence intensity in images A-C The cell nuclei were stained by Hoechst 33342;imaging condition:λex=643 nm, λem=650-754 nm
miRNA-155 可能与多种肿瘤的发生和发展有密切关系[21,22]。因此,进一步通过测定MB@BSA/CaP(MB 100 nmol/L)纳米探针在肿瘤细胞(MCF-7)和正常细胞(bEnd.3)中的荧光强度,评估不同细胞内miRNA-155 的表达。如图7 所示,与bEnd. 3细胞相比,MCF-7 细胞与MB@BSA/CaP 纳米探针共孵育后的体系显示出更强的荧光信号,其平均红色荧光强度是bEnd.3 细胞体系的8.10 倍。这是由于肿瘤细胞中表达了更多的miRNA-155 所致。结果表明,该纳米探针可对细胞内不同表达量的miRNA-155 进行可视化成像检测。

图7 (a)MB@BSA/CaP 纳米探针分别与bEnd.3 细胞和MCF-7 细胞孵育后的CLSM 图像;(b)(a)图的平均红色荧光强度细胞核用Hoechst 33342 染色;成像条件:λex=643 nm,λem=650-754 nmFig.7 (a)CLSM images of MB@BSA/CaP nanoprobe incubated with bEnd.3 cells and MCF-7 cells respectively;(b)mean red fluorescence intensity in image (a)The cell nuclei were stained by Hoechst 33342;imaging condition:λex=643 nm, λem=650-754 nm
3 结 语
本文利用生物矿化法构建了一种酸响应的生物矿化纳米载体BSA/CaP,通过静电相互作用高效负载MB,制备了MB@BSA/CaP 纳米探针。该纳米探针制备方法简单、分散性良好,为中空球型结构,MB 负载量高(331.24 nmol/L),其粒径随着MB负载量的增加而增大,且细胞毒性低,可被肿瘤细胞高效摄取,并可用于胞内miRNA-155 可视化成像检测。另外,该纳米载体可保护MB 不被DNaseⅠ降解,从而减少假阳性信号的产生,提高了探针检测的准确性。本工作为肿瘤标志物的检测提供了一种新颖可靠的方法,有望在复杂的生理环境中识别肿瘤细胞。
