烟草叶斑病新病原分离鉴定及其生物学特性测定
2022-09-05杨江敏桑维钧李昊熙卢燕回顾恒锋首安发甘国喜彭丽娟杨茂发
杨江敏,桑维钧*,孔 菲,李昊熙,卢燕回,顾恒锋,首安发,甘国喜,彭丽娟,杨茂发
(1贵州大学烟草学院/贵州省烟草品质重点实验室,贵州贵阳 550025;2中国烟草总公司广西壮族自治区公司科技处,广西南宁 530022;3广西壮族自治区烟草公司贺州市公司,广西贺州 542800)
0 引言
【研究意义】烟草(L.)隶属茄科(Solanaceae)烟草属(),是卷烟生产的主要原料(张希等,2021)。作为我国重要的经济作物,烟草对促进农业经济发展和增加烟农经济收入具有重要意义。广西位于我国西南部,地处中、南亚热带季风气候区,热量丰富,雨量充沛,各地年平均气温16.5~23.1 ℃,是我国烟草生产主要省区,其主产区为百色市、贺州市和河池市。叶斑病是烟草上最重要的病害,多数由真菌侵染引起,主要发生在烟叶成熟期,病菌主要通过伤口和自然孔口侵染叶片,烟叶组织被侵染发病后,病菌在组织上产生大量病原子实体,通过风、雨或气流传播,引起病原菌的再次侵染,严重影响烟叶的产量与烘烤质量(张思聂等,2021),而对病原菌种类进行准确鉴定是了解农作物病害流行规律,并有针对性地制定有效防控措施的前提。【前人研究进展】广西烟草病害的系统鉴定始于20世纪90年代初(黄福新,1993)。截至目前,有关广西烟区烟草侵染性病害的研究主要集中在烟草叶斑病、烟草病毒病、烟草黑胫病和烟草青枯病等(蒙姣荣等,2012;谭海文,2012;王五权等,2015),其中的烟草叶斑类病害包括赤星病、炭疽病和蛙眼病等国内其他烟区的常见病害(陈永德和覃春华,2010)。然而,受广西烟草种植地区调整、耕作栽培制度及气候条件变化等因素的影响,当地烟草病害呈现出种类复杂多样、新病害不断出现、危害损失加重、防控难度加大等趋势(谭海文,2012)。在传统形态学鉴定病原菌的基础上,利用分子生物学方法对病原菌特定基因进行测序分析,可增加病害鉴定的准确性(Taylor et al.,2000)。谭海文等(2012)在病害调查中首次报道由多主棒孢()引起广西烤烟棒孢霉叶斑病,同时在关国经等(2000)形态学鉴定的基础上首次通过rDNA-ITS对烤烟棒孢霉叶斑病的病原菌进行分子鉴定,并对该病原菌的生物学特性进行了补充研究,明确棒孢霉叶斑病在高温多雨季节易暴发与病原菌喜温好湿的特性有关。廖庭(2015)采用形态特征结合分子鉴定将由茎点霉引起的广西烟草新叶斑病害的病原菌鉴定为,同时测定了该病原菌的生物学特性,为针对广西烟草茎点霉叶斑病的防治研究提供了理论参考。真菌隶属子囊菌门(Ascomycota),座囊菌纲(Dothideomycetes),格孢菌目(Pleosporales),亚隔孢壳科(Didymellaceae)。能引起巴西大豆()豆荚炭疽病(Crous et al.,2019)和菊科杂草野茼蒿[(Benth.)S.Moore]叶斑病(He et al.,2021)。2020年,Cafà等通过基因组测序获得第1个基因组序列,为真菌比较基因组学研究提供了新的基因信息资源。【本研究切入点】2021年3—6月广西烟草生长季节,本课题组在贺州烟区开展病害调查过程中在烟草品种K326上发现一种症状明显不同于赤星病和靶斑病等常见病害的烟草叶斑病,对于该病害病原菌的种类以及相关信息尚不清楚。【拟解决的关键问题】采用组织分离法对从广西贺州烟区采集的具明显叶斑病症状的烟草叶片组织进行病原菌分离纯化、致病性测定及培养性状和形态特征观察,结合多基因序列联合分析[ITS、28S核糖体RNA基因(LSU)、β-微管蛋白基因()和RNA聚合酶亚基基因()]对病原菌进行鉴定,并研究不同温度、培养基、pH、碳氮源和光照条件对病原菌菌丝生长的影响,以明确病原菌的分类地位和生物学特性,为病害的及时防控和后续研究提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 分别从贺州市钟山县(东经111°30′,北纬24°52′)和富川瑶族自治县(东经111°16′,北纬24°49′)烟草品种K326上采集具明显叶斑病症状的烟草叶片共70份,通过显微镜检及病原菌分离培养,得到纯化菌株用于后续试验。
1.1.2 供试培养基 马铃薯葡萄糖培养基(PDA,青岛海博生物技术有限公司);玉米汁琼脂培养基(CMA,北京索莱宝科技有限公司);察氏培养基(CDA,北京索莱宝科技有限公司);燕麦培养基(OA,北京索莱宝科技有限公司);番茄汁琼脂培养基(TomA,自配);烟叶汁琼脂培养基(TobA,自配);南瓜汁琼脂培养基(PA,自配);水琼脂培养基(WA,自配)。自配培养基配方参照方中达(1998)的方法等量配比,所有培养基使用高压蒸汽灭菌锅(致微仪器有限公司)经121 ℃灭菌30 min,倒至9 cm的一次性培养皿中备用。
1.1.3 接种材料 生长至5~6叶期的盆栽K326品种健康烟株。
1.2 病原菌的分离
依据方中达(1998)的组织分离法对病原菌进行分离培养。操作步骤:用经火焰杀菌冷却后的手术刀从叶片病健交界处切取大小约5 mm的病组织,经70%酒精消毒处理10 s,再由0.1%升汞溶液浸泡3~5 min,用无菌水冲洗3次后放在无菌滤纸上吸干水分,将组织接于PDA培养基上,28 ℃恒温培养3 d,挑取组织周围的白色菌丝进行纯化。
1.3 病原菌致病性测定
将纯化得到的病原菌菌株分别接种于PDA培养基上,暗培养3 d。在超净工作台上,用直径5 mm的无菌打孔器打取菌碟,将菌碟左右对称无伤接种于烟株第4~6片叶上,以接种空白PDA碟为对照,每盆接3片叶。将接种叶片用自封袋套袋,盆壁贴标签,置于28 ℃恒温培养箱中,保持湿度75%以上,5 d后观察叶片发病情况,对发病叶片进行病原菌分离,通过柯赫氏法则验证病原菌。
1.4 病原菌鉴定
1.4.1 形态学鉴定 参照郭强等(2019)的方法,将菌株分别接种于PDA和OA培养基上,28 ℃恒温暗培养7 d后,观察记录菌落形态、颜色、菌丝疏密程度等,挑取菌丝体制作玻片,在光学显微镜下观察病原菌菌丝形态和产孢结构特征。
1.4.2 分子生物学鉴定 将分离菌株接种于带有灭菌半透膜的PDA培养基上,28 ℃暗培养5 d后,收集新鲜菌丝,参照真菌DNA提取试剂盒[生工生物工程(上海)股份有限公司]的步骤进行病原真菌DNA提取。使用引物ITS1(5'-TCCGTAGGTGAA CCTGCGG-3')/ITS4(5'-TCCTCCGCTTATTGATAT GC-3')(江艳等,2018);TUB2Fd(5'-GTBCACCTYCA RACCGGYCARTG-3')/TUB4Rd(5'-CCRGAYTGR CCRAARACRAAGTTGTC-3')(Wondenberg et al.,2009);RPB2-5F2(5'-GGGGWGAYCAGAAGAAGG C-3')/fRPB2-7cR(5'-CCCATRGCTTGYTTRCCC AT-3')(Sung et al.,2007);LROR(5'-GTACCCGCT GAACTTAAGC-3')/LR7(5'-TACTACCACCAAGAT CT-3')(Hou et al.,2020)对菌株的rDNA-ITS序列及、、LSU基因进行PCR扩增,扩增条件参照Chen等(2015)、江艳等(2018)的方法进行。PCR产物用1.5%琼脂糖凝胶进行电泳检测后委托生工生物工程(上海)股份有限公司进行测序。
从GenBank中收集已知的其他相关病原菌的序列信息,通过MAFFT v.7(https://mafft.cbrc.jp/alignment/software/)进行序列比对,使用TrimAl v.1.3进行序列剪切,以MEGA 7.0将剪切后的序列按照ITS、LSU、、的顺序进行拼接,应用IQ-TREE v.1.6.12将拼接后的序列采用最大似然法(Bootstrap值为1000次)构建系统发育进化树。
1.5 病原菌生物学特性测定
1.5.1 不同温度对病原菌菌丝生长的影响 使用直径5 mm的灭菌打孔器在培养3 d的菌落边缘打取菌碟,将菌碟的菌丝面朝下接种于PDA培养基中央,分别置于5、10、15、20、25、28、30和35 ℃恒温培养箱中暗培养(刘利佳等,2021)。每处理3次重复,7 d后观察菌落生长情况,用十字交叉法测量菌落直径,下同。
1.5.2 不同培养基对病原菌菌丝生长的影响 将5 mm的菌碟菌丝面朝下接种于8种不同培养基上,置于28 ℃恒温培养箱中暗培养(何世芳等,2021)。
1.5.3 不同碳、氮源对病原菌菌丝生长的影响 以Czapek为基础培养基,分别用等量的葡萄糖、乳糖、甘露醇、肌醇、山梨糖醇和可溶性淀粉替代培养基中的蔗糖;同理,以等量的蛋白胨、硝酸铵、牛肉浸粉、氯化铵、尿素、甘氨酸和丙氨酸替代培养基中的硝酸钠,制备不同碳、氮源培养条件(苟攀宁等,2021)。
1.5.4 不同pH对病原菌菌丝生长的影响 以PDA为基础培养基,使用1% HCl和1% NaOH溶液调节培养基的pH为8个不同梯度(4、5、6、7、8、9、10和11)(姚锦爱等,2021)。
1.5.5 不同光照条件对病原菌菌丝生长的影响 将5 mm的菌碟接种于PDA培养基上,分别置于3种光照条件(全光照、全黑暗、12 h光暗交替)的培养箱中恒温培养。
材料计划应详尽并略有富余,一般应为计划用量的102%,数量较少的关键管件应加倍计划,计划应周密、全面,必须有复核手续,避免出现因材料短缺造成停工、窝工现象,确保工程顺利施工。
1.5.6 病原菌菌丝致死温度测定 将5 mm的菌碟放入装有1 mL无菌水的1.5 mL无菌离心管中,分别置于40、45、50、55、60和65 ℃的恒温水浴锅中处理10 min(先预热1 min),取出后立即放入装有常温水的烧杯中冷却;将处理后的菌碟接于PDA培养基中央,28 ℃恒温培养。连续观察7 d,确定菌丝致死温度,以1 ℃为温度梯度,重复上述试验,最终确定致死温度范围(徐辉等,2020)。
1.6 统计分析
运用Excel 2010求取试验数据的平均值、标准偏差以及构建柱形图,采用SPSS Statistics 26的Duncan’s新复极差法进行单因素方差分析(One-way ANOVA)。
2 结果与分析
2.1 病害症状
病害主要发生在烤烟成熟期,病原菌侵染叶片形成病斑。田间症状表现为病斑不规则或近椭圆形,中央灰白色,边缘棕褐色且有黄绿色晕圈(图1)。随着病害的加重,病斑不断扩大,易破裂形成穿孔,表面产生小黑点。

图1 烟草叶斑病病害田间症状Fig.1 Field symptoms of tobacco leaf spot disease
2.2 病原菌分离纯化结果
采用组织分离法对病样进行病原菌分离,纯化获得7株菌株,其中,来自钟山县菌株4株,编号分别为GHZS80、GHZS21、GHZS8和GHZS3;来自富川县菌株3株,编号分别为GHFC63、GHFC54和GHFC2。
2.3 病原菌致病性测定结果
健康盆栽烟株在无伤接种病原菌3 d后,接种部位开始变黄,周围长出白色菌丝;接种7 d后,水渍状病斑出现,逐渐变为褐色(图2-A),与田间自然发病症状相似,对照未表现症状(图2-B)。对发病的叶片进行分离观察,得到与原接种菌株培养性状和形态特征一致的病原菌,且7株菌株间的致病力无明显差异。依据柯赫氏法则,确定接种菌为烟草叶斑病致病菌。

图2 烟草叶斑病病原菌对烟草品种K326的致病性测定Fig.2 Pathogenicity determination of pathogen of tobacco leaf spot to K326 tobacco variety
2.4 病原菌培养性状及形态特征描述
病原菌在PDA培养基上生长迅速,培养5 d后菌落呈现出同心圆,正面内层菌落深灰色,向外棕黄色,最外层黄肤色,菌丝较紧密,气生菌丝稀疏,平板背面表现为中间黑褐色,向外棕褐色,边缘浅灰色(图3-A);培养25 d后菌落变黑色(图3-C)。在OA培养基上菌落深灰色,菌丝稠密,气生菌丝较PDA上发达(图3-B)。分生孢子器黑色,单房近球形,平均大小为109.300~440.330 μm×94.280~318.250 μm(n=8),产孢器上具喙状结构(大小约为169.130 μm×31.953 μm)(图3-D);分生孢子无色,近似椭圆形,无隔膜,平均大小为3.520~3.830 μm×1.840~2.230 μm(n=80)(图3-E);菌丝具分支有横隔,菌丝末端或中央分化出无色链珠状膨大细胞(图3-F)。
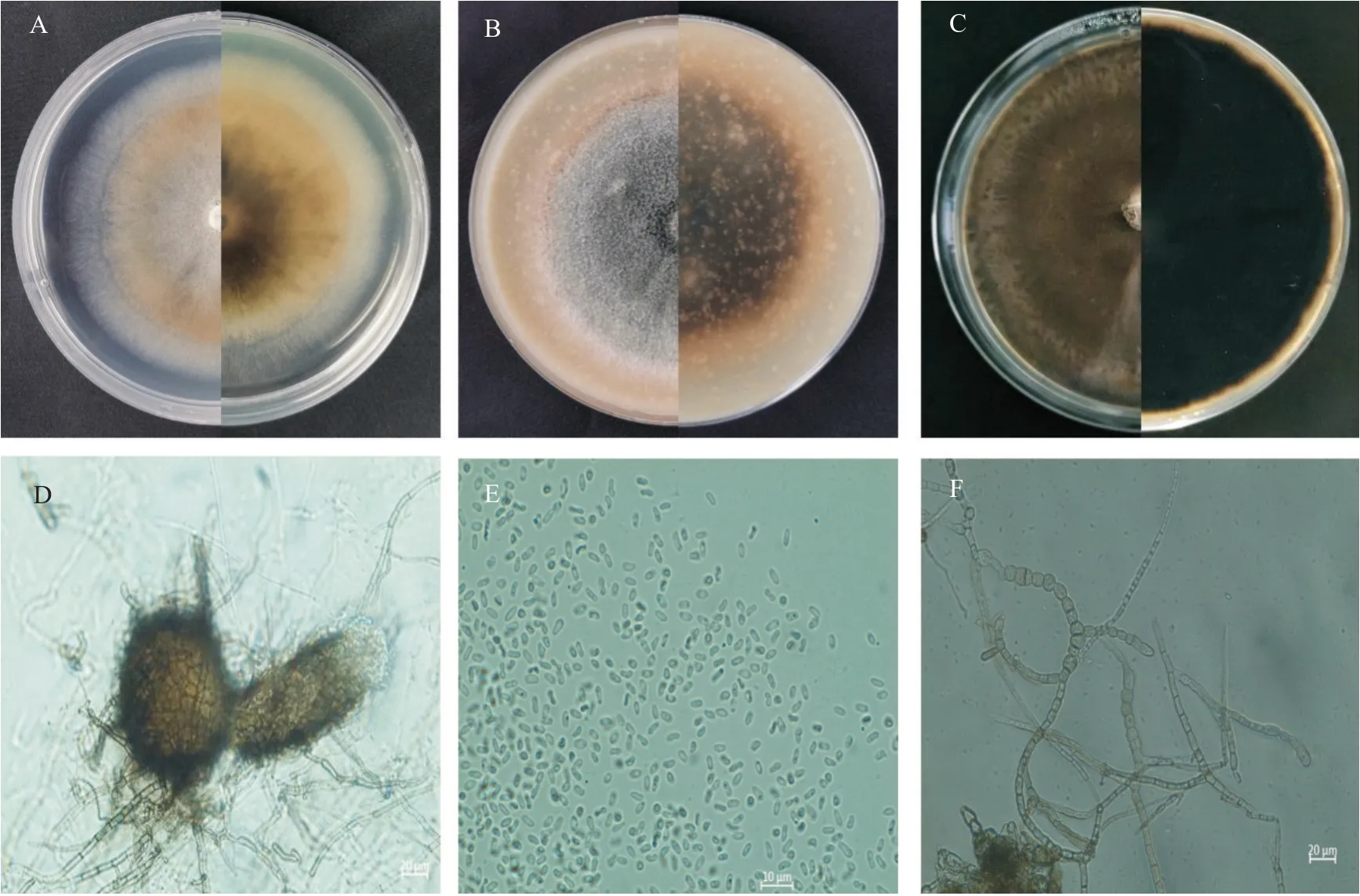
图3 病原菌培养性状及形态特征Fig.3 Culture traits and morphological characteristics of pathogens
2.5 病原菌分子生物学鉴定结果
将7株菌株的ITS、LSU、和序列测序结果进行处理和整合后提交至GenBank数据库,获得登录号(表1)。从GenBank中下载与7株菌株同源性较高以及同属内其他种的代表菌株的ITS、、、LSU序列(表2),以CBS 108.49作外群联合构建系统发育进化树,结果(图4)显示,7株菌株与LFN0148和YTH-12以100%的支持率聚为一支,能明显与其他种区分。对7株菌株的ITS、LSU、和序列信息进行BLAST比较分析,结果表明,各菌株在基因序列上未存在差异。菌株GHZS80、GHZS21、GHZS8、GHZS3、GHFC63、GHFC54、GHFC2与菌株LFN0148和YTH-12相比,ITS、LSU、和的同源性均达100%。因此,结合菌株的形态学特征,将7株菌株鉴定为。
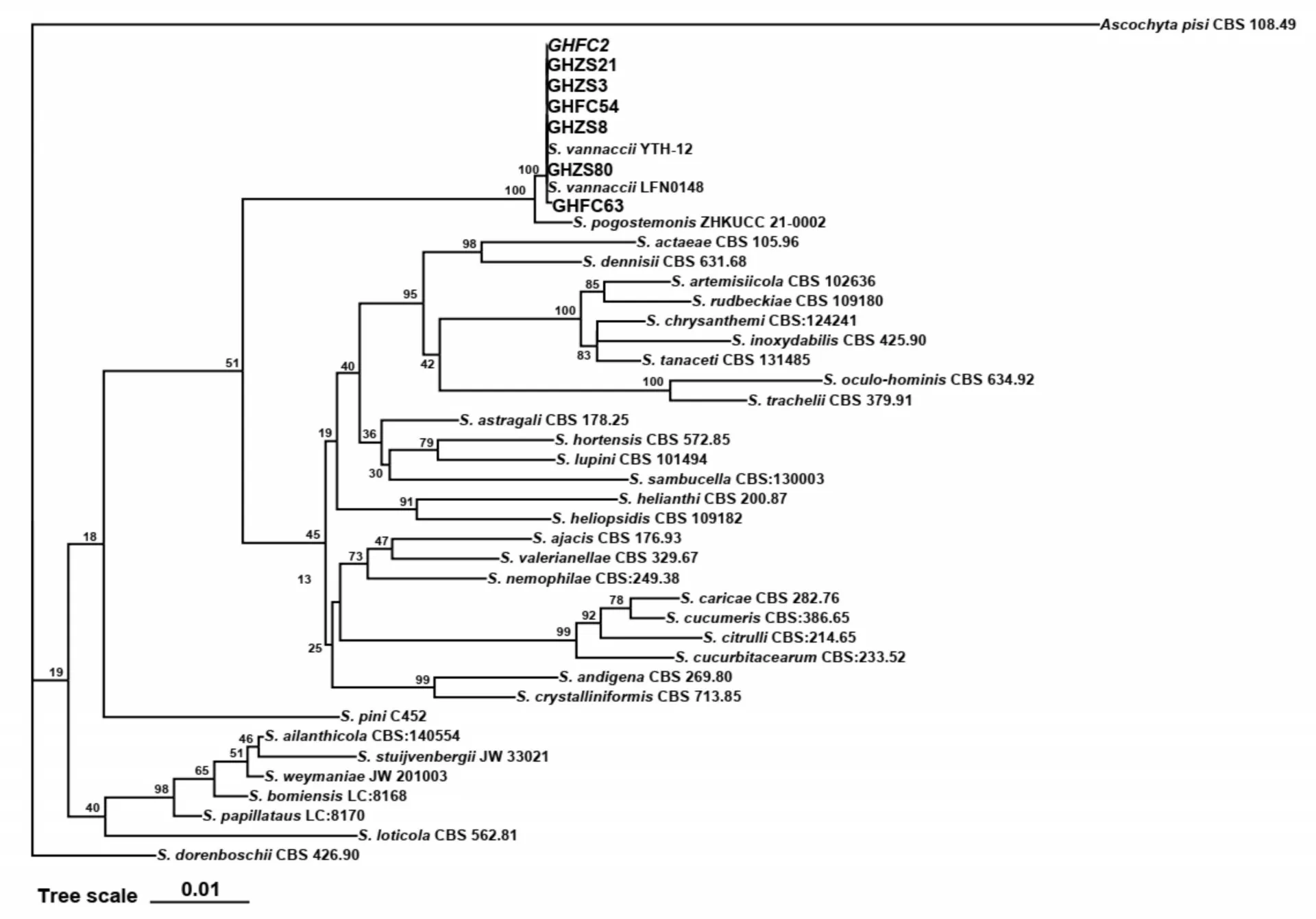
图4 基于ITS、LSU、RPB2和TUB2构建的烟草叶斑病病原菌系统发育进化树Fig.4 Phylogenetic tree of tobacco leaf spot pathogens based on ITS,LSU,RPB2 and TUB2
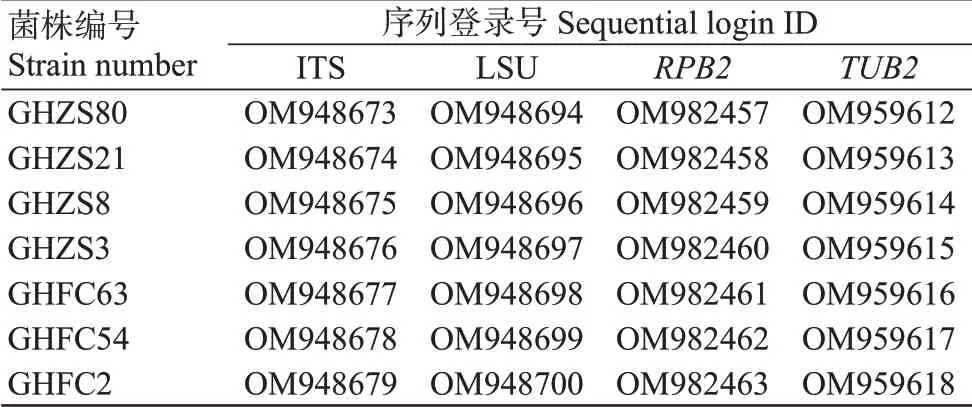
表1 菌株登录号Table 1 Strain login ID
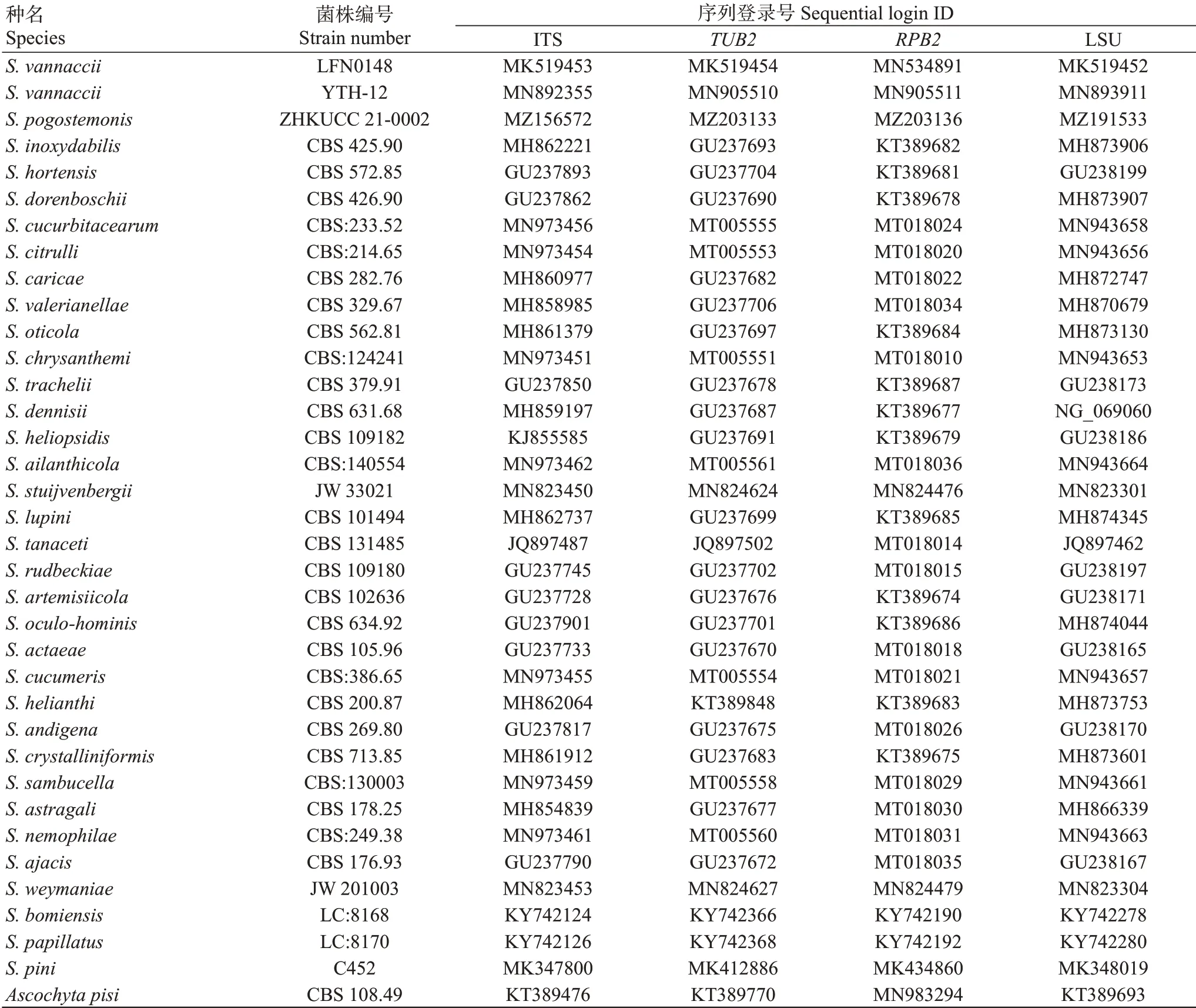
表2 从GenBank下载的相关菌株序列及信息Table 2 Sequence and information of relative fungal strains downloaded from GenBank
2.6 病原菌生物学特性测定结果
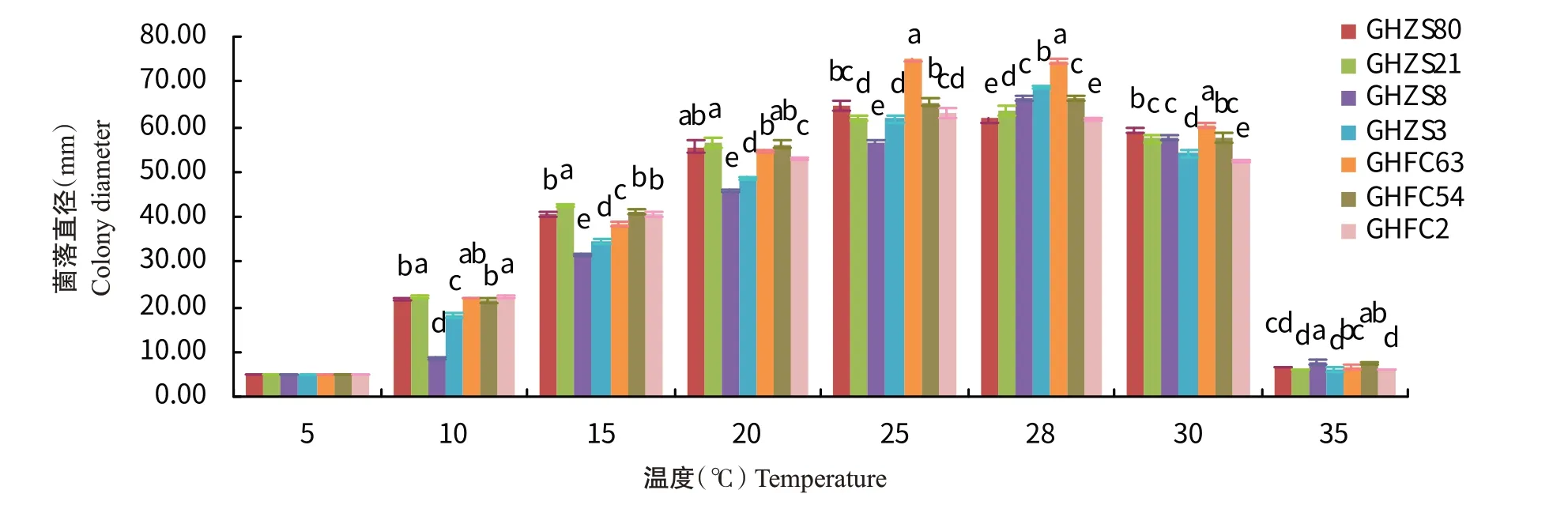
图5 不同温度对病原菌菌丝生长的影响Fig.5 Effects of different temperatures on mycelium growth of pathogens
2.6.2 培养基对病原菌菌丝生长的影响 在CMA、CDA、TomA、TobA和PA 5种培养基上,菌株GHZS8的生长速度最快,与其余6株菌株的菌落直径差异显著;菌株GHZS8的最适生长培养基为PA,菌株GHZS80、GHZS21、GHZS3、GHFC63、GHFC54和GHFC2的最适生长培养基均为PDA(图6)。综合各方面因素,7株病原菌的适宜培养基为PDA、OA和PA培养基。
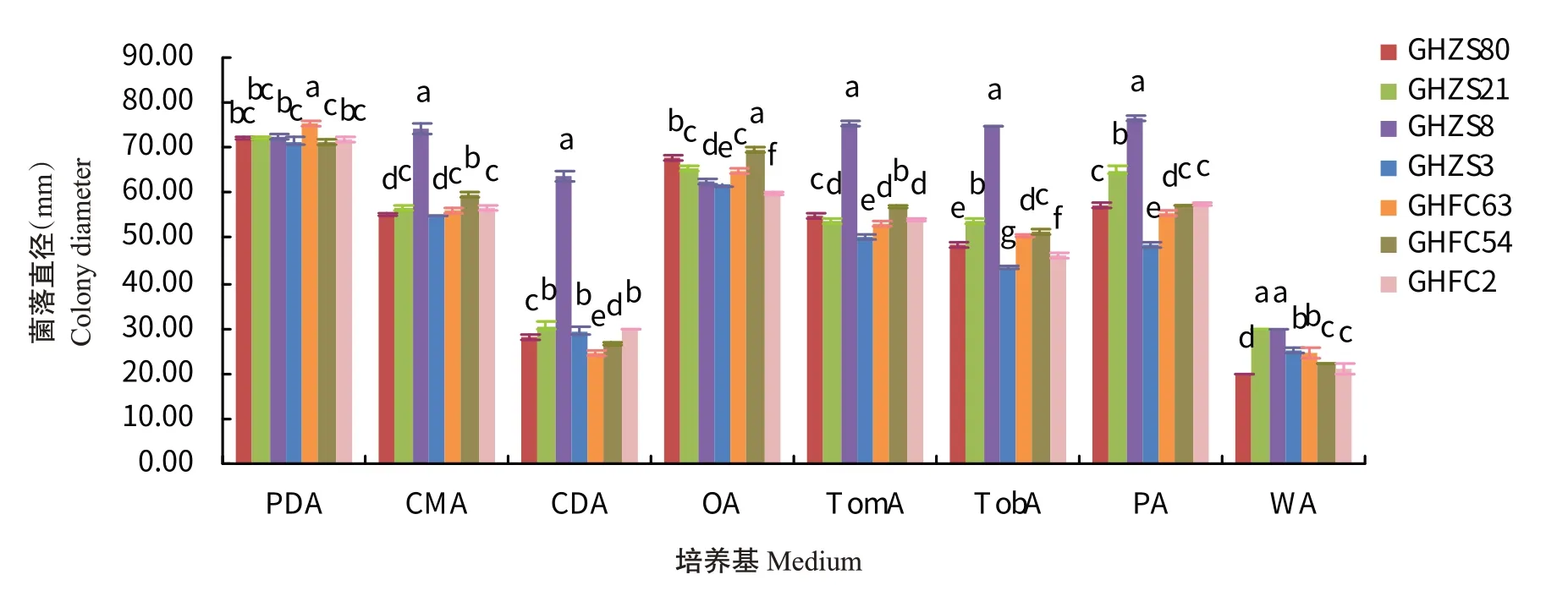
图6 不同培养基对病原菌菌丝生长的影响Fig.6 Effects of different media on mycelium growth of pathogens
2.6.3 碳源对病原菌菌丝生长的影响 7株菌株的最适碳源均为可溶性淀粉,且菌株GHZS8的生长速度最快,与其余6株菌株的菌落直径差异显著;在以乳糖为唯一碳源的培养基上菌株GHZS3生长最快,菌株GHFC63生长最慢;菌株GHZS8在除乳糖外的所有碳源条件下均表现出优势,生长速度均最快,与其余6株菌株的菌落直径差异显著(图7)。
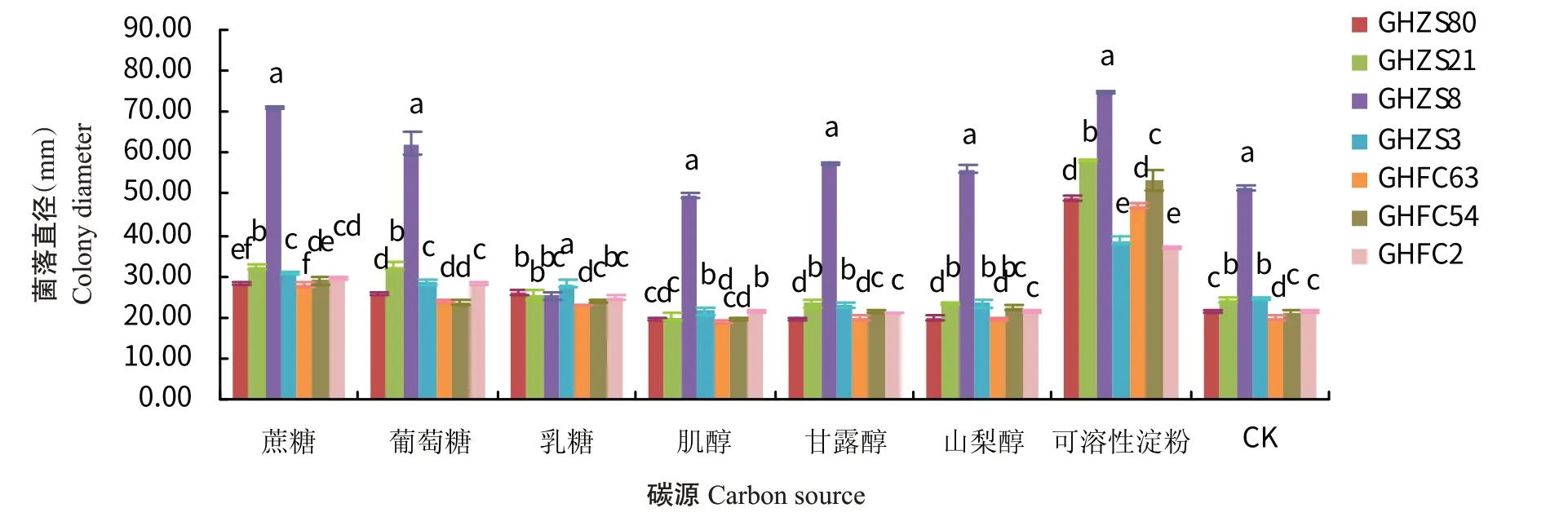
图7 不同碳源对病原菌菌丝生长的影响Fig.7 Effects of different carbon sources on mycelium growth of pathogens
2.6.4 氮源对病原菌菌丝生长的影响 以蛋白胨为唯一氮源时,菌株GHZS21、GHZS3和GHFC2的生长速度最快,优于在其他氮源培养基上的菌落直径;以牛肉浸粉为唯一氮源时,菌株GHZS80、GHZS8、GHFC63和GHFC54的生长速度最快,优于在其他氮源培养基上的菌落直径;菌株GHZS8在分别以蛋白胨、甘氨酸、丙氨酸、硝酸铵、牛肉浸粉和尿素为唯一氮源的培养基上生长速度均显著快于其他菌株,在以氯化铵为氮源的培养基上生长最慢,说明氯化铵为菌株GHZS8生长的最不适宜氮源(图8)。

图8 不同氮源对病原菌菌丝生长的影响Fig.8 Effects of different nitrogen sources on mycelium growth of pathogens
2.6.5 pH对病原菌菌丝生长的影响 7株菌株在pH 4~pH 11内均能生长,但最适pH不尽相同,其中,菌株GHFC54和GHFC2最适生长pH为6,菌株GHZS80、GHZS3和GHFC63最适生长pH为7,菌株GHZS21最适生长pH为8,菌株GHZS8最适生长pH为9;当pH为4时,7株菌株的生长均受到明显抑制,但菌株GHZS8的生长显著快于其他菌株(图9)。
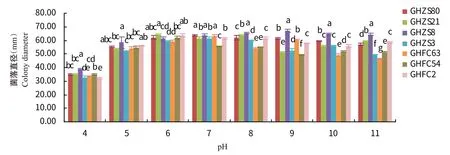
图9 不同pH对病原菌菌丝生长的影响Fig.9 Effect of different pH on mycelium growth of pathogens
2.6.6 光照对病原菌菌丝生长的影响 7株菌株均在全光照条件下生长最快,全光照处理对菌株GHFC2菌丝生长的影响较其余2种处理明显;光暗交替处理则对菌株GHFC54生长的影响较大;在全黑暗条件下菌株GHZS3生长最慢,与其他菌株的菌落直径差异显著(图10)。
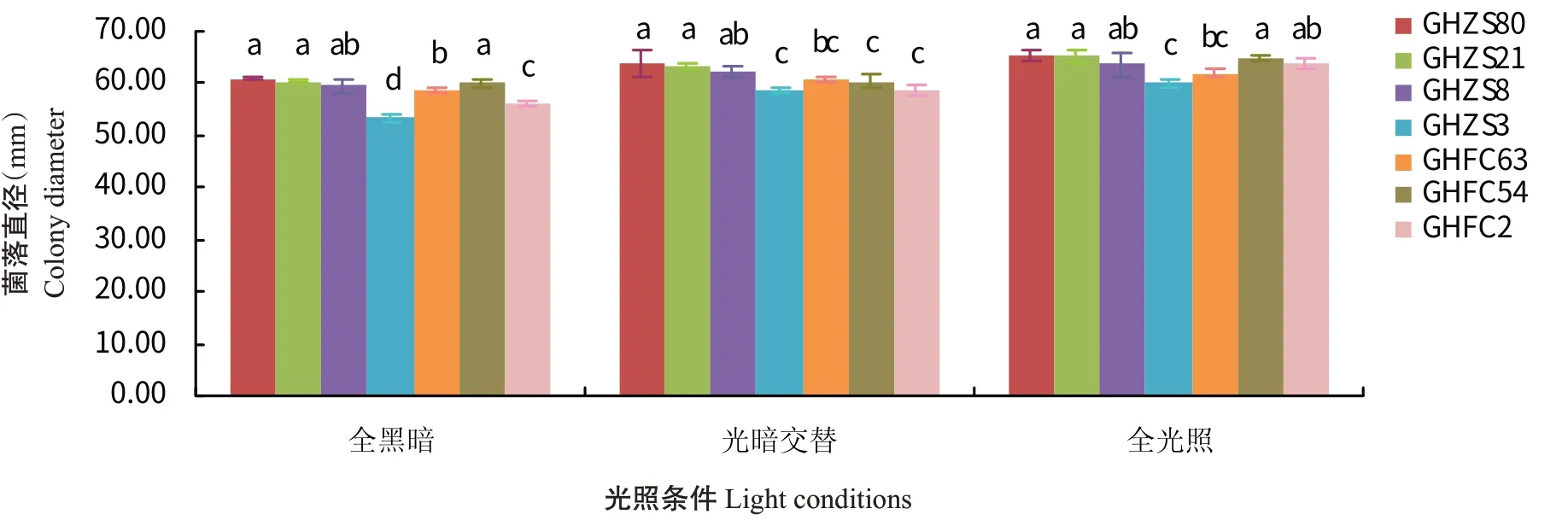
图10 不同光照条件对病原菌菌丝生长的影响Fig.10 Effects of different light conditions on mycelium growth of pathogens
2.7 病原菌的致死温度测定结果
7株菌株经45 ℃水浴处理10 min后在PDA培养皿上仍能生长,经50、55、60和65 ℃水浴处理10 min后菌株未生长。以1 ℃为梯度在45~50 ℃内对病原菌菌株进行水浴处理,结果显示7株菌株在50 ℃水浴处理10 min后菌丝不再生长,表明菌株的致死温度为50 ℃水浴10 min。
3 讨论
本课题组在调查中发现广西贺州市钟山县和富川县烟草品种K326上存在一种真菌性叶斑病害,田间症状表现为病斑不规则或近椭圆形,中央灰白色,边缘棕褐色且有黄绿色晕圈,受害后期病斑易破裂形成穿孔,表面产生小黑点,与常见烟草叶部病害的症状有所不同。通过形态特征结合多基因序列分析(ITS、LSU、和),将病原菌鉴定为,这是由引起烟草叶斑病在国内的首次报道。2019年,Crous等报道在巴西是一种植物致病真菌,可引起大豆豆荚炭疽病,随后He等(2021)报道在我国广西百色市可引起菊科杂草野茼蒿叶斑病,证实的非寄主专一性。菊科是烟田种类最多的杂草之一(罗战勇等,2007),野茼蒿是否可作为在烟田中传播病原体的桥梁以及对除烟草品种K326以外的其他品种烟草的致病性还有待验证。
本研究中在PDA培养基上生长的正面菌落特征为最内层深灰色,向外棕黄色,最外层黄肤色,与大豆豆荚炭疽病的致病菌株LFN0148和野茼蒿叶斑病的致病菌株YTH-12在PDA培养基上的菌落特征存在一定差异,菌株LFN0148表现出正面中央黑褐色,边缘醋灰色,菌株YTH-12表现为正面内圈灰白色,外圈橙黄色,产生上述特征差异的原因可能与地域、不同寄主以及培养周期有关。本研究中的分生孢子器、分生孢子大小以及菌丝等的形态特征与Crous等(2019)和He(2021)等的描述基本吻合。本研究在前人对形态特征描述的基础上增加了对膨大细胞的描述,并对产孢器上的喙状结构进行测量,大小约为169.130 μm×31.953 μm。
目前,尚无关于生物学特性方面的报道。本研究对7株分离菌株的生物学特性测定结果表明,7株菌株在10~35 ℃内均可生长,菌丝的最低致死温度为50 ℃水浴10 min,病原菌的生长温度范围较广,适宜菌丝生长的温度范围为25~28 ℃。贺州市为典型的亚热带季风气候,日照充足,土壤肥沃(莫水英,2020),4—7月的月平均温度为18~34 ℃,年平均相对湿度在78%左右,年均降水量1535.6 mm,病原菌的生长特性与该地区的气候与环境条件相适宜,因此由引起的烟草叶斑病发生流行的潜在风险较高。菌株GHFC54和GHFC2生长最适pH为6;菌株GHZS3、GHZS80和GHFC63生长最适pH为7;菌株GHZS21生长最适pH为8;菌株GHZS8生长最适pH为9,表明喜好在弱酸性至弱碱性环境条件下生长。7株菌株在全光照条件下生长最快,最适碳源为可溶性淀粉,菌株GHZS21、GHZS3和GHFC2的最适氮源为蛋白胨,菌株GHZS80、GHZS8、GHFC63和GHFC54的最适氮源为牛肉浸粉,说明同一病原菌的生物学特性在不同分离菌株上存在差异。本研究初步探讨了不同温度、pH、光照、培养基以及不同碳氮源处理对菌丝生长的影响,存在一定的局限性,但对引起烟草叶斑病的发生和防治提供了理论参考,下一步研究工作将聚集在的侵染机制以及病害防治等方面。
4 结论
引起广西贺州烟区烟草叶斑病的病原菌为,最适菌丝生长的温度为25~28 ℃,菌丝的最低致死温度为50 ℃水浴10 min,该菌喜好在弱酸性至弱碱性、阳光充足且营养丰富的环境条件下生长。根据病原菌的生物学特性,在烟草生产过程中可通过控制烟草种植密度、加强田间管理以及采取化学、生物防治手段对由引起的烟草叶斑病进行综合防控。
