核盘菌Ss160的基因克隆与功能初探
2022-09-03吴姗左蓉李艳赵传纪董志雪刘杰何贻洲吴钰坡高峰白泽涛刘胜毅陈建国
吴姗,左蓉,李艳,赵传纪,董志雪,刘杰,何贻洲,吴钰坡,高峰,白泽涛*,刘胜毅,陈建国
(1.中国农业科学院油料作物研究所,农业农村部油料作物生物学与遗传育种重点实验室,湖北 武汉,430062;2.湖北大学生命科学学院,湖北 武汉,430062)
由核盘菌(Sclerotinia sclerotiorum)引起的真菌性病害-菌核病可侵染600多种植物,包括几乎所有的双子叶植物和一些单子叶植物。核盘菌侵染初期在寄主植物组织中形成棉花状菌丝,附着于植物健康组织体表上,导致植物组织腐烂,进而坏死,其菌丝形成的菌核能够在土壤中存活8 年以上,当周围温度为15~25℃时可以再次侵染地上植物[1~3],给我国的农作物造成了巨大经济损失[4~6]。油菜作为我国重要的油料作物,常年受菌核病危害,据统计菌核病造成的油菜产量损失通常在10%~20%之间,并且菌核病病害程度愈发严重,部分产区产量损失高达80%[7,8]。因此,目前迫切需要挖掘菌核病抗性基因,解析核盘菌-植物作用机理,进而培育菌核病抗病品种,提高植物对菌核病的防控能力和水平。
植物应对病原菌的先天免疫反应有两种模式,分别为模式识别受体诱导的免疫反应(PTI)和效应蛋白诱导的免疫反应(ETI)[9]。PTI 反应是植物细胞膜上的模式识别受体蛋白(PRRs)对病原相关分子模式(PAMPs)的识别,通过胞内的级联将信号在植物体内扩大和传递,ETI 是植物抗病基因(resistant gene)特异性识别病原菌效应蛋白而触发产生的新一轮免疫反应,ETI 相对于PTI 而言,免疫反应更加迅速和强烈,往往伴随着超敏反应来限制病原菌的入侵[10,11]。效应蛋白是由病原菌分泌的,这些效应物通常是小而独特的蛋白质,能够通过改造植物体内的细胞结构、代谢途径等方式击败PTI,从而利于病原菌侵染寄主植物[12]。近年来通过筛选病原菌效应蛋白在植物中的互作靶标取得了很好的进展,研究发现某些病原菌能够与植物14-3-3 蛋白相互作用,如蚜虫唾液分泌蛋白M10 及其同源物Ag10K 可以与番茄14-3-3蛋白TFT7相互作用从而介导番茄抵抗蚜虫的能力[13]。由此可见,从病原菌效应蛋白入手,挖掘其在寄主植物中的互作因子,解析病原菌-植物互作机制,能够为未来通过基因工程改造基因提高植物抗病水平提供一种现实可行的策略。
由于核盘菌为非专性寄生型真菌,寄主范围广且侵染复杂,所以核盘菌-油菜的互作机制目前仍然不清楚。但随着研究的深入,研究者鉴定到部分核盘菌分泌蛋白能够对植物产生毒性,包括SsSSVP1,SsCP1,SsSm1,以及Ss-Caf1 等,其中Ss-CP1能够与油菜的PR1蛋白在质体外相互作用利于核盘菌的侵染[14]。研究者基于三代测序技术重新测序组装完成的核盘菌基因组鉴定到70 个可能效应蛋白[15],但是这些效应蛋白在核盘菌-植物互作中具有怎样的功能,目前缺乏深入研究。本研究基于实验室核盘菌接种油菜叶片的不同时间点收集到的菌丝转录组数据鉴定到一个核盘菌基因Ss160(Sscle04g035160)在菌-植物互作中诱导表达,并且该基因为上述预测的效应蛋白之一,因此,本研究将以此基因为研究点,通过生物信息分析以及分子实验对其功能进行初步研究。
1 材料和方法
1.1 材料
烟草种子为本实验室保存。核盘菌(S.sclerotiorum)WH13 为本实验室保存。酵母双杂交实验所用的酵母菌株AH109 为本实验室保存。亚细胞定位表达载体p2300-GFP、酵母双杂交阳性对照载体pGBKT7-p53+pGADT7-T,酵母双杂交阴性对照载体pGBKT7-Lam+pGADT7-T 均由本实验室改造并保存。大肠杆菌(Escherichia coli)DH5α 购自深圳康体生命科技有限公司,农杆菌GV3101 购自武汉转导生物实验室有限公司。
2×Phanta Max Master Mix、同源重组试剂盒购自南京诺唯赞生物科技有限公司;反转录试剂盒、限制性内切酶BamH1、EcoR1 及DL2000 Marker 购自TaKaRa 公司;琼脂糖凝胶回收试剂盒、质粒回收试剂盒购自上海天根生物工程有限公司;YPDA、YPD培养基购自青岛高科工业园海博生物技术有限公司;选择性缺陷培养基(SD/-Trp-Leu、SD/-His-Trp-Leu-Ade)购自Clontech 公司;AbA 购自solarbio 公司;X-α-Gal 购自INALCO 公司;Yeast extract、Tryptone 购自Thermo 公司;NaCl、DMSO、MgCl2·6H2O 购自国药集团化学试剂有限公司;鲑鱼精购自solarbio公司,乙酰丁香酮购自Acmec公司。
1.2 方法
1.2.1 核盘菌Ss160基因的克隆和表达模式 为收集核盘菌菌丝,在铺有玻璃纸(高温灭菌)的PDA固体培养基上接种活化的核盘菌菌丝块,黑暗培养。当菌丝长满平板后,将菌丝刮下置于液氮中研磨成粉,并利用Trizol 法提取核盘菌RNA,用超微量分光光度计NanoDrop 2000 检测RNA 质量和浓度,之后根据TaKaRa 公司反转录试剂盒说明书反转录合成cDNA链,获得的核盘菌cDNA作为后续基因扩增的模板。
Ss160基因引物是根据核盘菌基因组中公布的CDS 序列设计的(表1),酵母载体引物和亚细胞定位引物5’和3’端分别加入同源重组序列和酶切位点。以核盘菌WH13 cDNA 为模板,按照2×Phanta®Max Master Mix(Dye Plus)使用说明准备50µL 扩增体系:2×Phanta Max Master Mix 25 µL,正向反向引物分别2µL,cDNA 4µL,ddH2O 17µL。反应条件:95℃预变性5 min;95℃变性15 s,55℃退火15 s,72℃延伸1min ,34 个循环;72℃延伸5 min。用1%琼脂糖凝胶电泳检测PCR 产物,根据回收试剂盒说明书对Ss160进行切胶回收。

表1 实验所用引物Table 1 Primers for the experiment
1.2.2 核盘菌Ss160生物信息学分析 将克隆得到的Ss160核盘菌基因与基因组对应基因序列进行比对分析以确定获得的基因是本研究的目的基因。进一步通过生物信息学方法对该基因的序列特征进行分析,包括理化性质[16]、信号肽[17]和蛋白结构[18]等。利用NCBI 数据库对Ss160的同源基因进行搜索,并利用MEGA5.2 软件[19]对不同物种中Ss160的同源基因序列进行序列比对和进化树构建,以明确Ss160的亲缘关系,其中序列比对的展示利用GENEDOC 软件(https://genedoc. software. informer.com/download/)完成。
1.2.3 Ss160 的亚细胞定位 为初步探索Ss160的定位,本研究进一步利用同源重组法构建了亚细胞定位载体,将克隆到的Ss160与p2300-GFP 载体进行连接,体系为:6µL p2300-GFP 线性载体(KpnI 和BamH I 酶切回收获得)、3µLSs160回收产物、1µL Exnase Ⅱ、3 µL 5×CE ⅡBuffer、补ddH2O 至15 µL。之后37℃恒温孵育器孵育30 min 以上。连接产物通过热激法转化大肠杆菌,在超净工作台中挑单克隆,通过菌液PCR 法鉴定阳性单克隆,送测序。测序正确的活化菌液与50%甘油1:1 混匀,于-80℃冰箱保存。同时将该菌液扩大培养用于质粒的提取,质粒通过冻融法转化农杆菌GV3101:-80℃冰箱中取出农杆菌感受态细胞GV3101,冻融后,分别加入10µL 连有Ss160的重组质粒以及空载对照质粒,吹打混匀;液氮中冷冻5 min,37℃恒温水浴锅水浴5 min;超净台内加入新鲜的无抗生素液体LB 培养基500µL,28℃条件下220 r/min 活化2 h;取100µL 菌液均匀涂抹到LB(含50µg/mL Kan 和50µg/mL Rif)平板,28℃条件下倒置培养2 d,挑单菌落进行菌液PCR 鉴定阳性单克隆。将鉴定为阳性的克隆菌液按1:1 比例加入50%甘油保菌,-80℃冰箱保存备用,并命名为35S::Ss160-GFP和p2300-GFP。
将构建好的亚细胞定位表达载体35S::Ss160-GFP农杆菌菌液接种10µL至10 mL的LB液体培养基(含50 µg/mL Kan 和50 µg/mL Rif),28℃条件下220 r/min 过夜活化。之后取20 µL 活化菌液到20 mL 的LB(含50 µg/mL Kan 和50 µg/mL Rif)液体培养基中扩大培养。离心收集菌体并加入MES 液体培养基悬浮菌体,黑暗静置2 h,然后用注射器将菌液注射到4~5 周烟草叶片的下表皮,温室条件下黑暗培养12 h,光照培养36 h,用激光共聚焦显微镜(Nikon A1)观察GFP 荧光蛋白在细胞中的表达部位。
1.2.4 瞬时表达Ss160烟草叶片菌核病抗病鉴定将分别含有35S::Ss160-GFP以及空载体对照p2300-GFP质粒的农杆菌菌液注射到4~5周烟草叶片(分别注射20~30 个叶片)下表皮,黑暗培养48 h后在接种室对转化了35S::Ss160-GFP和p2300-GFP的叶片以及野生型烟草叶片进行核盘菌离体接种。具体接种方法为:首先将新鲜核盘菌菌丝块接种在PDA 固体培养基,24 ℃条件下黑暗培养至菌丝生长至平板2/3 处时,用打孔器在菌丝边缘打孔(8 mm×8 mm),得到的菌丝块菌丝朝下接种到离体烟草叶片上。接种完成后的烟草叶片放在封闭的箱子中并保持湿度在80 %以上以利于核盘菌生长。分别在接菌后24 h、36 h、48 h、60 h测量病斑大小并进行表型拍照,利用双因素差异分析完成统计数据分析。
1.2.5Ss160的转录活性检测 为研究Ss160是否具有转录激活活性,本研究将Ss160分别连入酵母的激活结构域(activation domain, AD)载体pGADT7和结合结构域(binding domain, BD)载体pGBKT7。具体载体构建方法为:用EcoR I 和BamH I 酶切pGBKT7或pGADT7获得线性质粒,PCR 扩增回收Ss160CDS全长片段,之后利用同源重组法进行连接,连接体系为:6 µL pGBKT7线性载体、3 µLSs160回收产物、1µL Exnase Ⅱ、3µL 5×CEⅡBuffer、补ddH2O 至15 µL,之后37℃恒温孵育器孵育30 min 以上。连接产物转化大肠杆菌:-80℃冰箱中取出大肠杆菌DH5α 感受态,冰上融化5 min,立刻加入重组产物,轻拨混匀,冰浴30 min;42℃热激60 s,冰浴2 min;加入500 µL 新鲜LB 液体培养基,37℃条件下200 r/min 摇1 h;取200µL 菌液均匀涂布在固体LB(含50µg/mL Kan)培养基上,37℃培养箱倒置培养过夜。超净台中挑单克隆进行菌液PCR 并将阳性单克隆送测序,测序结果比对成功的菌液用50%的甘油1∶1 保菌,-80℃保存,连接成功的载体分别命名为AD-Ss160和BD-Ss160。
酵母感受态细胞的制备:从-80℃取出冻存的AH109 酵母菌株冰上解冻,在超净工作台中吸取10µL 菌液,在YPDA 固体培养基上划线培养2~3 d。挑选直径为3 mm 左右的单克隆于15 mL 的离心管中并加入3 mL 的YPDA 液体培养基中,28℃条件下220 r/min 过夜振荡培养。取上述活化的培养液5µL 加入250 mL 的锥形瓶中,并加入50 mL YPDA 培养基,28℃条件下220 r/min 振荡培养16~20 h后,用分光光度计测量OD600值,直到达到0.15~0.3。室温条件下,将菌液700g离心5 min;弃上清,用100 mL 的YPDA 重新悬浮细胞沉淀,28℃条件下220 r/min 荡培养3~5 h,用分光光度计测量OD600值,直至达到0.4~0.5。将上步中的培养液平均分装到2 个50 mL的离心管中,室温条件下,700g离心5 min,弃上清,分别用30 mL的无菌去离子水重新悬浮沉淀。室温条件下,700g离心5 min,弃上清,分别用1.5 mL的1.1×TE/LiAc 重新悬浮细胞沉淀,将细胞悬浮液转移到1.5 mL 的离心管,12 000 r/min 离心15 s,弃上清,用600 µL 的1.1 × TE/LiAc 重新悬浮细胞沉淀,酵母感受态细胞制备完成,立即用于转化。
质粒转化酵母感受态细胞:在预先预冷的1.5 mL 的离心管中加入两个共转的100 ng 质粒DNA 以及5µL 的Carrier DNA(使用前将Carrier DNA 变性,先在95~100℃条件下加热5 min,再迅速置于冰上5 min,重复一次),加入50 µL 酵母感受态细胞,轻轻用枪吸打混匀,加入500µL 的PEG/LiAc,轻轻用枪吸打混匀,30℃温育30 min,期间每隔10 min轻轻地颠倒混匀,加入20 µL 的DMSO 混匀,42℃水浴15 min,期间每隔5 min 温和地混匀。13 000 r/min离心15 s,弃上清,用1 mL 的YPD 重新悬浮沉淀,28℃,220 r/min 振荡培养1 h,13 000 r/min 离心15 s,弃上清,用1 mL 的0.9% (m/V) NaCl 溶液重新悬 浮,取100 µL 涂 布SD/-Leu/-Trp 平 板。SD/-Leu/-Trp 平板长出单克隆后,每对共转质粒挑单克隆在超净台中用无菌水稀释10 倍和100 倍,做4 个重复。取稀释好的菌液用移液枪点到加入了X-α-Gal+AbA 的四缺固体培养基上,观察长斑情况。分别将BD 空载与测序正确的AD-Ss160 载体或者AD空载与测序正确的BD-Ss160 共同转化酵母菌株AH109,同时共转阳性对照BD-p53 和AD-T 以及阴性对照BD-lam 和AD-T,两个蛋白如若互作则可启动报告基因表达,产生的蛋白产物能够使得酵母因在缺陷型培养基上长斑或显蓝色,两个蛋白若不互作,则无法启动报告基因表达,无法在对应四缺培养基上长斑或显蓝。
1.3 统计分析方法
实验数据导入SPSS 22.0 进行数据检验,数据符合正态分布,统计方法使用独立样本t 检验,采用均值±标准差表示,P>0.05表示显著差异性。
2 结果与分析
2.1 Ss160的克隆与序列特征分析
本研究在核盘菌中克隆得到Ss160基因序列,其CDS 序列长度为849 bp,共编码282 个氨基酸。根据在线预测,其蛋白分子量大小为30 kDa,理论等电点pI 为4.43,不稳定系数为32.16,为稳定蛋白,平均疏水性为0.182,为亲水蛋白。通过SignalP5.0 预测显示Ss160 的N 端具有明显的信号肽(图1A)。TMHMM Server v. 2.0 预测显示该蛋白不存在跨膜结构域。序列比对发现,该基因氨基酸序列在真菌中高度保守(图1B),进化树结果显示Ss160 与灰霉、白腐菌、褐腐菌的亲缘关系最近(图1C)。为了解Ss160的高级结构,我们利用I-TASSER 软件对蛋白进行三维结构预测,结果显示Ss160主要有α-螺旋和无规则卷曲组成,无特殊结构域(图1D)。
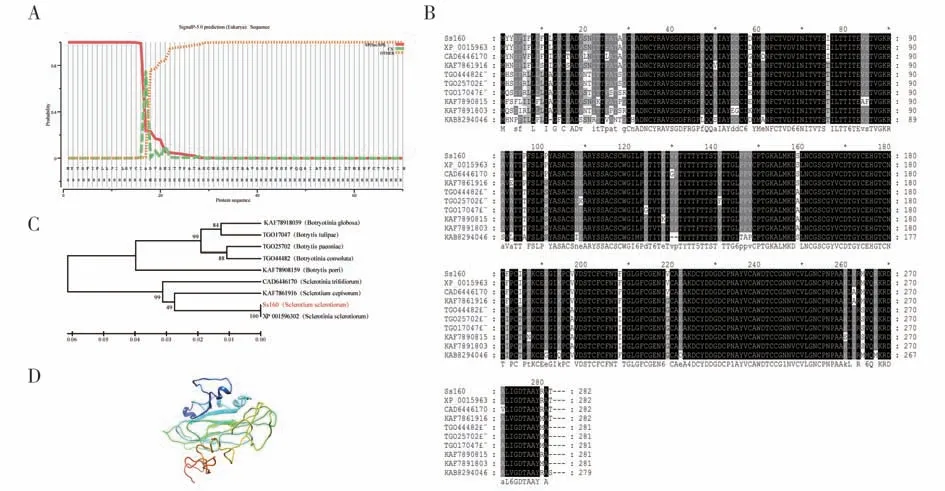
图1 Ss160生物信息分析Fig.1 Bioinformatics analysis of Ss160
2.2 Ss160的亚细胞定位
基因的功能定位可揭示其执行功能的细胞场所,Ss160 作为一种可能参与核盘菌-植物互作中的效应蛋白,为探索Ss160 在植物细胞中的功能定位,本研究首先构建了带有Ss160完整编码框的GFP 融合蛋白表达载体35S::Ss160-GFP,将构建好的无碱基突变的重组质粒导入农杆菌备用;为明确目标基因的功能定位,本研究将已报道的能够定位在细胞核和细胞膜的标记载体(FIB2-mCherry)[20]农杆菌菌液与含有35S::Ss160-GFP或空载体35S::GFP农杆菌菌液分别混合,共同注射适龄烟草叶片,黑暗培养12 h,光照培养36 h,在激光共聚焦显微镜下观察荧光信号,结果表明,GFP空载体的绿色荧光与标记载体的红色荧光在细胞膜和细胞核能够很好的重叠为黄色荧光,说明二者共定位在细胞膜和细胞核,与对照相比,Ss160 与空载体的细胞定位无明显差异(图2),因此,Ss160 在植物细胞中无特异性的定位。
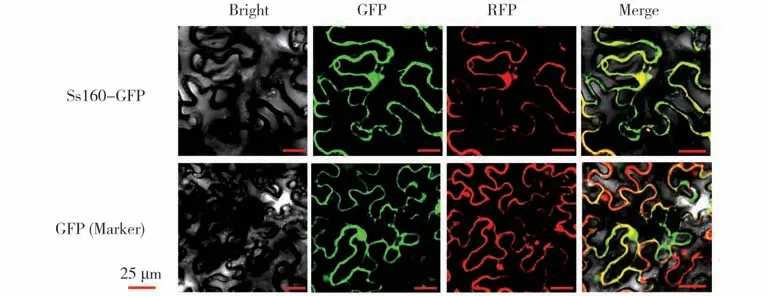
图2 Ss160烟草亚细胞定位Fig.2 The subcellular localization of Ss160 in tobacco(Nicotiana tabacum)
2.3 瞬时表达Ss160烟草叶片菌核病抗病性鉴定
为了初步研究异源表达Ss160对植物菌核病抗性的影响,本研究选取生长期为4~5周的烟草,选取20~30 个长势一致的叶片分别注射含有35S::Ss160-GFP和空载对照35S::GFP质粒的农杆菌菌液,经48 h 黑暗培养后,将瞬时表达35S::Ss160-GFP和35S::GFP的烟草叶片以及未注射的对照叶片离体接种核盘菌菌丝,湿度保持在80%以上黑暗培养。分别在接种后24 h、36 h、48 h、60 h测量病斑长度和宽度,进而进行病斑面积数据统计。结果表明,相比于野生型烟草叶片以及瞬时表达空载体的烟草叶片,瞬时表达Ss160 的烟草叶片菌核病病斑扩展速度明显较慢,且随着病害持续发展,病斑大小差异更加显著; 数据统计同样显示异源表达Ss160 的病斑面积显著低于对照(野生型和表达空载的叶片)(图3)。该结果初步表明Ss160能够提高植物对菌核病的抗性水平。

图3 瞬时表达Ss160的烟草离体叶片接种核盘菌抗性鉴定Fig.3 Sclerotinia disease resistance examination of transient expression of Ss160 gene in tobacco(Nicotiana benthamiana)by detached leaves inoculation method
2.4 Ss160转录激活活性检测
为探索Ss160 是如何在核盘菌-植物互作中发挥作用,本研究首先尝试通过酵母系统证明Ss160是否具有转录激活活性。通过同源重组将Ss160基因连入酵母AD 和BD 载体,经测序比对后证明所构建的载体无碱基突变,发现四个转化组合在二缺培养基培养3 d 能够正常长斑,转化成功(图4),之后将二缺培养基上的单克隆用无菌水以10 倍和100倍梯度稀释后用移液枪点到加入了AbA 和X-α-Gal的四缺培养基上,分别做4个重复,经3~4 d培养后,阳性对照在四缺培养基上正常生长,而阴性对照未长斑,证明实验体系正常,而空BD与AD-Ss160以及空AD 与BD-Ss160 在共转蛋白不互作的情况下,依然在四缺培养基上长斑(图4),表明Ss160自身具有转录激活能力。

图4 酵母双杂交实验证明Ss160的转录激活能力Fig.4 Transcript activation capacity of Ss160 examined by yeast two-hybrid assay
3 结论与讨论
核盘菌的菌核在外界条件适应的情况下会萌发出子囊盘,继而喷射出子囊孢子,空气中的子囊孢子落入油菜以及其他作物的花瓣,以花瓣作为其天然培养基进行菌丝萌发和生长;被侵染的花瓣落到茎秆和叶片,使得菌丝进一步入侵植物形成病斑;菌丝在茎秆中生长并在维管组织中形成菌核堵塞植物体内的水分运输,直至植株提前衰亡[21]。由核盘菌引起的菌核病是油菜发展面临的重要病害,如该病害能够全面防控,油菜产业将获得一次质的飞跃。经过多年的研究,科学家利用化学药剂[22,23]以及生物防治[24](如盾壳霉等)等方法提高油菜对菌核病的抗性,取得了一定的效果,但是长远来看,培育抗病品种是最为安全有效的方法[25,26]。可是,由于菌核病的致病机理复杂,油菜菌核病是由多个微效基因复杂调控,因此极大地限制了抗病品种选育的进程[27~29]。
近年来诸多研究从植物本身出发挖掘抗病基因,如多位学者在油菜中发现了多个能够提高油菜菌 核 病 抗 性 的 基 因,如BnMPK3[30]、BnMPK6[31]、WRKY[32]以及一些调控植物细胞壁降解的酶类等,而从病原菌本身挖掘可能参与病原菌-植物互作的因子并进一步解析其在植物中的互作靶标是另一种寻找病原菌致病或植物抗病机理的思路和方法。目前这一方向已经取得了一些进展,比如Deb 发现黄单胞菌效应子XopQ可以通过与两个14-3-3蛋白相互作用而抑制水稻免疫应答[33],Giska 等研究表明丁香假单胞菌所分泌的效应蛋白HopQ1与菜豆14-3-3 蛋白相互作用可以介导菜豆的抗病效应[34]。柴亚茹等[35]通过干扰核盘菌基因SsCCS可以提高拟南芥菌核病抗性,研究过程和方向与本研究有一定相似性,但本研究是通过Ss160过表达来增强油菜抵抗核盘菌的能力;远俊虎等[36]利用病毒介导的基因沉默技术对核盘菌中8个具有信号肽的未知功能基因进行功能探究,成功鉴定到了7 个编码核盘菌分泌蛋白的基因,但也还需要进一步解析具体抗病机理。本研究基于三代组装核盘菌基因组中预测到的候选效应蛋白,从中鉴定到一个可能参与核盘菌-植物互作的基因Ss160,其转录水平在核盘菌接种油菜叶片后不同时间点具有明显变化,因此本研究进一步在核盘菌中克隆了该基因,该基因特征与效应蛋白基本特征(具有信号肽且蛋白小)一致,序列在真菌界非常保守,暗示其功能具有保守性。功能实验表明该基因在烟叶片并没有特异性的定位,在烟草中瞬时表达表明该基因能够明显抑制核盘菌菌丝在叶片上的扩展,提高了烟草对菌核病的抗性。本研究还需要思考的是:Ss160是如何在植物体内激活其病害防御系统,从而提高其菌核病抗性?其在植物中下游的信号是如何传递的?通过酵母系统证实Ss160 具有转录激活活性,暗示其可能通过这种方式启动植物特定基因的表达,但到底是何种植物防御相关基因受Ss160 激活而启动是本研究后期将继续探索的问题。Ss160 是否类似于细菌鞭毛蛋白flagellin 的N 末端高度保守多肽(flg22)[37]一样能够诱导植物的天然免疫?如是,植物又是如何识别Ss160进而激活其体内防御机制?此外,核盘菌作为一种以死体营养型为主要生活方式的病原真菌,其效应蛋白可能与植物特定基因互作启动寄主介导的细胞程序性死亡从而达到其侵染植株的目的[38],那么Ss160 在核盘菌致病性中扮演了怎样的角色?后续将Ss160转入拟南芥获得转基因植株后,以上问题将得到进一步的实验验证。综上所述,本研究克隆了核盘菌基因Ss160并初步探讨了该基因的特性以及在菌核病的具体功能,为后续该基因的功能研究及其在核盘菌-植物互作中的作用机理奠定基础,也为未来油菜抗病基因筛选提供可能的线索。
