BnPHR1转基因油菜低温抗性机制探究
2022-09-03伍小琴王有艺童奕凯张建丰顾斌洁徐帆任峰
伍小琴,王有艺,童奕凯,张建丰,顾斌洁,徐帆,任峰
(华中师范大学生命科学学院,湖北 武汉,430079)
低磷是作物生长发育的限制因素,也是农业生产面临的主要问题之一。无论是自然环境下还是农业生产中,植物经常处于磷素缺乏的状态。为了应对低磷胁迫,植物进化出一系列反应来维持自身的正常生长。这些反应很大程度上通过转录水平进行调控。拟南芥与油菜中包括多数转录因子在内的一批基因都受低磷的调控,表明植物对低磷的适应是基因组中大批基因受协调性诱导或抑制的系统性过程[1~3]。
磷(phosphorus,P)是植物生长所需大量必需元素之一。P 在植物中具有多种功能,包括能量产生、核酸合成(DNA、RNA)、光合作用、糖酵解作用、呼吸作用、细胞膜形成、磷酸化和去磷酸化反应、氧化还原反应、信号转导、碳水化合物代谢及氮固定等[1]。植物所利用的磷主要来源于土壤,其主要吸收形式是无机磷酸盐(phosphate,Pi)[2]。土壤溶液中无机磷酸盐含量大约在1~10µmol/L 之间,但多数以植物不能吸收利用的形式存在[2,3]。因此,磷营养缺乏是作物生长发育的限制因素。
植物在发育及生化上都演化出对低磷环境的适应。MYB家族成员PHR1是拟南芥磷饥饿应答中的关键转录激活因子[4]。拟南芥phr1突变体磷含量降低[4,5]。相反,过量表达PHR1导致拟南芥地上部分磷含量的升高以及磷饥饿应答基因表达上调[5]。在油菜、水稻和菜豆中也发现了PHR1的同源基因[6~8]。PHR1 通过与目标基因启动子中的顺式元件P1BS(GNATATNC)的结合来调控下游靶基因[4]。在油菜中,BnPHR1 能够通过正调控高亲和磷转运蛋白基因BnPht1;4来促进油菜磷的吸收,过量表达BnPHR1能够影响油菜低磷胁迫适应及生长发育[8]。
而低温是影响植物生长发育的另一种非生物胁迫因素。0℃以上的低温胁迫会减少植物的光合作用,降低细胞膜的流动性及基础代谢等过程,抑制植物的生长发育。0℃以下的低温胁迫会使植物细胞内和细胞间结冰,造成直接的机械损伤,严重时导致植物死亡[9]。低温胁迫造成了一系列生理和代谢物的变化,比如活性氧酶系(reactive oxygen species, ROS),丙二醛(malondialdehyde, MDA),蔗糖(sucrose),脂质过氧化物(lipid peroxides),脯氨酸(proline),及其他代谢物的改变。目前,在拟南芥中ICE1-CBF-COR 低温胁迫调控通路已比较清晰。低温胁迫时,COR(cold-regulated)基因家族基因大量表达,这些基因包括编码抗冻蛋白基因及低分子量抗冻保护剂生物合成基因[10,11]。在拟南芥ICE1-CBF-COR 低温调控通路中最为关键的组分是CBF(C-repeat binding factor)。拟南芥中与低温胁迫相关 的CBF基 因,分 别 为CBF1、CBF2和CBF3[12]。CBF属于AP2/ERF 转录因子家族,通过识别并结合下游基因启动子中的CRT/DRE 顺式作用元件(A/GCCGAC)并激活其转录活性来增加抗寒性。CBF基因过表达可以显著提高拟南芥抗冻能力[13]。
已有研究表明茉莉酸(jasmonic acid,JA)信号参与植物低磷胁迫应答。在拟南芥中低磷胁迫能诱导JA 合成并能增强其对草食昆虫防御能力[14]。而低温胁迫中ICE1活性与JA 信号直接有关。JA 信号通路中的抑制因子JAZ(JAZMONATE ZIM-DOMAIN)蛋白能够与ICE1 互作并抑制ICE1 活性[15]。拟南芥中SIZ1基因编码一种类泛素化修饰(sumoylation,SUMO)E3 连接酶。PHR1 作为SUMO 类泛素化修饰靶标而被SIZ1 修饰。SIZ1 功能缺失突变可导致拟南芥持续性磷饥饿反应,如磷饥饿应答基因表达上调[16]。在低温胁迫中CBF蛋白水平也存在SUMO 类泛素化修饰调控,ICE1 蛋白也作为SUMO 类泛素化靶标而被SIZ1 修饰[17]。油菜中低温应答基因BnCOR25不仅参与油菜低温胁迫应答,同时BnCOR25在油菜低磷胁迫中也受到明显诱导[18,19]。此外,植物低磷及低温胁迫中还存在生理生化适应的相关性,如植物低磷胁迫典型表型特征之一为地上部分花青素积累[20],而植物低温胁迫也会导致植物地上部分花青素积累[21]。基因调控及生理生化适应的相关性表明植物低磷和低温应答调控网络存在密切的关联。
本文发现油菜BnPHR1参与了油菜低温胁迫应答,其过量表达转基因油菜株系低温抗性提高,一些低温相关基因也可能受到BnPHR1 直接或间接调控。
1 材料与方法
1.1 材料
实验所用油菜为甘蓝型油菜(Brassica napusL,Westar)。BnPHR1过表达(35S:BnPHR1)转基因油菜株系由本实验室提供。将WT(野生型)和35S:Bn-PHR1转基因油菜种子表面消毒后,平铺于1/2 MS培养基,23℃培养箱中萌发。萌发的油菜幼苗移入土钵后于温室(16 h 光照/8 h 黑暗,湿度65%)培养生长。生长发育3 周大小的油菜移入低温(-4℃)光照培养箱处理24 h,再移入23°C恢复生长。
1.2 方法
1.2.1 总RNA 提取、cDNA 合成及qRT-PCR 取油菜叶片,液氮研磨后加1 mL RNAiso Plus(TaKa-Ra)试剂,静置5 min,4℃,12 000 r/min 离心10 min;取上清,加入200 µL 氯仿,剧烈振荡30 s,4℃,12 000 r/min 离心15 min;取上清,加入600 µL 异丙醇混匀,静置5 min,4℃,12 000 r/min离心10 min;去上清,晾干后加1 mL 70 %乙醇,4℃,12 000 r/min,离心5 min;去上清,晾干后加30 µL DEPC 水溶解RNA。总RNA 经DNase 酶消化去除DNA。依据SMART MMLV 反转录酶(TaKaRa)说明书合成第一链cDNA。根据基因特异性引物,参考Takara 公司的SYBR System 操作手册进行实时荧光定量PCR(qRT-PCR)扩增。以BnACTIN2基因为内参。根据得到的Ct值,计算目标基因在不同处理下的相对表达量。
1.2.2 MDA 含量测定 称取0.25 g 油菜叶片,液氮处理后用预冷的研钵磨,然后加入4 mL预冷磷酸缓冲液(150 mmol/L,pH 7.0)匀浆,然后转入10 mL离心管中在4℃,12 000 r/min 离心20 min,转移上清液至新的试管中用于MDA测定。
1.2.3 电导率测定 取叶片0.2 g,剪成1 cm 大小置于25 mL ddH2O 浸泡,摇床上150 r/min 振荡24 h,使用雷磁DDSJ-318 电导率仪测得起始电导率值Ci,然后于灭菌锅121℃下灭菌20 min,取出冷却至室温时测得最大电导率。
1.2.4 转录组数据分析 WT、35S:BnPHR1转基因油菜幼苗高磷(1 mmol/L KH2PO4)和低磷(1 µmol/L KH2PO4)营养处理7 d,分别取地上部分(叶片)和根组织进行转录组分析,每个样品设置两个生物学重复,共计16个测序样品。RNA提取及测序工作由百迈客公司完成,利用Illumina 测序技术进行测序,原始测序数据NCBI 注册号为PRJNA739537。通过对转录组数据质控处理,分析所选差异基因|Fold Change|≥1.5。利用软件TBTOOLS 和Blast进行同源分析,查找出与低温胁迫相关差异基因。取差异基因起始密码子(ATG)上游2 kb 序列并通过plant pan网站(http://plantpan. itps. ncku. edu. tw/promoter.php)进行启动子元件分析。利用软件TBTOOLS 对启动子进行可视化作图。
2 结果与分析
2.1 BnPHR1过量表达转基因油菜表达鉴定
实验室前期工作获得了多个35S:BnPHR1转基因油菜株系。选取6 个T3代株系(L1、L10、L12、L31、L32、L33)进行BnPHR1基因表达量分析。提取35S:BnPHR1转基因油菜株系总RNA,逆转录成cDNA,利用特异性引物,通过qRT-PCR 分析BnPHR1表达量。结果显示,6 个35S:BnPHR1转基因油菜株系中BnPHR1表达量相比野生型(WT)均有不同程度的提高,其中L12,L32 两个株系BnPHR1表达量相对较高(图1)。选择L12 和L32 两个株系用于后续低温处理分析。
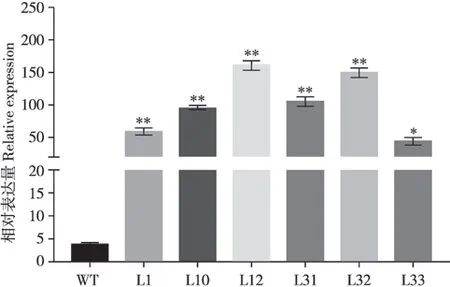
图1 转基因油菜BnPHR1表达分析Fig.1 Expression of BnPHR1 in transgenic Brassica napus
2.2 BnPHR1过量表达转基因油菜低温表型分析
WT 和35S:BnPHR1转基因油菜(L12,L32)低温处理24 h 后,发现两个转基因油菜株系相比WT 油菜叶片萎焉程度明显减轻,表明BnPHR1基因过表达增加了转基因油菜低温抗性(图2A)。植物在逆境中细胞膜受损,膜内电解质外渗,细胞浸提液电导率增大。逆境下也会发生质膜过氧化作用,丙二醛是质膜过氧化作用的最终产物,它的含量可以反映植物遭受逆境的程度。低温胁迫条件下35S:Bn-PHR1转基因油菜L12 和L32 两株系叶片电导率相比WT 明显减弱(图2B),叶片丙二醛含量相比WT也显著降低(图2C)。结果显示,低温胁迫条件下L12 和L32 转基因株系相比WT 细胞膜损伤程度降低。

图2 BnPHR1转基因油菜表型分析Fig.2 Phenotypic analysis of BnPHR1 transgenic B.napus
2.3 35S:BnPHR1 转基因油菜地上部分低温应答基因表达分析
为了探究转基因油菜中BnPHR1过量表达对低温应答基因影响,将高磷和低磷处理后的野生型(WT)与35S:BnPHR1转基因油菜(L12)地上部分(叶)和根组织取样进行转录组测序,测序结果显示每个样品Clean Data 都达到了6.76 Gb,Q30 碱基的百分比在89.47%及以上。将各样品Clean Reads 与甘蓝型油菜基因组序列进行比对,比对出来测序效率在68.52%到77.06%之间(表1)。

表1 RNA-Seq clean reads与甘蓝型油菜基因组比对效率Table 1 RNA-seq clean reads comparison efficiency with B.napus genome
从差异表达基因中筛选低温胁迫相关基因。通过查阅文献及拟南芥冷胁迫相关基因同源比对从地上部分差异表达基因中筛选出44 个冷胁迫相关基因,其中包含低温信号调控通路因子基因如BnCOR15B,BnCOR78,BnCBF2等(表2)。根据转录组数据FPKM 值绘制聚类热图(图3)。各组别具体FPKM 值及组别差异倍数见附件1(首页OSID 码)。BnPHR1 作为转录因子可结合靶基因启动子P1BS元件并正调控其表达。对地上部分与冷相关基因进行启动子元件分析,发现28个基因启动子中含有P1BS 元件,对这些基因启动子进行了可视化分析(图4)。

图4 油菜地上部分BnPHR1调控冷胁迫相关基因启动子可视化分析Fig.4 Visual analysis of promoters of cold-stress-related genes in shoot of B.napus

表2 油菜地上部分受BnPHR1影响的冷胁迫相关基因Table 2 Cold-stress-related genes affected by BnPHR1 in shoot of B.napus

图3 油菜地上部分BnPHR1影响冷胁迫相关基因聚类热图Fig.3 Heat map of the cold-stress-related genes affected by BnPHR1 in shoot of B.napus
挑选了部分差异基因进行表达验证。qRTPCR 结果显示在低磷条件下,转基因油菜地上部分BnCBF2、BnCOR15B及BnCOR78表 达 显 著 上 调,BnAZF1、BnESK1及BnSAUR14表达显著下调,该结果与转录组数据一致(图5)。
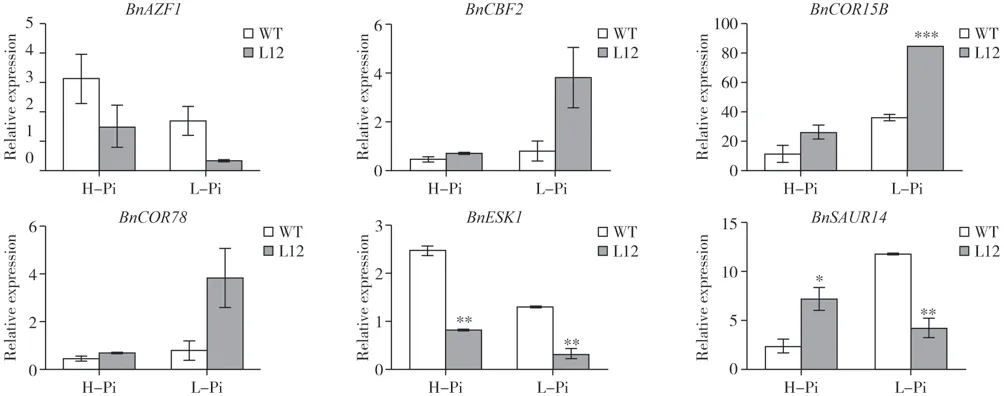
图5 油菜地上部分BnPHR1调控冷胁迫相关基因qRT-PCR分析Fig.5 qRT-PCR of BnPHR1 regulated cold-stress-related genes in shoot of B.napus
2.4 35S:BnPHR1 转基因油菜根中低温应答基因表达分析
为了探究转基因油菜根中BnPHR1对低温应答基因的影响,将WT 与35S:BnPHR1转基因油菜(L12)根组织取样进行转录组测序。从差异表达基因中筛选低温胁迫相关基因。通过查阅文献及拟南芥冷胁迫相关基因同源比对分析从地下部分根差异表达基因中筛选出49 个冷胁迫相关基因(表3)。根据转录组数据FPKM 值绘制聚类热图(图6),各组别具体FPKM 值及组别差异倍数见附件2(首页OSID 码)。BnPHR1 作为转录因子可结合靶基因启动子P1BS 元件并正调控其表达。对地下部分与冷相关基因进行启动子元件分析,发现26个基因启动子中含有P1BS元件,对这些基因启动子进行了可视化分析(图7)。

图6 油菜根中BnPHR1影响冷胁迫相关基因聚类热图Fig.6 Heat map of cold-stress-related genes affected by BnPHR1 in root of B.napus
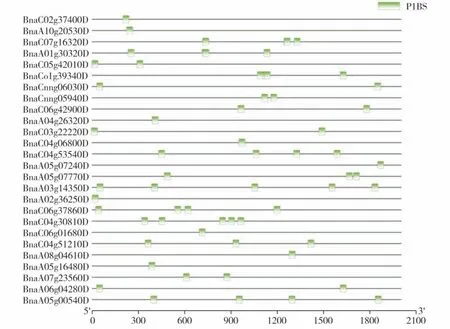
图7 油菜根中BnPHR1调控冷胁迫相关基因启动子可视化分析Fig.7 Visual analysis of promoters of cold-stress-related genes in root of B.napus

表3 油菜根中受BnPHR1影响的冷胁迫相关基因Table 3 Cold-stress-related genes affected by BnPHR1 in root of B.napus
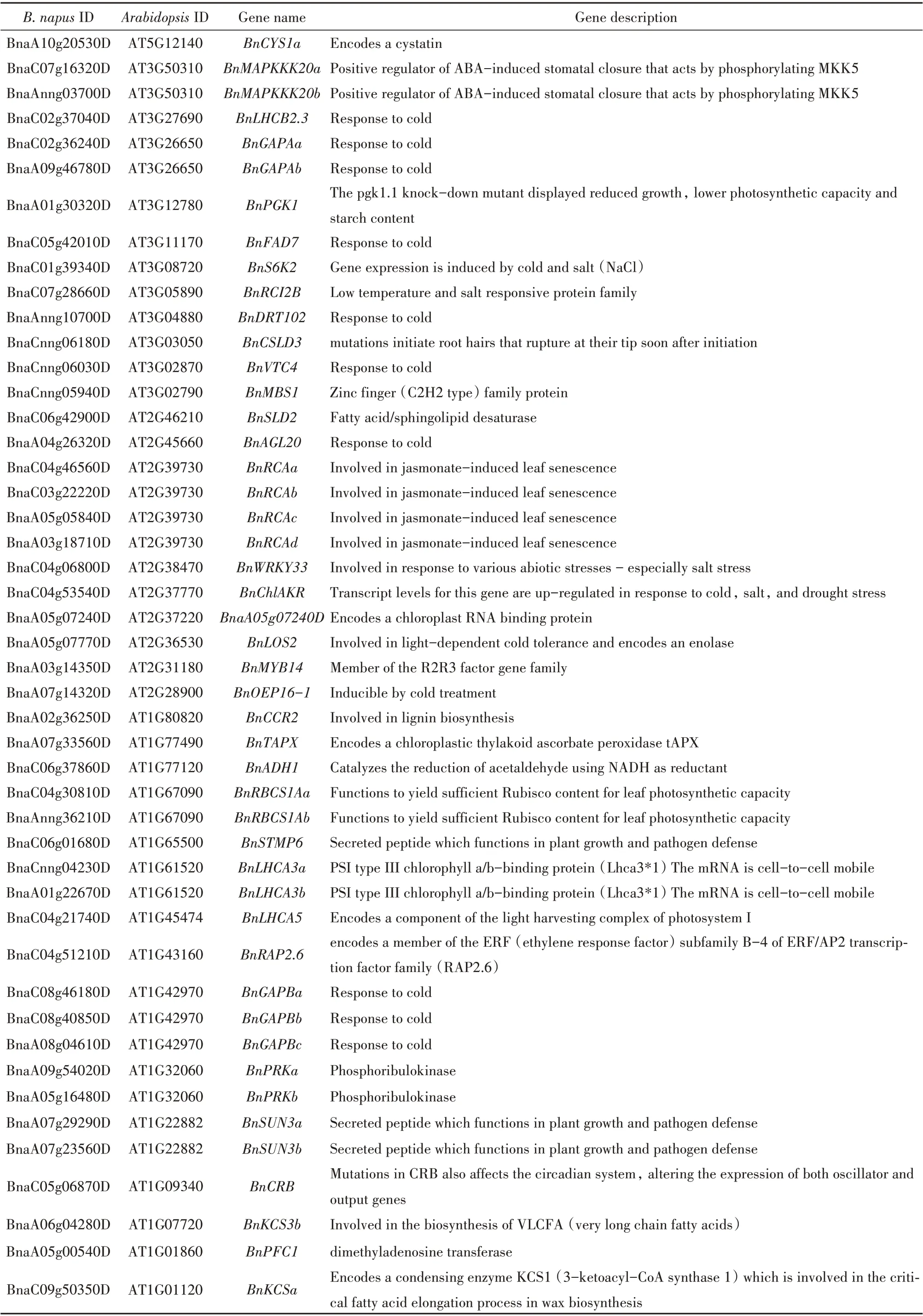
续表
3 讨论与结论
油菜低磷胁迫应答与低温胁迫应答调控之间的关联及互作机制目前是油菜研究的空白领域。但从现有的研究数据中可以找到很多低磷胁迫与低温胁迫相关联的线索。拟南芥中,许多在Pi 饥饿胁迫时表达上调的基因,包括Pht1;1、Pht1;4、MIR399、IPS1和RNS1等基因,其启动子区域都共有P1BS 基序。在低磷胁迫条件下,这些基因作为PHR1直接靶基因而被激活[4,19]。在油菜中,BnPHR1能够通过正调控高亲和磷转运蛋白基因BnPht1;4来促进油菜磷的吸收,过量表达BnPHR1 能够影响油菜低磷胁迫适应及生长发育[8]。
ICE1 蛋白作为SUMO 类泛素化靶标而被SIZ1修饰,SIZ1功能缺失突变体表现低温敏感的表型[22]。油菜低温应答基因BnCOR25不仅参与油菜低温胁迫应答,同时在油菜低磷胁迫中也受到明显诱导[18]。在BnPHR1过量表达转基因油菜低温处理表型分析发现BnPHR1 能提高植株抗冷性,35S:BnPHR1转基因油菜具有比对照更高的耐低温特性。转基因油菜转录组数据挖掘发现,BnPHR1 影响冷相关基因表达。在油菜地上部分和根中分别鉴定到44 个和49 个差异基因受到BnPHR1 调控。这些受BnPHR1调控的基因中包含一些经典的低温胁迫调控通路成员,如BnCOR15B,BnCOR78,BnCBF2等。基因启动子元件分析发现转基因油菜中有部分差异启动子中含有P1BS 元件。BnPHR1 可能与这些启动子结合调控这些基因转录,增强植株对冷的抵抗力,提高耐寒性。植物低磷及低温胁迫中还存在生理生化适应的相关性,如植物低磷胁迫典型表型特征之一为地上部分花青素积累(叶片呈现紫红色),而植物低温胁迫也会导致植物地上部分花青素积累。因此推测BnPHR1作为低磷应答核心调控因子可能在油菜低磷胁迫与低温胁迫应答之间起到联结者和协调者的作用。BnPHR1 可能在多种生物、非生物胁迫中扮演重要调控角色。依据BnPHR1在油菜低磷、低温胁迫应答中的双功能角色指导耐低磷、耐低温双功能油菜品种选育具有潜在的应用前景。
