植物甘油脂合成途径第一步酰化反应的研究进展
2022-09-03韩妮莎丁硕郑月萍魏琳燕柯星星刘宏波刘娟郑志富
韩妮莎,丁硕§,郑月萍,魏琳燕,柯星星,刘宏波,刘娟,郑志富*
(1.浙江农林大学林业与生物技术学院,浙江 杭州,311300;2.浙江农林大学现代农学院,浙江 杭州,311300;3.河南省农业科学院经济作物研究所,河南 郑州,450002)
植物细胞中合成的绝大多数脂肪酸被掺入到 甘油骨架中,生成的极性甘油脂(glycerolipids)是生物膜的主要成分,而中性甘油脂三酰甘油(triacylglycerol,TAG)则是油料植物种子或果实中的主要储存物质[1,2]。很多甘油脂及其代谢产物具有信号传递因子的作用,参与众多与植物生长发育、生物胁迫或非生物胁迫相关联的信号传递过程[3]。同时,TAG 代谢在维持植物细胞的能量和脂质平衡过程中发挥着重要作用。已知油料植物种子在发育过程中形成的TAG 可为光合自养前的幼苗生长提供所需的能量和碳源;TAG 的合成和转化亦与花粉的形成和萌发密切相关[4,5]。因此,深入了解甘油脂代谢对油料作物产量与品质性状的改良至关重要。
1 甘油脂合成
甘油脂的从头生物合成途径(de novoglycerolipid biosynthesis)是最基本的代谢过程,在低等与高等真核生物间存在较高的保守性。已知植物细胞中存在三个甘油脂合成部位,分别分布于质体、细胞质和线粒体中。植物已进化出多种机制,使得甘油脂分子在不同亚细胞区间广泛地发生交换[6,7]。在传统的Kennedy途径中(图1),甘油脂从头生物合成的第一、二步酰化反应分别由3-磷酸甘油酰基转移酶(Glycerol-3-phoshate acyltransferase, GPAT)和溶血磷脂酸酰基转移酶(Lysophosphatidic acid acyltransferase,LPAT)催化,形成的磷脂酸(Phosphatidic acid, PA)是极性甘油脂和中性储存类甘油脂TAG生物合成途径中的一个关键前体物质[8],它在磷脂酸磷酸酶(Phosphatidate phosphatase)的作用下,水解脱去磷酸生成1,2-二酰甘油(Diacylglycerol,DAG)。DAG 是TAG 的直接合成前体,它的脂酰化是TAG 生物合成的最后一步反应,该反应至少受两类酶的控制,它们分别是以脂酰辅酶A 和磷脂作为脂酰基供体的二酰甘油酰基转移酶[9~12],即DGAT(Acyl-CoA: diacylglycerol acyltransferase)和PDAT(Phospholipid:diacylglycerol acyltransferase)。
随着现代分子生物学的发展,人们不断地发现更多的参与植物甘油脂代谢的遗传因子和新的合成途径。例如,有证据显示,植物中存在一酰甘油(Monoacylglycerol,MAG)途径[13],这一途径由依赖于脂酰辅酶A 作为酰基供体的一酰甘油酰基转移酶(Monoacylglycerol acyltransferase,MGAT)所介导,将MAG 转化为DAG,这说明植物细胞中DAG 的合成并不像传统上描述的那样单一。另外还发现,参与Lands 循环(Lands cycle)的溶血磷脂酸胆碱酰基转移 酶(Lysophosphatidylcholine acyltransferase,LPCAT)能影响种子中甘油脂的脂肪酸组分,这表明Lands 循环和Kennedy 途径在甘油脂的合成中存在着复杂的互作关系[14,15](图1)。这些新发现的遗传因子对植物甘油脂生物合成的贡献,在过去并没有被清晰地认知。在目前已知的参与植物脂肪酸组装(Fatty acid assembly)的一系列酶类当中,只有极少数的酶被公认为具有直接参与TAG 合成的功能,其中之一为催化TAG 合成途径中最后一步酰化反应的DGAT。
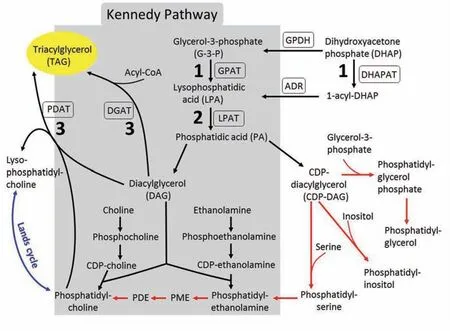
图1 真核生物中甘油脂的生物合成Fig.1 Glycerolipid biosynthesis in eukaryotes
2 GPAT基因的克隆与功能研究
GPAT 催化甘油脂生物合成途径中的第一步酰化反应,该反应被认为是关键的限速步骤,它居于脂肪酸和甘油脂合成代谢的中心位置,起到衔接二者的作用。位于质体中的GPAT 是可溶性的,由ATS1基因编码,在甘油脂原核合成途径中发挥重要作用。质体外的GPAT 则是膜结合蛋白,负责甘油脂真核合成途径中的第一步酰化反应。有关质体中GPAT基因的克隆与功能已有较多研究[16~19],但植物中膜结合GPATs 的研究相对滞后,一个重要原因是膜结合蛋白不易分离纯化,且在体外难以重构获得具有活性的酶分子。长期以来,这类GPAT,特别是位于内质网的GPAT 酶,是很多研究组关注的焦点,因为目前研究认为,内质网被认为是TAG 生物合成的主要位点[20],内质网GPATs 的分离与鉴定对油脂合成的基因工程改良非常重要。但是,直到2001 年,真核生物中第一个编码内质网GPAT 的基因才被克隆。Zheng 和Zou 基于低等和高等真核生物中甘油脂代谢具有相对保守性的设想,从研究面包酵母(Saccharomyces cerevisiae)入手,分离鉴定了两个编码内质网GPAT 酶的基因,分别命名为GAT1和GAT2,这是首例报道真核生物细胞中内质网GPAT基因的克隆工作[21]。在此基础上,其它真核生物中的GPAT基因的克隆研究逐渐取得了实质性进展[20,22~26]
2.1 拟南芥GPATs的生化特性与生理功能
根据酵母Gat1p 和Gat2p 多肽中所含的保守酰基转移酶特征序列(Conserved acyltransferase motifs),Zheng 等从拟南芥中克隆到7 个相关基因,由之组成的GPAT家族被命名为AtGPAT[20]。随着拟南芥基因组序列的完善,Beisson 等发现其中还存在另一个与之相关的成员,称之为AtGPAT8[27]。由这一家族编码的GPATs,大小接近、氨基酸序列相似,且均含有两个跨膜氨基酸序列和四个保守的酰基转移酶特征序列[20]。体外蛋白转运分析(In vitroimport assay)显示,AtGPAT1 具有双重亚细胞定位特性,即位于内质网与线粒体[20]。反向遗传学分析进而发现,AtGPAT1的突变严重延缓绒毡层细胞的程序性死亡,并影响花粉粒细胞内膜的形成,从而导致雄性不育[20]。
后续一些研究显示,除AtGPAT9 之外,AtGPAT家族其它成员优先催化G-3-P 上sn-2 位置的酰化反应,而非sn-1 位置。目前大多认为这一家族的酶是高等植物所特有的,其主要功能是参与聚酯的合成。遗传分析发现,AtGPAT4、6和8基因在角质合成过程中发挥重要作用,gpat4 gpat8双突变体的茎和叶中角质含量明显下降,保卫细胞角质含量的降低影响了气孔的正常结构,造成干旱和病菌耐受性下降[28,29]。AtGPAT6参与花萼和花瓣角质合成,与花药发育、植物育性相关,gpat6突变体的花粉萌发和花粉管伸长受到影响,种子结实率降低[30]。另外,AtGPAT5在拟南芥种皮和根中参与木栓质合成[27]。AtGPAT7与AtGPAT5序 列 相 似 度 高,AtGPAT7参 与植物损伤修复[28]。进一步的生化分析显示,AtGPAT4、6 和8 结构相似,是独特的双功能酶,兼具sn-2 酰基转移酶和磷酸酶活性,可将G-3-P 转化为2-单酰基-甘油(2-Monoacylglycerol,2-MAG)[27,31]。而AtGPAT5与AtGPAT1只有sn-2酰基转移酶活性,而无磷酸酶活性。迄今,AtGPAT2 和AtGPAT3 的生化特性尚不清楚[28]。
与ATS1 一样,AtGPAT9 属于sn-1 GPAT,优先在sn-1 位置上催化G-3-P 的酰化反应。GPAT9 是膜结合蛋白,位于内质网,参与质体外甘油脂的合成;其过表达和下调表达不影响外表皮的角质和蜡质的含量。atgpat9突变体表现出雌雄配子纯合致死现象[32,33]。
在拟南芥体内,不同成员之间可能发生多种相互作用,但目前对这些互作复杂性的了解甚少,将来有必要运用新一代基因编辑技术构建多种不同的GPAT基因多突变体,进一步深入研究GPAT基因在植物体内的真实生物学功能。
2.2 油料作物GPATs基因对油脂合成的影响
除了模式植物拟南芥(Arabidopsis thaliana)[20,30,34,35],目前已在油菜(Brassica napus)[36~41]、花生(Arachis hypogaea)[42~46]和向日葵(Helianthus annuus)[47]等油料植物,水稻(Oryza sativa)[48]和玉米(Zea mays)[49~51]等单子叶植物,以及番茄(Solanum lycopersicum)[52~54]等植物中分离鉴定了多个与拟南芥GPAT基因同源的基因。这些植物中的GPAT基因表现出多种生理功能,在植物的生长发育中发挥着重要的作用。关于GPAT基因在植物育性和抗逆方面的功能,陈文玲等[26]与Liu 等[17]作了综述介绍。本文重点讨论油料作物GPAT基因在甘油脂合成中的功能。
2.2.1 油菜GPAT4、GPAT6和GPAT9基因对种子油脂合成的影响 现有证据表明,BnGPAT4在油菜种子油脂合成过程中扮演着重要角色,其表达量变化对种子含油量产生显著影响。Chen 等运用RNAi技术下调甘蓝型油菜BnGPAT4基因的表达,发现受RNAi干扰的转基因株系与野生型相比,含油量下降了12.4%~24.1%;脂肪酸组分也发生了改变,油酸(C18∶1)下降了4.3%~16.5%,而亚油酸(C18∶2)和α-亚麻酸(C18∶3)则有不同程度的增加[37]。不过,目前并不完全清楚BnGPAT4 酶在植物体内的生化特性,因此BnGPAT4基因调控油菜种子油脂合成的具体机制尚待进一步完善。
目前,与BnGPAT4 高度相似的BnGPAT6 在种子油脂合成过程中的功能并不清晰。耿宇等运用RNAi 技术下调甘蓝型油菜BnGPAT6基因的表达,发现转基因种子与野生型相比,萌发延缓1~2 d,发芽势弱,真叶出现时间晚3~4 d,推测转基因种子萌发迟缓可能与其种子中的三酰甘油含量较低有关[39],但缺乏直接证据证明BnGPAT6基因对种子含油量产生影响。
另外,邢蔓等的研究显示,BnGPAT9基因在拟南芥种子中的特异性表达可在一定程度上促进种子的油脂合成,使得种子含油量提高了1.91%~2.56%,并使脂肪酸组分发生了一些变化[40]。但BnGPAT9是否构成油菜种子油脂合成的关键基因,目前尚缺少有力的生化证据。我们实验室最近运用酵母遗传互补法对BnGPAT9 进行了体内酶学活性鉴定,这将在后续分析中介绍[55]。
上世纪七十年代,原轻工业部成立了全国家用电器工业科技情报站;1980年,北京家用电器研究所(2002年更名为中国家用电器研究院)被确定为全国家用电器工业科技情报站归口单位。同年,我国家电行业第一本行业期刊《家用电器》创刊。1996年,根据中国轻工总会轻总息[1996]11号文件,全国家用电器工业科技情报站更名为全国家用电器工业信息中心,成为中国轻工业信息中心所属33个全国轻工行业信息中心之一,并设置在中国家用电器研究院。
2.2.2 花生GPAT9基因对油脂合成的影响 一些研究表明花生AhGPAT9在种子发育时期的表达量变化与油脂合成或积累关系密切。华方静等分析了10 个花生品种种子的含油量及AhGPAT9在这些品种种子发育过程中的表达特性,发现AhGPAT9的相对表达量与品种含油量存在一定的相关性。Krapt. st. 16 种子含油量高达55.80%,AhGPAT9在油分积累的主要时期的表达量亦较高;相反,在含油量较低(47.32%)的特21 品种中,AhGPAT9在油分积累的主要时期表达量较低。这些结果表明Ah-GPAT9在花生种子油脂积累过程中起着重要的作用[42]。另外,Lv 等对AhGPAT9基因在花生不同组织的表达模式进行了分析,发现AhGPAT9基因在发育种子中表达量高,在42 DAP 时达到峰值,这与花生籽粒的油脂积累速率一致[45]。为了进一步明确AhGPAT9在花生种子油脂积累过程中的功能,Lv 等对AhGPAT9基因在花生中进行过表达和反义表达,发现T3过表达株系种子平均含油量达54.24%,比野生型增加4.75%,但T3反义表达株系的含油量却降至45.80%,比野生型下降3.69%。这些结果表明AhGPAT9基因在花生种子油脂合成过程中起着关键作用[45]。
另有研究调查了花生AhGPAT3和AhGPAT5基因与种子油脂合成的关系。郝翠翠等分析了AhGPAT3和AhGPAT5基因在花生种子不同发育时期的表达特性,发现AhGPAT3和AhGPAT5基因在花生发育初期比较活跃[46]。但是这两个基因是否在花生种子油脂合成过程中发挥某种作用并不清楚。
2.2.3 其他油料作物中GPAT9基因对油脂合成的影响 除油菜和花生外,一些研究还分析了向日葵和大豆等油料作物中GPAT基因与种子油脂合成的关系。Payá-Milans 等分析了向日葵HaGPAT9-1和HaGPAT9-2基因在发育种子和营养组织中的表达量,发现HaGPAT9-1在种子TAG开始积累时强烈表达,种子灌浆过程中HaGPAT9-1的表达模式与油脂积累速率相一致。相反,HaGPAT9-2基因在营养组织中强烈表达。虽然HaGPAT9-2在种子发育早期和中期短暂表达,但与HaGPAT9-1相比,前者表达弱。这些结果表明HaGPAT9-1可能与向日葵种子的油脂积累有关[47]。不过,目前缺乏对HaGPAT9-1生化特性的了解,其在向日葵种子油脂合成中的真实功能并不清楚。
目前有关大豆GPAT基因的研究报道很少。陈锦玲等运用RNA-Seq 分析了大豆(Glycine max)籽粒不同发育时期的基因表达变化,筛选获得8 个与大豆油脂合成相关的候选基因,其中某些GPAT基因在大豆籽粒发育期间(20~50 d)表达量持续上升,与大豆籽粒油脂积累相符[56]。不过,其在大豆油脂合成中的真实功能尚不知晓。
综上,目前有关GPAT基因在油料作物种子油脂合成过程中的功能研究,大多局限于基因表达量与含油量的关联分析,而大部分GPAT 酶在这一过程中的生化特性并不清楚,因此,人们并不明确GPAT基因对油脂合成的影响究竟是直接效应还是间接效应。导致这一现象的一个主要原因是很多实验室缺乏鉴定GPAT 酶的有效方法。因此,我们将在下文介绍目前GPAT 酶分析方法的研究进展,以期为农作物GPAT基因的功能研究提供参考。
3 GPAT 的酶活性测定及其基因的鉴定
3.1 体外酶学测定法
GPAT催化的脂酰化反应,将3-磷酸甘油(Glycerol-3-Phosphate,G-3-P)转 化 为 溶 血 磷 脂 酸(LPA)。因待测的蛋白提取液中常同时含有GPAT和LPAT,生成的LPA 可进一步转化为PA。因此,GPAT 的体外酶学测定法通常是测定源于G-3-P 的LPA 与PA 两者的总形成量,并以此计算GPAT 酶的活性。目前常用的GPAT 体外活性测定法包括同位素标记测定法和荧光偶联酶学测定法。
3.1.1 同位素标记测定法 目前,在GPAT 酶的体外活性测定中,常以放射性14C 或32P 同位素标记的G-3-P 为底物[21,57,58]。反应液中生成的同位素标记的LPA 和PA 产物经薄层层析法(TLC)[21]或高效液相色谱法(HPLC)[59,60]分离后,可用液体闪烁计数仪测定其总形成量(图2)。例如,Zheng 和Zou 利用14C同位素标记的底物测定了酵母Gat1p 和Gat2p 的酶活性。在含Tris-HCl、DTT 与MgCl2的缓冲液中加入棕榈酰基-CoA 和14C 标记的G-3-P,混合均匀后加入含GPAT 酶的酵母提取液;室温反应一定时间后,加入1%HClO4终止反应;再用氯仿-甲醇萃取,汲取下层含反应产物的有机相,并用1%HClO4洗涤有机相,最后将含14C 标记产物的有机相在氮气下吹干。一部分产物可直接用于放射性闪烁计数,另一部分用于TLC 分析,在特定展开剂系统,LPA 和PA 的Rf值相差很大,同位素扫描仪可直接对TLC 板上的分离物质进行扫描[21]。另外,Zheng等为了鉴定拟南芥GPAT基因的功能,在酵母gat1突变体中表达AtGPAT基因,利用同样方法测定了酵母蛋白提取液中的GPAT 活性,发现5 个AtGPAT基因具有GPAT 酶活性[20]。

图2 利用放射性同位素标记3-磷酸甘油底物测定GPAT酶活性Fig.2 Determination of GPAT enzyme activity with glycerol-3-phosphate substrate labeled with radioisotope
同位素标记分析法直接对标记产物进行测定,具有灵敏度高的特点。这种方法可有效地测定GPAT 酶对3-磷酸甘油底物的专一性及对脂酰基供体的偏好性[21]。但由于同位素的使用限制,该方法对大多数实验室而言并不适用(表1)。另外,植物中的膜结合GPAT 酶,其活性受膜脂组分的影响,因而体外酶学分析结果受反应条件的影响较大,这在一定程度上限制了数据的可比性。

表1 GPAT的酶活性测定及其基因的遗传互补法鉴定Table 1 Measurement of GPAT enzyme activities and identification of the genes by genetic complementation
3.1.2 荧光偶联酶学测定法 Morita 等人建立了一种荧光偶联酶学测定法(表1),用于分析细胞中产生的PA。该方法将脂质提取物溶解于含有Triton X-100(非离子表面活性剂)的反应液中,在特定细菌脂肪酶(对PA 底物高度专一)的作用下,将PA分子中的脂肪酸基团解离出来,使PA 转化为G-3-P。随后,在G-3-P 氧化酶的作用下,G-3-P 被氧化,产生过氧化氢。过氧化氢与Amplex Red 反应生成高荧光产物试卤灵(Resorufin),其荧光强度可用荧光酶标仪测定[61]。
Hassaninasab 等人在测定酵母细胞PA 含量过程中,对上述方法进行了改进[62]。他们发现,在Morita 等人开发的荧光偶联酶学测定法中[61],因使用了活性氧含量较高的Triton X-100 以及受脂肪酶未完全热灭活的影响,反应液中的背景荧光值很高,导致信噪比严重下降。相反,当使用高纯度的Triton X-100,并结合脂肪酶的充分热灭活,其信噪比大幅提高[62]。
荧光偶联酶学测定法具有较高的分析灵敏度,但该方法将产物PA重新水解生成底物G-3-P,步骤较为繁琐,操作不简便。在反应液中,除了产物LPA与PA 外,常含其他磷脂,因此分析的可靠性取决于不同来源的细菌脂肪酶的底物专一性。该酶的价格普遍很高,因此制约了荧光偶联酶学测定法的广泛使用(表1)。
3.2 遗传互补法
除了位于质体的GPAT酶,其它已知GPAT酶属于膜结合蛋白,不易分离纯化,且其体外重构十分困难[21],这在一定程度上限制了GPAT 酶的体外分析。遗传互补法,作为一种体内酶学分析方法,具有简便易行的优点,可以通过观察目的基因的导入对生物体特定生理缺陷的恢复状况,直观地评估酶的功能。下面综述细菌遗传互补法和酵母遗传互补法用于GPAT基因鉴定的研究进展。
3.2.1 细菌的遗传互补 大肠杆菌中,GPAT 酶是由PlsB基因编码的膜嵌合蛋白[63~65],该基因已被克隆[64]。在BB26-36 菌株中PlsB基因发生了突变,导致该酶对G-3-P 底物的亲和力下降。在不添加甘油或G-3-P 的培养基中,它不能正常生长,因此它属于甘油或G-3-P 营养缺陷型突变体[58,66]。利用这一生长特性,人们已建立了一种基于BB26-36 菌株的细菌遗传互补法,可用于鉴定GPAT基因(表1)。
BB26-36 菌株属于革兰氏阴性菌,在这类细菌细胞中,acyl-ACP 是酰化反应中的主要脂酰基供体,由细菌Ⅱ型脂肪酸合成酶FASII(Type II fatty acid synthase)产生。当在培养基中添加甘油时,甘油可以被细菌快速吸收,并在甘油激酶作用下快速地转变为G-3-P,成为酰化反应中的脂酰基受体。PlsB 和PlsC 以acyl-ACP 为 脂 酰 基 供 体,分 别 催 化G-3-P 的第一步与第二步酰化反应,生成LPA 与PA[67](图3)。不过,一些细菌酰基转移酶也可以利用脂酰基-CoA 作为底物,它由酰基-CoA 合成酶(FadD)产生[68]。
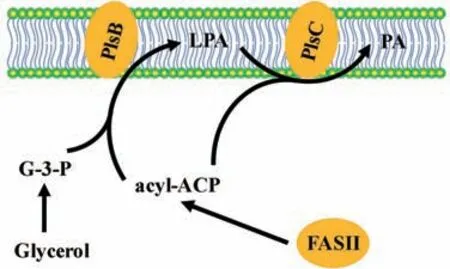
图3 大肠杆菌plsB 突变体(BB26-36)的甘油营养缺陷型特性Fig.3 Glycerol auxotrophy of the plsB strain of Escherichia coli(BB26-36)
利用上述细菌遗传互补法,Lewin 等分析了酰基转移酶的保守氨基酸残基对GPAT 酶活性的影响[57]。根据不同酰基转移酶的氨基酸序列的相似性[69~72],Lewin 等对酰基转移酶四个保守区域的氨基酸序列进行了定点诱变,并将发生氨基酸替换的PlsB 编码基因导入到BB26-36 菌株中;通过检测不同突变基因恢复BB26-36 在甘油营养缺乏条件下的生长能力,评估高度保守区域的氨基酸残基对GPAT 活性的调控作用[57]。研究发现,保守区I 的组氨酸和天冬氨酸、保守区III 的甘氨酸和保守区IV的脯氨酸在GPAT 催化中发挥重要作用,而保守区II 的苯丙氨酸和精氨酸以及保守区III 的谷氨酸和丝氨酸似乎对甘油3-磷酸底物的结合很重要[57]。
上述细菌遗传互补法被证明可有效用于原核生物中GPAT基因的功能分析[57,58,73]。然而,另有一些研究表明,该法存在某些局限性,真核生物中的一些GPAT基因的异源表达无法弥补BB26-36 的生长缺陷(表1)。一个可能原因是,真核生物中的膜结合GPAT 酶优先使用脂酰基-CoA 作为脂酰基供体,而在BB26-36 细胞中,酰基-ACP 是主要的脂酰基供体,它可能不是真核生物中的膜结合GPAT 酶的适用底物[16,67,73,74]。
3.2.2 酵母的遗传互补 作为细胞中最基本的代谢过程,甘油脂合成在低等与高等真核生物之间存在较高的保守性,因此基于酵母突变体的遗传互补技术已被广泛用来鉴定高等真核生物中参与甘油脂代谢的基因[8,67,75]。建立一个实用的酵母遗传互补体系的主要挑战是构建一种具有特定生长缺陷的突变株,这种生长缺陷只有在特定的目标基因导入的情况下才得以消除。Zheng 和Zou 发现,Gat1p和Gat2p是酿酒酵母中两个最主要的GPAT酶,同时敲除两者的编码基因GAT1和GAT2会导致酵母丧失生长能力[21]。这一特性允许人们构建条件致死型gat1Δgat2Δ 酵母双突变体(图4),理论上,只有当导入编码具有GPAT 酶活性的基因时,这种突变体才能恢复其在特定条件下的生长能力。

图4 四分体分析显示GAT1和GAT2基因双敲除能使酵母细胞丧失生长能力[21]Fig.4 Simultaneous knockout of GAT1 and GAT2 genes renders yeast cells unable to grow as revealed by tetrad analysis
Zaremberg 等以W303 酵母菌株为遗传材料,构建了一个名为CMY228的条件致死型gat1Δgat2Δ酵母 双 突 变 体,其 基 因 型 为(W303,gat1Δgat2Δ+[pGAL1::GAT1 URA3]),该菌株携带的质粒含GAL1启动子驱动的GAT1基因(源于酵母自身的基因)以及URA3选择标记,GAL1启动子受半乳糖诱导,葡萄糖抑制[77]。基于CMY228 的酵母遗传互补体系曾被用于鉴定恶性疟原虫中编码内质网GPAT 的基因[78]。同时,我们亦构建了一个以BY4742 为遗传背景的gat1Δgat2Δ 酵 母 双 突 变 体 菌 株,名 为NIU8(BY7472,gat1Δgat2Δ+[pGAL1::GAT1 URA3]),其携带的质粒与CMY228 中的一样[79]。犹如CMY228,NIU8 菌株的生长完全依赖于该质粒的存在,换言之,GAL1启动子驱动的GAT1基因的表达是这两个突变体生长所必需的[79]。然而我们发现,NIU8 不但能在以半乳糖为碳源的培养基中生长,而且在葡萄糖存在的条件下,该菌株仍能生长。我们推测,在受葡萄糖抑制条件下,GAT1基因的泄漏表达可能足以产生足够高的GPAT活性来维持gat1Δgat2Δ双突变体的生长,这可能与GAT1基因编码的GPAT 酶在酵母自身环境中具有很高活性有关[79]。在这种情况下,目标基因的筛选会出现假阳性现象[79](表1)。
多数情况下,酶在其自然细胞环境中具有较高的催化活性,而在异源细胞系统中其活性往往较低。于是,当一个外源编码GPAT 的基因与酵母自身GAT1基因的表达水平相同时,前者常会产生较低的GPAT 活性[20,21]。因此,Lei等假设,解决上述假阳性问题的一种途径是,用一个异源GPAT基因替换质粒中所含的酵母自身GAT1基因。当该质粒导入gat1Δgat2Δ 双突变体时,异源GPAT基因在葡萄糖抑制条件下的泄漏表达不能产生足够高的GPAT活性用以弥补突变体的生长缺陷[79]。我们称这种策略为“产能过剩消除策略”(the Eradication of Excess Capacity strategy)[79]。基于这种假设,Lei 等在NIU8菌株的基础上,构建了一个新的gat1Δgat2Δ 双突变体菌株,名为ZAFU1(BY4742,gat1Δgat2Δ+[pGAL1::AtGPAT1 LEU2]),其中所含的质粒携带一个受半乳糖诱导的启动子(GAL1)控制的拟南芥GPAT1基因及LEU2选择基因[79](图5)。我们反复试验证明,ZAFU1 菌株能在含有半乳糖的培养基中正常生长,而在葡萄糖的培养基中,即使延长生长时间至几个月,菌株仍未出现任何生长迹象,因此有理由相信,基于ZAFU1 的遗传互补体系出现假阳性的频率会非常地低(表1)。

图5 携带拟南芥AtGPAT1的条件致死型gat1Δ gat2Δ双突变体酵母的构建流程Fig.5 A schematic diagram for construction of a conditional lethal gat1Δ gat2Δ double mutant of Saccharomyces cerevisiae carrying Arabidopsis AtGPAT1
在此基础上,Lei 等构建了适用于ZAFU1 遗传互补体系的pYES2-Kan-yADH1 穿梭载体,该质粒携带一个受葡萄糖诱导的酵母ADH1启动子及一个与之相邻的多克隆位点DNA 片段,后者作为候选基因的插入位点[79]。Lei 等研究显示,当含已知GPAT基因的pYES2-Kan-yADH1质粒导入ZAFU1突变体时,该菌株能在葡萄糖培养基中恢复生长;相反,编码其它脂类合成相关酶基因不能恢复ZAFU1 在葡萄糖培养基中的生长能力。这些结果表明该酵母遗传互补体系对GPAT基因的鉴定具有很高的专一性[79]。若目的基因在葡萄糖诱导条件下的表达能够恢复ZAFU1 的生长,则可以推断该目的基因编码的蛋白具有类似酵母G-3-P 酰基转移酶的功能。Lei等利用该遗传互补体系对拟南芥GPAT基因家族8位成员进行了鉴定,结果显示在葡萄糖培养基中At-GPAT1、GPAT5或AtGPAT7的导入能使ZAFU1 菌株不同程度地恢复生长,但AtGPAT2、AtGPAT3、AtGPAT4、AtGPAT6或AtGPAT8的表达未能弥补其生长缺陷[79]。这一结果与GPATs的体外酶学分析结果相一致,AtGPAT1、AtGPAT5 与AtGPAT7 只具有将G-3-P 转化为LPA 的酰基转移酶活性,而AtGPAT4、AtGPAT6 与AtGPAT8 兼具酰基转移酶与磷脂酶的活性,能将G-3-P经LPA中间产物转化为MAG[27,31]。
由于外源GPAT基因在酵母中的表达产物活性较低,于是ZAFU1 的生长速率受到该基因在葡萄糖诱导下的表达水平的影响很大。为了提高ZAFU1菌株的生长速率及与此相关的目的基因筛选效率,陈丹丹等用长片段酵母ADH1启动子替换pYES2-Kan-yADH1 质粒中所含的短片段酵母ADH1启动子,使目的基因在葡萄糖诱导条件下的表达水平得到增强,从而进一步优化了基于ZAFU1 的酵母遗传互补筛选体系[80]。该优化后的筛选体系已被用于油菜和花生等作物的GPAT 编码基因的鉴定[55,81]。段芊芊等鉴定了甘蓝型油菜中的13 个候选GPAT基因,发 现BnGPAT1-1、BnGPAT4-1、BnGPAT4-2和BnGPAT9-1基因的异源表达能恢复ZAFU1 在葡萄糖培养基中的生长,表明这些基因具有类似酵母酰基转移酶编码基因GAT1或GAT2的功能[55]。姜竹等利用该遗传互补体系对栽培花生中的13 个候选GPAT基因进行了鉴定,发现AhGPAT5B和AhGPAT7A/B具有类似酵母酰基转移酶编码基因GAT1或GAT2的功能[81]。这些研究结果有助于深入了解作物甘油脂合成的分子调控机制。
值得指出的是,尽管酵母和植物之间在PA 生物合成途径中存在较高的保守性,但因植物细胞比酵母具有更复杂的遗传互作关系,通过酵母遗传互补鉴定获得的植物GPAT基因,需要进一步在植物体内进行功能验证,以更加全面地了解其在植物体内的真实功能。
4 展望
油料植物不仅是食用油的主要来源,而且是可持续地生产生物能源和化工原料的潜在工厂[82]。如何有效地提高可适用于不同用途的植物油脂的生产,已成为生物技术领域一个迅速增长的研究热点。在过去的几十年里,人们对甘油脂的生物合成有了较为深入的了解,但是这一代谢途径中仍存在某些未知因子。譬如,对脂肪酸组装体系的了解尚不完善,下列问题有待解决:(i)油料植物中TAG 合成的初始反应和第二步甘油酰化反应究竟是由哪些基因编码的酶直接控制的;(ii)极性和中性甘油脂的合成前体是否分别由不同的脂肪酸组装体系控制。这些关键科学问题的存在致使人们仍难以有效地操控甘油脂的生物合成,从而制约油料作物的生产。
目前,通过提高已知GPAT基因在油料植物种子中的表达量以大幅增加种子含油量,并未获得很大成功[39,40],对这种现象至少有两种不同的解释。其一,这些已知GPAT 编码基因可能并不直接参与油脂合成,这种观点得到下面证据的支持,即对含油量不同的物种进行全基因组的表达谱比较分析显示,已知GPAT和LPAT基因的表达水平在这些物种之间没有明显差异[83,84]。我们推测,油料植物中或许存在某些新的酰基转移酶和由之介导的TAG合成途径,这是因为模式植物拟南芥基因组中仍有多个功能并不完全清楚的基因,其编码的蛋白质含有保守的脂肪酰基转移酶特征序列。其二,虽然目前尚无证据表明植物中含有类似于酵母和哺乳动物中存在的磷酸二羟丙酮(DHAP)途径(图1),但是植物中是否存在类似合成途径,尚不清楚。在DHAP 途径中,甘油脂合成的初始反应是由DHAP酰基转移酶(DHAPAT)催化的[21]。因此,将来有必要开展下列研究:(i)调查那些未知的含保守酰基转移酶特征序列的拟南芥蛋白是否具有GPAT 和LPAT 的功能,并调查其在甘油脂合成中的作用;(ii)探究油料植物中是否存在一类不含有已知酰基转移酶特征序列的新型酰基转移酶;(iii)探究植物中是否存在未知的TAG 合成途径。这些研究将有助于我们深入了解甘油脂合成前体的来源,从而为有效提高油料作物种子含油量以及改造油的组分使之适应各种不同的用途提供理论基础。
另外,本文分析了GPAT 酶的体外与体内测定方法,并重点综述了酵母遗传互补法的建立与应用。我们认为,对大多数实验室而言,酵母遗传互补法是一种有效且简便的GPAT 鉴定方法,可快速用于植物GPAT 编码基因的鉴定与结构优化。随着大规模基因组测序的不断发展,越来越多的序列被注释为候选酰基转移酶基因,但迄今已鉴定的大多数膜结合的GPATs 与LPATs 共享四个酰基转移酶的保守结构域[57],运用生物信息学工具难以有效区分这些序列究竟编码哪种类型的酰基转移酶,因而在不同物种中克隆的这些酰基转移酶基因的生化功能不清楚。基于条件致死型gat1Δgat2Δ双突变体的酵母遗传互补法可使GPATs 的酶学功能鉴定与结构优化工作变得简便易行,它可直观地根据酵母细胞生长速度来评估异源表达产物GPAT 的酶活性大小。因而,上述酵母遗传互补法的推广与应用将有助于促进农作物GPAT基因的克隆与功能研究以及油料作物的脂类代谢研究。
