甘蓝型油菜子叶黄化致死突变体ytl的表型分析和基因定位
2022-09-03邬瑜锦徐凯宋居荣赵伦文静易斌马朝芝沈金雄傅廷栋涂金星
邬瑜锦,徐凯,宋居荣,赵伦,文静,易斌,马朝芝,沈金雄,傅廷栋,涂金星
(华中农业大学植物科学技术学院/作物遗传改良国家重点实验室,湖北 武汉,430070)
我国食用植物油的自给率正持续下降,消费的植物油大约65%依赖进口[1]。油菜是我国主要的油料作物之一,不仅在我国食用油生产中占有主导地位,同时也是我国动物饲料蛋白的重要来源,因此提高产量一直是油菜育种的首要目标[2,3]。油菜的产量构成因素中,单位面积的成苗率反映作物幼苗的活力和均匀性,是影响油菜产量的重要因素之一。成苗率是保证作物生产力的前提,同时也是影响作物种植密度的原因之一,而子叶黄化致死与成苗率有关。叶色突变不利于植物的正常发育,影响植物的正常生长。叶色突变体可以通过人工诱变、自发突变、基因沉默突变和插入突变获得。叶色突变体的分类方法有很多,按照叶色突变颜色不同,可以将叶色突变体分为白化、白黄、白绿、淡黄绿、淡绿、黄化、条纹、常绿、斑叶、紫叶和类病斑类型[4]。
叶片黄化致死可能的原因有很多,涉及的主要通路可以分为四大类:(1)叶绿素生物合成和降解途径。在高等植物中,叶绿素生物合成通路十分复杂,以谷氨酸为前体,由27 个基因编码的15 种关键酶参与,经过19步反应,最终形成叶绿素a和叶绿素b[5]。Willianm 等研究发现,当编码叶绿素合成途径中类原卟啉原氧化酶(HEMF)的基因被破坏时,玉米幼苗即使在光下也会一直表现为黄化,最终死亡[6]。(2)血红素代谢途径。叶绿素的合成途径和血红素合成途径有重叠的部分,细胞内合成四吡咯之后,会根据细胞内血红素和叶绿素的含量分别进行两种合成途径。所以血红素合成途径和叶绿素合成途径会通过四吡咯相互反馈调节,当细胞内血红素含量升高,会通过反馈抑制调节降低叶绿素合成,降低叶绿素含量[7]。血红素加氧酶(HO)是血红素合成途径中的关键酶,在拟南芥中,其编码基因突变会限制血红素合成,进一步导致叶绿素水平降低,叶片黄化[8]。(3)叶绿体发育途径。叶绿体是由质体分化形成,其发育分化在复杂的质核基因协同调控下完成[9]。该过程中的任一基因突变均会导致叶绿体发育异常,进而导致叶色变异。叶绿体发育主要包括光形态建成途径、蛋白质转运及利用、类囊体分化以及叶绿体分裂等过程。例如,在叶绿体发育和分化早期,质体核糖体蛋白起关键作用,水稻中突变体al1和asl2的突变体叶绿体发育分化异常,幼苗白化致死[10,11]。(4)叶绿体蛋白修饰和降解。叶绿体是半自主性细胞器,该细胞器正常运行涉及多种蛋白质的合成、转录、运输和代谢降解。Xu 在甘蓝型油菜中发现一个黄化致死基因,该基因编码PSⅡ系统中的Ftsh1 水解酶,降解PSⅡ系统中光受损的D1 蛋白,该基因的突变导致光系统中D1 蛋白受损后不能及时更换,阻碍光合作用的正常运行[12]。
黄化致死性状可以作为形态标记用于良种的繁育和筛选,同时,这类资源也是基础研究的优良材料。随着CRISPR-Cas9 技术的不断发展,人们对于致死基因有了更好的应用。在水稻中,致死基因Ospds在CRISPR-Cas9技术中首次应用,编辑苗在T0代就可以观察到预期表型,提高编辑检测效率[13]。之后在玉米、拟南芥、小麦、烟草等作物中都开始将致死基因应用于CRISPR-Cas9 技术中[14~17]。由于甘蓝型油菜基因组十分复杂,关于黄化致死基因的研究和利用较少。甘蓝型油菜黄化致死基因的研究不仅丰富了甘蓝型油菜种质资源,而且对于提高基因编辑效率检测以及推进分子育种的创新具有潜在应用前景。
本实验以恢复系轮回选择群体的自交后代中分离的黄化致死突变体ytl为实验材料,对ytl突变体进行叶绿素含量测定以及叶绿体透射电镜观察,分析黄化致死的生物学机制,利用遗传分析和图位克隆,对BnaC09.YTL进行定位,随后对双亲中定位区间内的候选基因进行比较测序和表达量测定分析,为鉴定出目的基因、进一步研究该基因的功能奠定基础。
1 材料与方法
1.1 材料
黄化致死突变体ytl(yellow to lethal)来源于恢复系轮回选择群体的自交后代,将同一株系后代中正常表现单株YTL 作为野生型对照。利用位点杂合单株(命名为自交一代S1)套袋自交获得分离群体,命名为自交二代S2。取群体S2 中777 个黄化致死单株进行突变体的遗传分析和基因定位。所有材料均种植于华中农业大学和甘肃省临夏回族自治州和政县试验基地,田间材料种植与管理按照常规油菜种植方法进行。
1.2 叶绿素含量测定
自交一代S1 的株系种子播种7 d 之后,选取野生型与突变体ytl单株的子叶去除叶脉剪成小碎片,称取0.3 g,野生型和突变体各3 个重复。放入20 mL 的浸提液(丙酮∶乙醇=8∶1)中。室温避光48 h,期间多次摇晃之后吸取上清,使用紫外分光光度计测量在470 nm、646 nm 和663 nm 的吸光度值,按下列公式计算[18,19]:(mL),A:叶片鲜重(g)。

1.3 叶绿体透射电镜分析
群体S1 代的种子播种7 d,切割黄化致死表型单株和野生型单株相同位置的新鲜子叶,并固定在0.1 mol/L 盐酸缓冲溶液(pH=7.2)和2.5%戊二醛的溶液中,叶片抽真空至管底。使用0.2 mol/L 的磷酸缓冲液(pH=7.2)洗涤3 次,随后进行固定2 h。用缓冲溶液洗涤3 次,每次10 min;利用酒精浓度分别为30%、50%、70%、80%、90%进行逐步脱水,每次30 min,最后一次用100%浓度的酒精洗涤两次。样品用酒精与SPI-812 树脂混合液按梯度3∶1、3∶2、3∶3 进行浸透和置换,每次3 h。使用SPI-812包埋至样品材料硬化,用Leica UC6 切片机进行超薄切片制备,使用2.6%(m/V)柠檬酸铅和2%(m/V)乙酸铀酰双染色。制备完成的样品在华中农业大学公共电镜平台日立Hitachi-7650 透射电镜下镜检照相。
1.4 突变体ytl的遗传分析
S2 代的种子在温室培养条件下,温度为22℃,湿度50%~60%,光周期设计为光照时间16 h,黑暗时间8 h。播种7 d 后观察分离比,统计野生型和突变体个体的数目,计算分离比和卡方检验。
1.5 BSA结合油菜60K SNP芯片分析
采用混合分组分析法(BSA),结合Illumina公司的油菜60K SNP 芯片进行差异分析。从S2 群体中选取子叶正常单株和黄化单株各36 株,CTAB 法提取子叶DNA,调整DNA 浓度至100 ng/µL。分别构建3个黄化池和3个正常池。所有DNA 池及亲本都采用甘蓝型油菜60 K Illumina Infinium™SNP 芯片[20]进行分析。芯片杂交及扫描的方法与前人报道相同[21]。扫描后的SNP 数据在ZS11 参考基因组进行BLAST以确定差异富集位点。
1.6 突变体ytl的染色体定位
根据60K SNP 芯片的结果,提取差异富集区间DNA 序列信息,在Webset 网站(http://wsmartins.net/websat),设计和开发SSR(Simple sequence repeats)标记。引物的设计原则如下:扩增的片段长度为150~250 bp,Tm 值设定在50~56℃则,引物长度为20~30 bp;最终选择二或三碱基重复类型,且重复次数为5~6 次的SSR 标记。选取黄绿混合池筛选有差异的SSR 标记,利用777 个黄化致死单株进行基因定位。根据ZS11 基因组注释网站(http://cbi.hzau.edu. cn/bnapus/index. php)设计候选区间内的10 个基因的特异性引物进行PCR 扩增。PCR 程序采用常规方法进行。
1.7 候选区间基因的表达量分析
取播种7d 后的野生型和突变体新鲜子叶约0.3 g 放置于液氮中,随后放置于-80℃保存。使用普洛麦格(北京)生物技术有限公司植物总RNA 提取试剂盒(LS1040)提取植物的总RNA,对提取的RNA 进行1%琼脂糖凝胶电泳检测,取1µg RNA 进行反转录。反转录使用宝日医生物技术有限公司PrimeScript ™RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(RR047A),操作步骤按照说明书进行。根据已公布的基因编码区序列设计qRT-PCR 引物,模板使用稀释50 倍的反转录产物,使用SYBR Green Realtime Mix(TOYOBO, Japan)进行荧光定量反应,qRT-PCR 在Bio-rad CFX96 TouchTM 荧光定量PCR 仪中进行。BnaActin7 作为内参对数据进行标准化,基因表达量的结果用2-ΔΔCT的方法计算[22]。
2 结果与分析
2.1 黄化致死突变体ytl的表型分析
黄化致死突变体ytl来源于恢复系轮回选择群体的自交后代。突变体子叶表现为黄色,后期不转绿,不能长出真叶,播种9~15 d后枯萎死亡(图1A)。播种7 d 时,测定野生型YTL 和突变体ytl的光合色素含量。结果表明,在子叶时期,突变体ytl的叶绿素a、b 以及叶黄素和类胡萝卜素含量均极显著低于野生型YTL,与野生型相比,突变体ytl的总叶绿素/类胡萝卜素的比值显著降低,野生型和突变体在叶绿素a/b 的比值中并没有显著性差异(表1)。因此黄化致死突变体的叶绿素含量显著低于野生型。
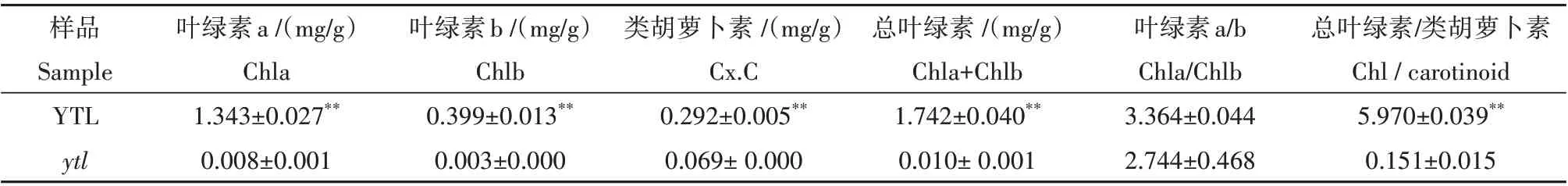
表1 野生型YTL与突变体ytl光合色素含量Table 1 Contents of photosynthetic pigments in wild-type YTL and mutant ytl
选取播种7 d的ytl和YTL 植株进行叶绿体透射电镜观察,野生型叶肉细胞结构完整,细胞内脂肪粒较多,叶绿体发育正常、类囊体高度分化结构正常、基粒片层垛叠数丰富。与之相比,突变体细胞发育迟缓、细胞内淀粉粒含量较少、质体发育不良,其内部没有垛叠的类囊体,结构模糊、基粒片层稀疏(图1B)。
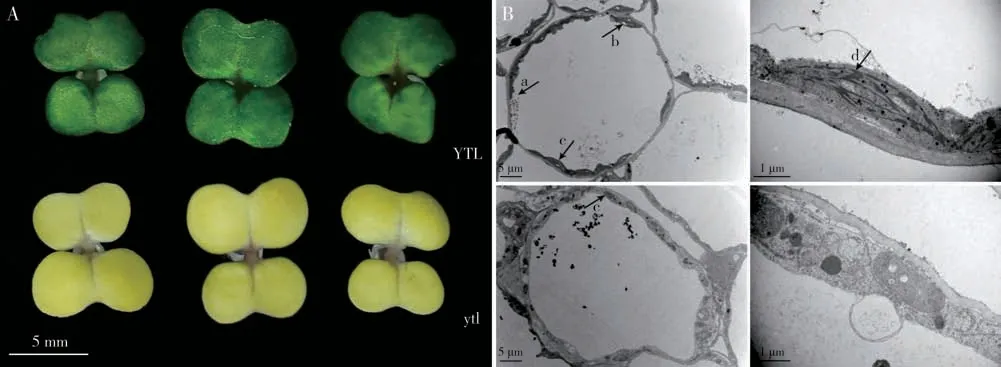
图1 野生型YTL和突变体ytl的表型特征Fig.1 Phenotypic characteristics of wild-type YTL and mutant ytl
2.2 黄化致死突变体ytl的遗传分析。
为了进行遗传分析和图位克隆,我们对自交二代S2播种后观察统计分离比。卡方测验结果表明,正常单株与黄化致死单株数之比为275∶104(χ2=1.20<3.84),符合3∶1 的分离。初步判断该性状由一对隐性核基因控制。
2.3 黄化致死突变体ytl的基因定位
为了对黄化致死基因进行精细定位,从自交分离群体中各选取12 株黄化致死单株和正常表型单株构建DNA 混池,对其进行60K SNP 芯片分析。结果显示SNP 差异富集区间为C02 染色体5Mbp~10Mbp 以及C09 染色体20Mbp~25Mbp 和40Mbp~45Mbp(附图1,详见首页OSID 码),在这三个区间内设计SSR 标记,寻找与性状连锁的标记。结果显示只有C09 染色体20Mbp~25Mbp 区间的标记在两亲本之间存在稳定的多态性。利用自交分离群体中的119 个黄化致死单株进行初定位,区间初定位在标记SSR-140 和SSR-158 之间,对应ZS11 物理位置1.7 Mbp。根据ZS11 基因注释网站信息,在标记SSR-140 和SSR-158 之间又加密SSR 标记以及参照ZS11 的参考基因组设计InDel 标记(附表1,详见首页OSID 码),进一步精细定位,对658 个黄化致死单株使用差异标记进行扫描。最终将该基因定位到标记SSR-140 和PBZIN-1 之间,对应甘蓝型油菜ZS11 上198 kb 的物理区间,其中包括10 个注释的ORF(开放阅读框)(图2 和表2),基因命名为BnaC09.YTL。对突变单株进行测序,与ZS11 的序列进行对比,结果显示,BnaC09G0294400ZS、BnaC09G0294600ZS、BnaC09G0294700ZS、BnaC09G0294800ZS、BnaC09G0294900ZS、BnaC09G0295000ZS、BnaC09G0295200ZS这7 个 基因编码区均没有差异,BnaC09G0294300ZS的内含子区有三处变异。BnaC09G0294500ZS、BnaC09G0295 100ZS在突变体ytl中扩增失败。
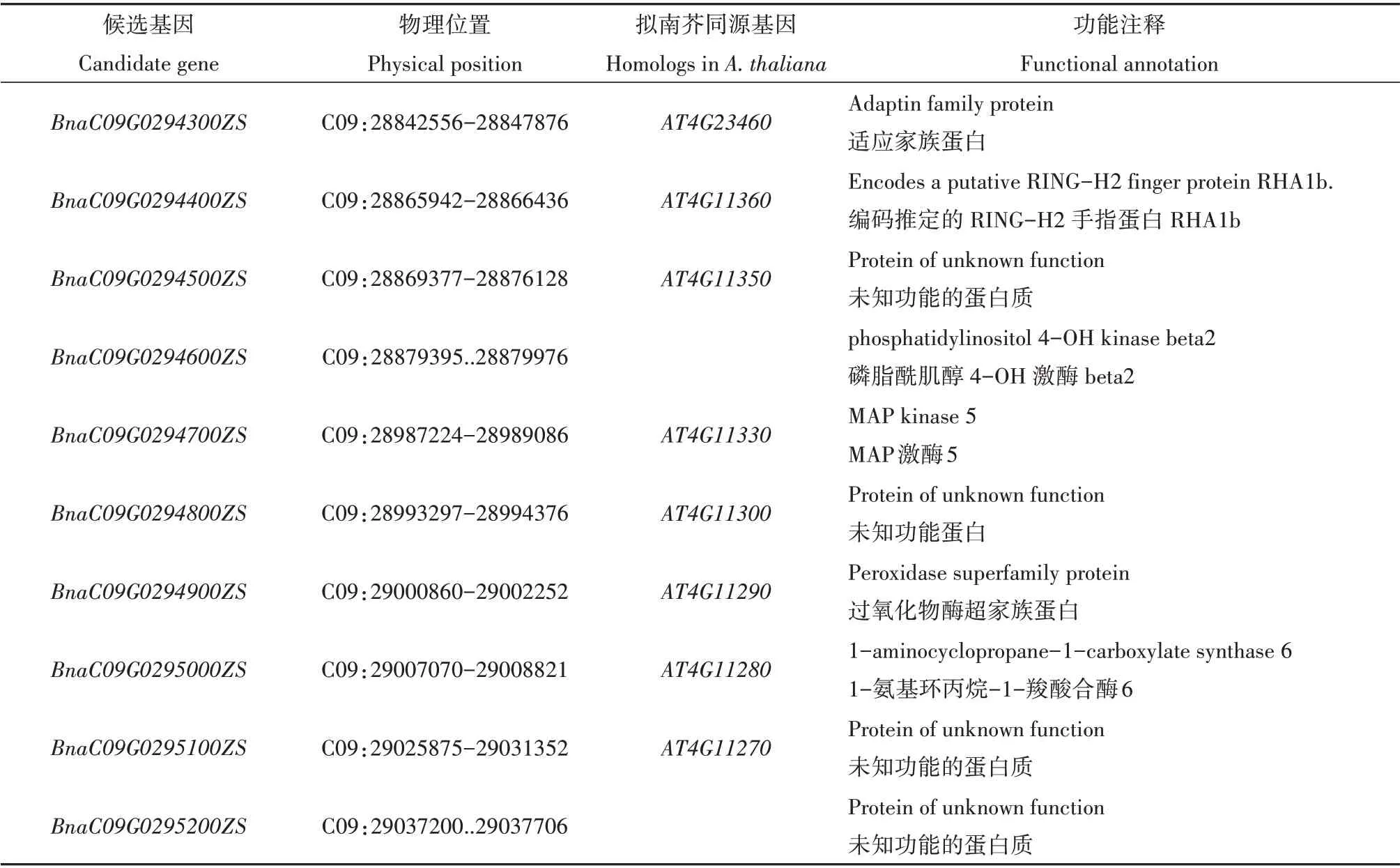
表2 定位区间内的基因及功能注释Table 2 Gene names and their functional annotations in the target interval
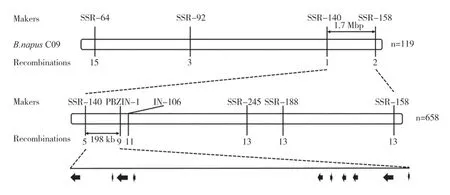
图2 黄化致死基因在C09染色体上的基因定位Fig.2 Gene mapping of yellow to lethal gene on C09 chromosome
2.4 候选基因的表达量分析
参考ZS11 的转录组数据网站(http://yanglab.hzau. edu. cn/BnTIR/eFP)发现BnaC09G0294600ZS和BnaC09G0295200ZS在子叶时期不表达,因此排除这两个基因作为候选基因的可能性。首先对区间内候选基因的时空表达进行分析,进一步设计特异性引物(附表2)对区间内的候选基因进行表达量检测,结果表明,子叶时期,在突变体ytl中候选基因均下调表达。在野生型和突变单株之间表达量有显著性差异的基因为BnaC09G0294300ZS、BnaC09G0294400ZS、BnaC09G0294500ZS、BnaC09G0294700ZS和BnaC09G0294900ZS(图3)。对比参考拟南芥中同源基因的注释信息发现,BnaC09G0294300ZS属于适应家族蛋白,该家族蛋白参与囊泡运输,可能参与到质核转运系统,进而影响叶绿体生长发育途径[23]。BnaC09G0294400ZS参与蛋白质泛素化调控,而蛋白质泛素化调控途径参与植物光形态建成[24]。BnaC09G0294500ZS没有相关的注释信息。BnaC09G0294700ZS在拟南芥中的同源基因是MAP 激酶,在拟南芥中与同家族的其他激酶调控植物根系生长速率[25]。BnaC09G029490 0ZS是过氧化物家族蛋白,在拟南芥中,参与植物受到寒冷胁迫时ROS 的清除反应[26]。BnaC09G029500 0ZS主要参与到乙烯的生物合成过程。BnaC09G02 94800ZS、BnaC09G0295100ZS没有相关注释信息的基因,但是由于这两个基因的表达量在子叶时期差异较小,作为候选基因的可能性比较小。

图3 候选基因表达量分析Fig.3 Candidate gene expression analysis
结合比较测序的结果,排除BnaC09G0294600 ZS、BnaC09G0294700ZS、BnaC09G0294800ZS、BnaC09G0294900ZS、BnaC09G0295000ZS、BnaC09G0295100ZS、BnaC09G0295200ZS作为候选基因的可能性。BnaC09G0294300ZS的表达量存在差异,该基因的内含子区域也存在碱基变异。BnaC09G0294400ZS的编码区没有变异,但是表达量存在差异,有可能是启动子区发生变化导致表达量的差异。BnaC09G0294500ZS的表达量存在显著性差异,在突变体ytl中扩增失败,有可能该基因在突变体中缺失。 综上,BnaC09G0294300ZS、BnaC09G0294400ZS、BnaC09G0294500ZS是可能性最大的候选基因。
3 讨论与结论
油菜成苗率提高能够增加幼苗与杂草的竞争能力。出苗率和成苗率影响作物的密度,从而影响田间覆盖的完整度和植株的健康程度,进而影响产量。黄化致死表型影响作物成苗率,降低单位面积作物的产量和品质。通过对黄化致死突变体的研究以期丰富甘蓝型油菜的种质资源,更好地服务于甘蓝型油菜植物叶色的突变的基础研究,为分子育种研究以及改良甘蓝型油菜基因编辑系统提供理论依据。
图位克隆技术是正向遗传学中分离基因的一种有效手段,该技术的关键之处就是筛选与目的基因相互连锁的分子标记并找到足够多交换单株。近年来,生物信息学和生物基因组学迅速发展,油菜多个品种的基因组序列相继宣布,在基因定位中优化了寻找标记的途径,用以设计更加简单有效的SNP、SSR、InDel 等标记。本研究使用油菜60K SNP芯片结合图位克隆技术,将定位区间缩小到198 kb,标记两侧仍有交换单株,但后续的工作中,在区间内还未开发出多态性标记,因此无法进一步缩小区间。
作物有机物积累和产量形成主要依靠叶绿体的光合作用,开展甘蓝型油菜黄化致死突变体的基础研究,能够丰富油菜光合作用调控网络,为提高油菜光合作用以及产量奠定理论基础。随着多组学的进步和不同物种基因组的不断释放,在模式植物拟南芥和水稻中,人们对于植物叶色突变体的关注逐渐增多,已经鉴定出很多控制色素合成和代谢、叶绿体生物合成、光形态建成途径中的关键基因。但在甘蓝型油菜中,对于叶色突变体的研究和报道并不是很多。2000 年,甘蓝型油菜中首个叶色突变体Cr被发现,该突变体在苗期叶色变黄,后期叶色逐渐恢复正常,之后被应用于甘蓝型雄性不育杂交育种中[27]。2014 年,Zhu 等通过图位克隆和遗传转化的方法确定了BnaC.HO1是控制BnaC.ygl叶色黄化的目的基因[7]。肖华贵等发现的甘蓝型油菜黄化突变体NY在叶片发育后期甚至到衰老阶段才会转绿,在突变体发育阶段,体内的叶绿素含量以及光合速率均降低[28]。甘蓝型油菜中,通过CRISPR-Cas9技术敲除Bn.YCO,转基因后代由于叶绿素合成和类囊体膜的发育受阻,出现子叶白化以及后期真叶杂色表型,该基因有可能参与质体转录途径,并且该突变体中,参与核糖体组装的相关基因下调表达[29]。由EMS 诱变得到的Bn.CDE1突变体,该突变体由单显性基因控制,在发育时期表现为叶片和花蕾叶绿素合成不足,导致浅绿表型[30]。甘蓝型油菜中研究的大多数叶色突变体为苗期表型黄化,后期叶色恢复正常,突变体均表现为叶绿素含量降低,叶绿体发育不正常。cyd1基因编码FtsH1水解酶,该基因突变导致植物无法正常进行光合作用,子叶持续黄化不返绿,播种10 d 之后死亡[12],与本研究突变体具有相同的表型。
本研究通过甘蓝型油菜60K SNP芯片技术结合图位克隆将突变体ytl定位在C09 染色体分子标记SSR-140 和PBZIN-1 之间,该区段内的基因没有报道过与黄化致死相关的表型,之后对候选基因进行表达量和比较测序分析,预测目的基因。10 个候选基因的表达量在突变体中均下调表达,可能是由于突变体长势较弱,植株无法进行光合作用,自我供能不足,影响植株其他的调控途径。比如BnaC09G 0294700ZS,在拟南芥中同家族的基因参与调控植物根系的生长速率,由于突变体不能进行自养,导致植株根系生长能力不足,相关基因表达下调。在候选区间内的10 个基因中,BnaC09G0294300ZS在拟南芥中的同源基因报道参与植物囊泡的运输,在叶绿体发育初期以及后期的正常运作阶段涉及大量的蛋白质的运输,该基因编码区不存在变化,但是表达量有差异,有可能是启动子区发生变异,所以不排除其为候选基因。BnaC09G0294400ZS在拟南芥中的相关注释是涉及到蛋白质泛素化过程,有可能参与叶绿体的光形态建成途径进而影响叶绿素的合成以及改变植物叶片颜色。蛋白质泛素化是蛋白质翻译后的修饰途径之一,参与多个细胞的基本反应[24]。该基因的编码区没有变异,表达量存在差异,不排除启动子区变异导致突变的可能。BnaC09G0294500ZS在拟南芥同源基因中没有注释信息,但是表达量存在差异,并且在突变体中扩增失败,有可能该基因在突变体中缺失导致突变表型,该基因也有可能是目的基因。综上,预测BnaC09G0294500ZS是目前候选区间内可能性最大的目的基因,但该基因是否为目的基因还需要下一步的研究。
