miR-28 调控非小细胞肺癌细胞增殖、迁移与侵袭的作用机制
2022-09-03麦宗炯蔡玉莹王美才杨志雄吴爱兵
麦宗炯,蔡玉莹,王美才,杨志雄,吴爱兵
1.广东医科大学附属医院肿瘤医院,广东 湛江 524000;2.湛江中心人民医院肿瘤科,广东 湛江 524000
肺癌是目前世界上发病率和死亡率最高的恶性肿瘤,中国每年新增肺癌患者约30 万例[1]。肺癌可分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)两大类,非小细胞肺癌占所有肺癌病例的85%以上[1-2]。肺癌早期往往无明显症状,超过一半的肺癌患者在确诊时伴有远处转移,而转移性非小细胞肺癌患者的5 年总生存率还不到5%[3-4]。非小细胞肺癌的高发病率与高致死率使其成为癌症相关死亡的主要原因。因此,研究和开发新的方法对非小细胞肺癌的诊断和治疗具有重要意义。
许多研究表明miRNAs/miRs 参与了非小细胞肺癌的发生发展[5]。miRNAs 是一类由17~25 个核苷酸组成的高度保守的单链非编码RNA,其通过与靶信使RNA(mRNA)的3'-非翻译区(3'UTR)相互作用来调节基因的表达,被广泛认为是肿瘤发生发展的重要调控因子[6]。已有研究报道,miRNAs 通过参与调节肿瘤细胞的增殖、凋亡和转移在多种类型的人类肿瘤中作为促癌因子或抑癌因子[7]。在非小细胞肺癌的生物学进展中,也发现了一些重要的miRNA 与非小细胞肺癌患者的生存和癌症复发密切相关[8]。miR-28由染色质3q27-28 转录而来,其前体(pre-miR-28)在细胞质中经过Dicer 酶加工后生成成熟体miR-28-3p和miR-28-5p[9]。miR-28 已被证实在多种恶性肿瘤中表达异常。miR-28 在肿瘤中的表达具有组织特异性,具有肿瘤促进或肿瘤抑制的作用。研究表明miR-28 在胃癌[10]、卵巢癌[11]中促进肿瘤细胞的增殖,而在非霍奇金淋巴瘤[12]、肝癌[13]中抑制肿瘤细胞的增殖。目前关于miR-28 的表达异常在非小细胞肺癌的作用尚不明确[14]。因此,miR-28 在调控非小细胞肺癌细胞增殖、侵袭、迁移的作用机制方面需要进一步研究,现报道如下:
1 材料与方法
1.1 材料 miR-28 minics 和miR-28 inhibitor转染序列购买于上海吉玛公司(hsa-miR-28-5p mimics:sense 5'-AAGGAGCUCACAGUCUAUUGAG-3',antisense 5'-CAAUAGACUGUGAGCUCCUUUU-3',mi-m-ics NC:sense 5'-UUCUCCGAACGUGUCACGUTT-3';anti-sense 5'-ACGUGACACGUUCGGAGAATT-3';hsamiR-28-5p inhibitor:5'-CUCAAUAGACUGUGA-GCU CCUU-3',inhibitor NC:5'-CAGUACUUUUGUGUAG-UACAA-3')。Transwell 小室和基质胶来自Corning公司,荧光素酶报告基因试剂来自美国ABcom 公司,细胞周期试剂来自碧云天公司。脂质体LipofectamineTM2000、RPMI1640为美国Invitrogen公司产品,胎牛血清、蛋白裂解液、PVDF 膜购自华奇盛公司,RAP1B抗体购于Cell Signaling Technology 公司,二抗购于中杉金桥公司。
1.2 细胞培养方法 人肺腺癌细胞株A549 和H299为贴壁细胞,为广东医科大学附属医院临床科研中心保存,培养于含10%胎牛血清的RPMI-1640培养基中,置于5%CO2、37℃恒温细胞培养箱中培养,在细胞生长状态良好时用于实验。
1.3 CCK8 实验 取生长状态良好的培养细胞,在96孔板中加入100 μL的细胞悬液,将培养板在培养箱预培养24 h(37°C,5%CO2),向培养板中加入10 μL不同浓度的待测物质。将培养板在孵育箱内孵育24 h。向每孔加入10 μL CCK8 溶液,将培养板在孵育箱内孵育4 h,用酶标仪测定在450 nm 波长测定各孔吸光度值(OD 值),以相对应OD 比值表示细胞增殖能力大小。实验重复3次,以时间为横坐标、吸光值为纵坐标绘制细胞生长曲线。
1.4 平板克隆实验 取生长状态良好的培养细胞,接种100个细胞到6孔培养板中。在培养箱中孵育两周。当培养皿中出现肉眼可见的克隆时终止培养。弃去上清液,磷酸盐缓冲液(PBS)洗两次后,加入甲醇固定15 min。去甲醇后空气干燥;用Giemsa应用染液染色5 min。流水缓慢洗去染液,空气干燥后用肉眼直接计数克隆。实验重复3 次。平板克隆形成率=形成克隆数/接种细胞数100%。
1.5 细胞周期实验 生长状态良好的培养细胞,胰酶消化后制成单细胞悬液,将细胞接种在培养基上,RPMI 1640 培养基中直径为10 cm 的培养板含有10%的人肾母细胞瘤细胞(NBC)。孵育24 h 后,总共收集1×106个细胞,用冷PBS 冲洗,并在4℃下用70%冰冷乙醇固定48 h。用冷PBS 冲洗固定细胞,然后与含有10 μg/mL 碘化丙啶的PBS 孵育以及0.5 mg/mL RNA酶A,在37℃下持续15 min。DNA使用流式细胞仪获取标记细胞的含量。每次实验分3次进行。
1.6 划痕实验 将对数生长期细胞(1×l05个/孔)分别单层接种至6 孔板中,待融合度达50%~60%时,弃去培养基,用l mL 蓝色枪尖划痕,PBS 洗细胞三次后加入含有10%胎牛血清(FBS)的新鲜培养基,开始实验时间记录为W0h,继续培养24 h(W24h),置于倒置显微镜下观察拍照。采用愈合率为细胞迁移能力的量化评估标准,愈合率=(W0h-W24h)/W0h×l00%。实验重复3次。
1.7 Transwell小室迁移实验 生长状态良好的培养细胞,胰酶消化后制成单细胞悬液,无血清培养基洗涤细胞两次后,细胞计数,调整细胞浓度为1×106/mL。加100 μL细胞悬液于内室,然后加500 μL含10%新生牛血清的完全培养基于下室,37℃培养12 h。取出小室,用棉签轻轻擦掉未穿过膜的细胞,甲醇固定15 min,弃甲醇后空气干燥,用Giemsa应用染液染色5 min,用蒸馏水轻轻地冲洗数次,空气中风干。显微镜下随机选取5个高倍视野计数穿过膜的细胞数。重复3次。
1.8 Boyden小室侵袭实验 利用4℃预冷的无血清培养基稀释基质胶(Matrigel)(按1∶8稀释),在Chamber上室底部中央垂直加入100 μL 稀释后的Matrigel,37℃温育4 h 使其干成胶状,取对数生长期细胞、胰酶消化、加培养基终止消化,离心2 min(800 r/min),用无血清培养基重悬,调整细胞加100 μL无血清细胞悬液于小内室,在24 孔板下室加入500 μL 含20%FBS 的培养基,然后培养箱孵育16 h。收集小室,利用棉签擦拭小室内细胞,甲醇固定>5 min,PBS 液清洗3 次,空气风干。400倍显微镜下随机五个视野观察细胞并计数。实验重复3次。
1.9 双荧光素酶报告基因实验 取对数生长期细胞,接种于6 孔板中,将野生型(RAP1B-WT)或突变型(RAP1B-mut)报告质粒与miR-28 或miR-control 共转染到HEK293T 细胞中,转染48 h 后严格按照双荧光素酶报告基因检测试剂盒说明书检测荧光素酶活性。实验重复3次。
1.10 实时荧光定量PCR (qRT-PCR) 收集处于对数生长期的肺腺癌细胞,PBS 洗两遍,加入Trizol提取总RNA,反转录后进行qRT PCR检测。miR-28 mimics引物序列为:5'-ACACTCCAGCTGGGAAGGAGCTCACAGTC-3'(上游序列),5'-CAGTGCAGGGTCCGAGGT-3' (下游序列);内参U6 的引物序列为:5'-CTCGCTTCGGCAGCACATATACT-3' (上游序列),5'-ACGCTTCACGAATTTGCGTGTC-3' (下游序列)。每孔10 μL体系,设置3个平行样。样本经过3 次独立重复实验,所得数据使用2-ΔCt或者2-ΔΔCt(ΔCt=Ct目的基因-Ct内参)进行相对定量分析。
1.11 Western blot 取状态良好对数生长期细胞,提取蛋白,配制10%SDS聚丙烯酰胺凝胶,并加入30 μg蛋白进行电泳。电泳结束后,转移蛋白至PVDF上。3%牛血清白蛋白封闭后,加入RAP1B 抗体和β-Actin抗体进行孵育。然后用二抗进行孵育,用奥德赛条带扫描仪扫描蛋白条带。
1.12 统计学方法 应用SPSS13.0统计软件处理数据。计量资料符合正态分布,以均数±标准差(±s)表示,两组计量资料比较采用非配对t检验,而两组以上计量资料比较采用方差分析(ANOVA)。以P<0.05 为差异有统计学意义。
2 结果
2.1 qRT-PCR 验证转染效率 为了研究miR-28在非小细胞肺癌细胞系中潜在的生物学功能,把miR-28 mimics、miR-28 NC、miR-28 inhibitor分别转染到A549 和H1299 非小细胞肺癌细胞系中。RTq-PCR结果显示:与miR-28 NC比较,转染miR-28 mimics后肺癌细胞miR-28 的表达增加,差异有统计学意义(P<0.05),转染miR-28 inhibitor 后肺癌细胞miR-28 的表达下降,差异也有统计学意义(P<0.05),见图1。

图1 RTq-PCR结果验证转染后肺癌细胞miR-28表达水平
2.2 miR-28对非小细胞肺癌细胞增殖的影响 在确定转染成功后,通过CCK-8、克隆形成实验和细胞周期实验评估非小细胞肺癌细胞系A549、H1299细胞的增殖能力。CCK-8实验结果显示,与miR-28 NC比较,转染miR-28 mimics组A549 和H1299 细胞的增殖速度均明显减慢;转染miR-28 inhibitor 组A549 和H1299 细胞的增殖速度则增快(图2A、2B)。克隆形成实验结果显示,与miR-28 NC 比较,转染miR-28 mimics 组A549 和H1299 细胞的克隆形成率均明显减 少:A549:(106.33±18.58) vs (46±8.00);H1299:(87.67±6.43)vs(38.67±3.51),差异均具有统计学意义(P<0.05);转染miR-28 inhibitor 组的克隆形成率则明显增加:A549:(90.33±8.15)vs(130±5.29);H1299:(93.67±7.77) vs (121±12.53),差异均有统计学意义(P<0.05),见图2。CCK-8 实验、克隆形成试验结果直接表明,过表达miR-28可以抑制非小细胞肺癌细胞的增殖,抑制miR-28表达则促进非小细胞肺癌细胞的增殖。细胞周期实验结果显示,过表达miR-28 使处于S期的非小细胞肺癌细胞的百分比下降,瞬转miR-28 inhibitor 与miR-28 NC 处于S 期的非小细胞肺癌细胞的百分比比较差异无统计学意义(图2E)。
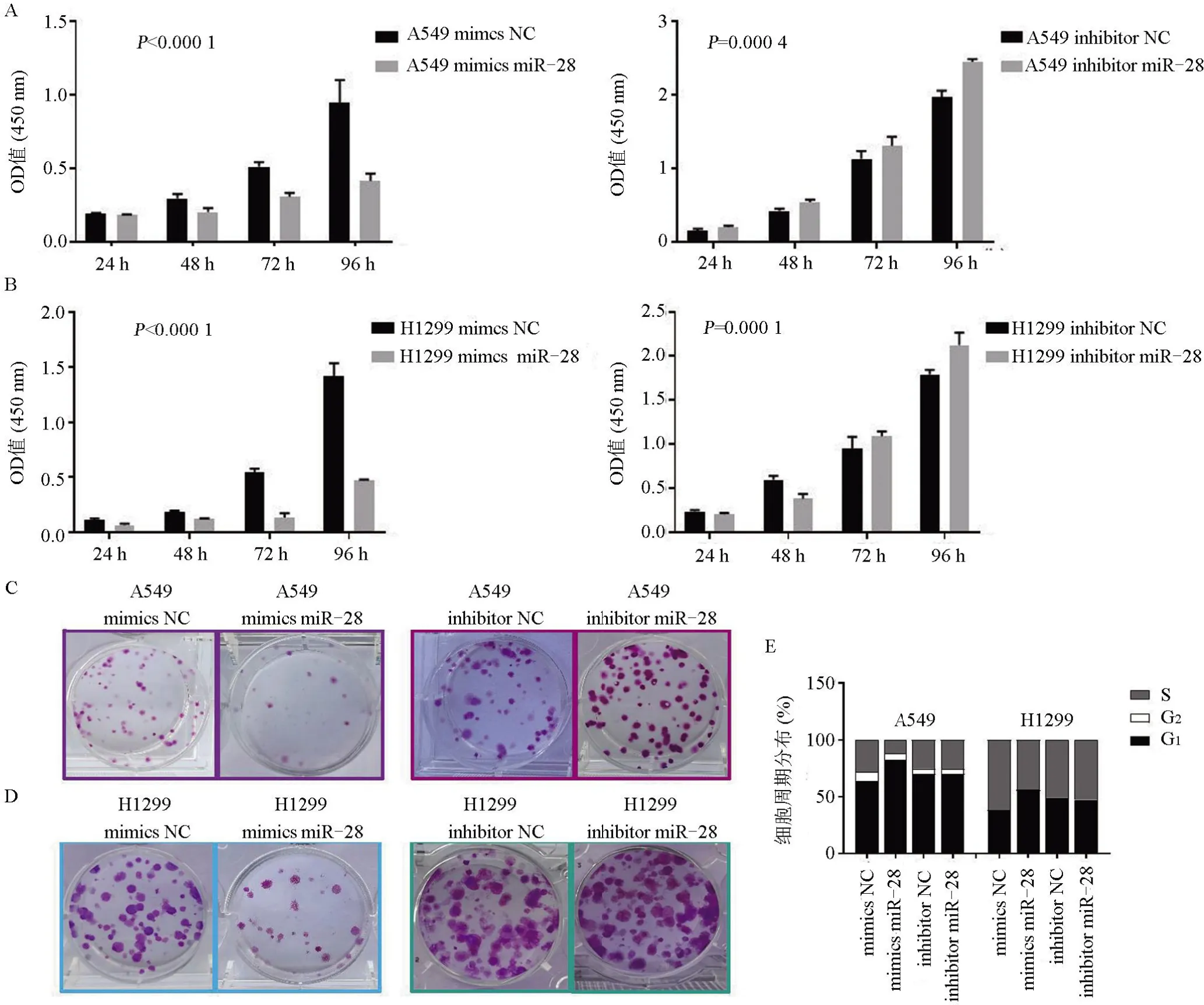
图2 miR-28抑制非小细胞肺癌细胞的增殖
2.3 miR-28 抑制非小细胞肺癌细胞的迁移与侵袭 利用划痕实验、Transwell 迁移实验和Boyden 侵袭实验探究miR-28 对非小细胞肺癌细胞的迁移与侵袭能力的影响。在划痕实验中,发现过表达miR-28后A549 和H1299 细胞的迁移能力均下降,而沉默miR-28的表达后A549和H1299细胞的迁移能力均增加(图3)。
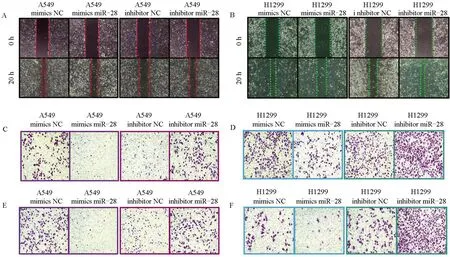
图3 miR-28抑制非小细胞肺癌细胞的迁移与侵袭
2.4 miR-28直接靶向RAP1B 作为RAS癌基因家族的一员,RAP1B被发现参与人类癌症的调控。通过生物信息学(TargetScan、PicTar)等软件分析发现RAP1B可能是miR-28的潜在靶基因,两者的结合位点如图4所示。通过荧光素酶报告基因实验验证miR-28可以直接靶向RAP1B。将野生型(RAP1B-WT)或突变型(RAP1B-mut)报告质粒与miR-28或miR-control共转染到HEK293T 细胞中,结果显示在miR-28 mimic 和RAP1B-WT共转染组中,荧光素酶活性显著降低;而在miR-28 mimic和RAP1B-mut共转染组中,荧光素酶活性并未降低(图5)。这些证据表明在非小细胞肺癌细胞中RAP1B是miR-28的作用靶点。
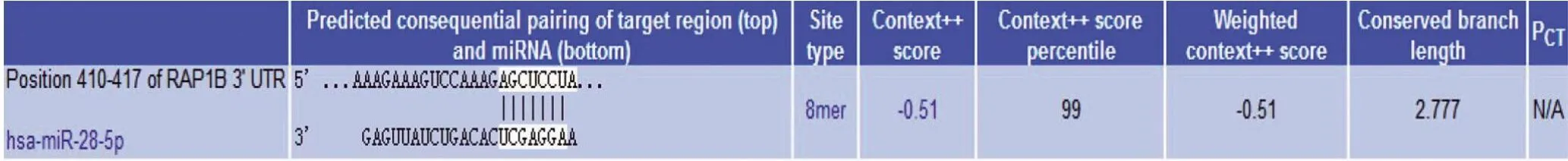
图4 miR-28可靶向结合RAP1B的3’-UTR 区的同源序列
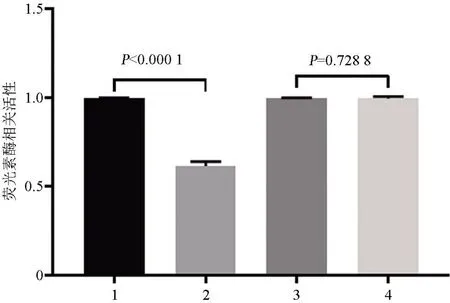
图5 荧光素酶活性检测实验结果显示miR-28直接靶向RAP1B
2.5 miR-28 在转录和翻译水平抑制RAP1B 基因的表达 利用RT-qPCR 和Western blot 方法检测miR-28 分别在mRNA 转录和蛋白翻译水平调节RAP1B 表达的作用。RT-qPCR 结果显示,与miR-28 NC 比较,miR-28 mimics 转染后的A549 和H1299 细胞内源性RAP1B mRNA水平显著降低;miR-28 inhibitor 转染后的A549 和H1299 细胞内源性RAP1B mRNA 水平则显著增加(图6A、6B)。利用Western blot 方法检测A549 和H1299 细胞分别转染miR-28 mimics、miR-28 inhibitor后RAP1B蛋白水平的变化情况,结果显示miR-28 过表达显著抑制RAP1B 的蛋白表达水平,抑制miR-28 则提高RAP1B 的蛋白表达水平(图6C、6D)。
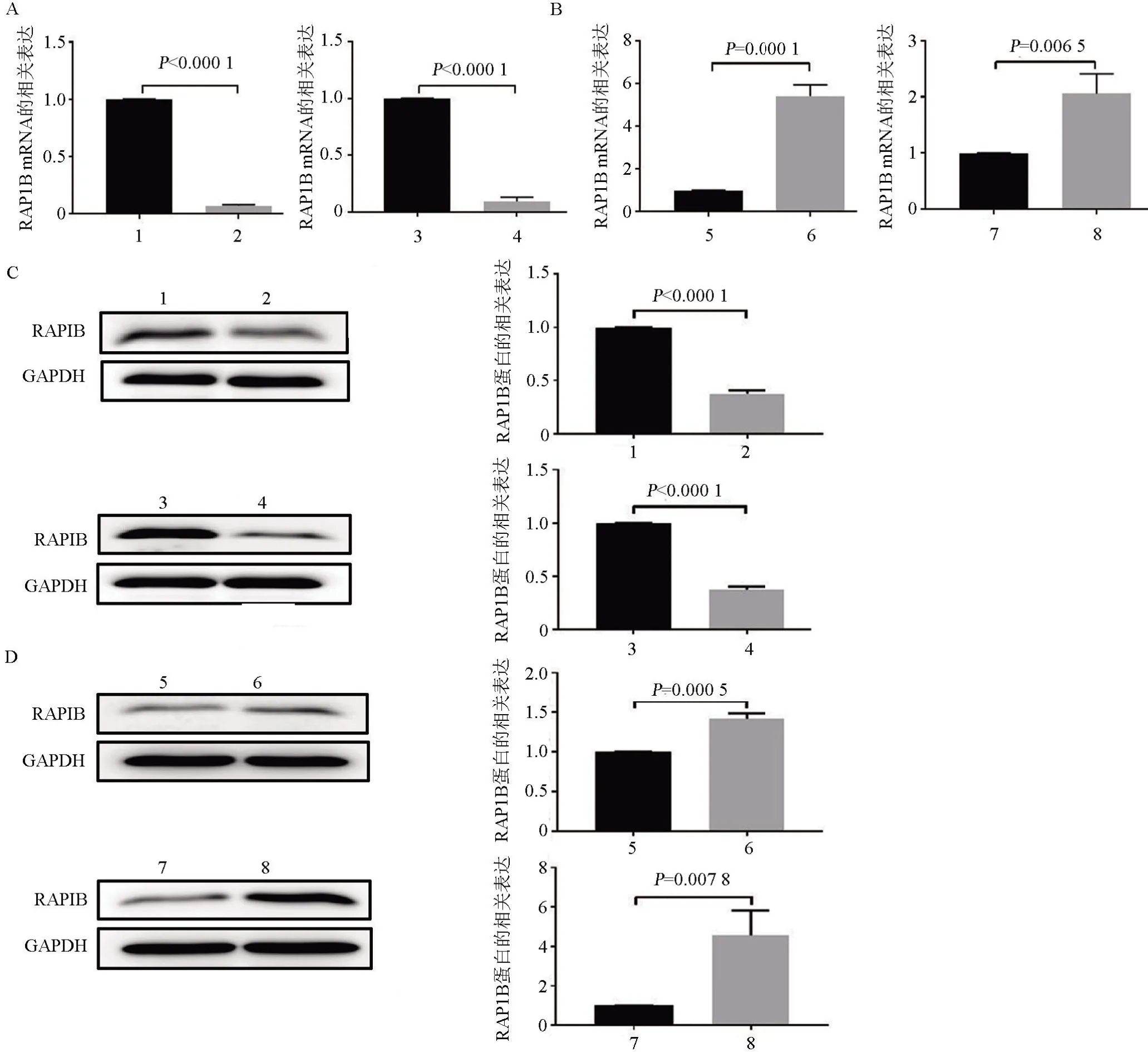
图6 miR-28在mRNA转录和蛋白翻译水平抑制RAP1B的表达
3 讨论
miRNAs 在肿瘤的发生、发展和治疗预后的评估中起着重要的作用[15]。miR-28 作为一种可能调节肿瘤生长的miRNA,其表达水平与癌细胞的增殖、迁移与侵袭密切相关。笔者对既往的文献进行回顾学习,发现miR-28 在胃癌[10]中表达升高促进癌症进展,而在非霍奇金淋巴瘤[12]中上调则抑制肿瘤进展;miR-28 不同的亚型在同类细胞的作用也不一致,在鼻咽癌细胞[16]中发现miR-28-5p 可抑制细胞增殖、侵袭,而miR-28-3p 促进细胞增殖、侵袭。上述研究说明miR-28 在不同类型癌症中的作用并不总是相同的,而miR-28 的不同亚型在同一种癌症中可能具有完全相反的功能。
目前研究认为RAP1B 可以通过与GTP 结合产生活性形式而与大量效应蛋白结合,从而将信号传输到信号通路的下游组件,产生细胞调控作用[17]。既往的许多研究表明RAP1B 在多种癌症中存在显著的调节作用,其通过调节肿瘤细胞增殖、侵袭和参与多种免疫细胞的功能来影响肿瘤进展。研究表明负调控RAP1B 的表达能抑制结直肠癌的发展[18-19],抑制甲状腺癌中RAP1B 的表达同样可以抑制癌细胞增殖和侵袭[20],而RAP1B的过表达与胃癌患者的不良预后呈正相关[21]。为了探究miR-28 抑制肺癌细胞增殖和迁移的作用机制,笔者通过miRNA生物信息学分析和荧光素酶报告基因实验发现miR-28与RAP1B基因有较高的匹配度,并通过荧光素酶报告实验证明RAP1B 是miR-28 调控的一个下游靶基因。实验结果表明在非小细胞肺癌细胞中过表达miR-28可以抑制RAP1B基因的表达,而下调miR-28 则会促进RAP1B 基因的表达。这表明miR-28在mRNA转录和蛋白翻译水平上均抑制内源性RAP1B的表达,这在一定程度上解释了miR-28抑制非小细胞肺癌的发生。
综上所述,miR-28 过表达时可通过下调RAP1B基因的表达来抑制非小细胞肺癌的增殖、转移、侵袭。
