荧光腹腔镜肝切除术与开腹肝切除治疗肝细胞癌对患者免疫功能及预后的影响
2022-09-03成勇陈港心万永张典朋徐冰
成勇,陈港心,万永,张典朋,徐冰
1.安康市人民医院普外科,陕西 安康 725000;2.西安交通大学第一附属医院老年外科,陕西 西安 710061
肝细胞癌(hepatocellular carcinoma,HCC)为临床常见恶性肿瘤。经流行病学调查发现,全球每年因肝癌而死亡患者高达100 万以上[1];既往研究表示,肝癌患者生存率相对较低,即五年生存率不足5.0%[2]。目前临床对于HCC发病原因及发病机制尚未明确,仅认为它的发生与基因突变、遗传因素、病毒性肝炎等有关[3]。其中,我国肝癌患者多是由慢性肝炎演变而来,在病毒持续性破坏肝细胞,引发肝硬化,最终发展至原发性肝癌,而原发性肝癌又以HCC最为常见。针对该病,临床一般采用手术方法治疗,譬如开腹肝切除术、荧光腹腔镜肝切除术等。虽然开腹肝切除术能将病灶组织完全切除,但具有创伤大等缺点,可能会影响免疫功能,不利于患者预后恢复;而荧光腹腔镜肝切除术是一种微创手术,具有创伤小、术后恢复等优点,但有学者质疑其是否能完全切除病灶组织。本研究旨在探讨荧光腹腔镜肝切除术与开腹肝切除对患者免疫功能及预后的影响。
1 资料与方法
1.1 一般资料 选取2018 年2 月至2020 年2 月在安康市人民医院就诊且符合以下纳入和排除标准的82 例HCC 患者纳入研究。纳入标准:①符合临床HCC,经病理检查确诊;②肿瘤直径≤8 cm;③认知功能正常;④近期6 个月未接受腹腔镜手术治疗。排除标准:①合并严重凝血功能障碍;②伴有免疫系统疾病;③预计生存时间<6 个月。按照随机数表法将患者分为观察组和对照组,每组41 例。观察组患者中男 性21 例,女性20 例;年龄32~60 岁,平均(41.32±8.25)岁;肿瘤直径(4.21±1.32)cm;Child 分级:A 级38 例、B 级3 例。对照组患者中男性19 例,女性22 例;年龄31~61 岁,平均(41.39±8.19)岁;肿瘤直径(4.17±1.36)cm;Child分级:A级36例、B级5例。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,所有患者均签署知情同意书。
1.2 手术方法 两组患者于术前禁水4~6 h,禁食8~12 h,行肠道准备及放置胃管和导尿管,且采用气管插管,予以吸入好静脉复合全身麻醉。
1.2.1 观察组 该组患者予以荧光腹腔镜肝切除术治疗。具体方法:若为左叶肝段切除术取仰卧位,若为右叶肝段切除术则取左侧卧位,术中采用Esaote MyLabTMCIassC 腹腔镜超声仪,选择8666 型号探头,频率为4~10 MHz,先建立气腹(压力14 mmHg,1 mmHg=0.133 kPa),于脐下处为观察孔位置,剑突下3~5 cm为操作孔位置,进入腹腔后利用腹腔超声全面扫描肝脏,观察肿瘤大小、位置、腹腔黏连等情况,再定位肿瘤及目标肝蒂门静脉,在腹腔镜超声引导下穿刺目标门静脉分支,穿刺成功后注入吲哚菁绿0.125~0.250 mg;其次在腹腔镜系统荧光融合模式下,确认染色成功后沿着荧光染色边缘行切除术,即采用超声刀、超声吸引刀、电刀等离断肝实质,沿途结扎断离较大血管及胆管,直至断离至门静脉蒂部,夹闭后切断,完全切除病灶所在肝段,切除完毕后于肝残面及温氏孔放置引流管,经腹壁引出后采用缝线固定,再关闭腹腔。
1.2.2 对照组 该组患者予以开腹肝切除术治疗。具体方法:取平卧位,在右侧肋下缘做一切口,电刀逐层进入腹腔,游离部分肝周韧带组织后,在第一肝门预置阻断带,采用超声定位肿瘤病灶后选择Pringle法阻断肝门,完整切除肿瘤病灶后取出,止血,放置引流管,清洗创面,缝合切口。
1.3 观察指标 两组患者均随访1年,每3个月随访一次,随访方式包括电话、上门及患者来院复查。(1)手术相关指标:包括手术时间、术中出血量、首次进食时间、住院时间;(2)体液免疫:于术前、术后3 d 采集患者空腹静脉血3 mL,采用酶联免疫吸附法测定免疫球蛋白,包括IgA、IgG、IgM;(3)T淋巴细胞亚群:于术前、术后3 d 采集患者空腹静脉血3 mL,采用BD_FACSCalibur流式细胞仪测定T淋巴细胞亚群,包括CD3+、CD4+、CD8+,计算CD4+/CD8+比值;(4)肝功能:术前、术后1 d、术后1 个月采集患者静脉血3 mL,采用采用日本日立7600 全自动生化仪及配套试剂测定丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST);(5)并发症:记录两组患者术后两周内是否出现胸腔积液、肺部感染、创面渗血、胆漏、全身感染等并发症;(6)死亡和复发:两组患者均进行为期1 年的随访。复发:随访期间行超声、CT 或MIR 等影像学检查,发现手术切缘出现新发肿瘤为局部复发,若肝内其他部位出现新发肿瘤则定义为远处复发。死亡:以随访期间因病情进展而死亡。
1.4 统计学方法 应用SPSS22.0统计软件分析数据。计量资料符合正态分布,以均数±标准差(±s)表示,两组间采用独立样本t检验;组间整体比较采用重复测量方差分析,两两比较采用LSD-t检验;分类变量以例数和百分率用表示,行χ2检验;手术方式、复发、并发症对预后的影响采用Cox 回归模型分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者的手术相关指标比较 两组患者的手术时间比较差异无统计学意义(P<0.05);观察组患者术中出血量明显少于对照组,而首次进食时间、住院时间明显短于对照组,差异均有统计学意义(P<0.05),见表1。
表1 两组患者的手术相关指标比较(±s)

表1 两组患者的手术相关指标比较(±s)
组别观察组对照组t值P值例数41 41手术时间(min)146.74±21.52 139.25±23.45 1.507 0.136术中出血量(mL)136.52±15.21 282.33±20.52 36.553 0.001首次进食时间(d)2.35±1.02 3.77±1.32 5.451 0.001住院时间(d)7.45±1.32 11.52±3.05 7.842 0.001
2.2 两组患者手术前后的体液免疫比较 术前,两组患者的IgA、IgG、IgM指标比较差异均无统计学意义(P>0.05);术后3 d,观察组患者的IgA、IgG、IgM明显高于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组患者手术前后的体液免疫比较(g/L,±s)

表2 两组患者手术前后的体液免疫比较(g/L,±s)
指标IgA IgG IgM组别观察组对照组t值P值观察组对照组t值P值观察组对照组t值P值例数41 41 41 41 41 41术前4.12±1.32 4.16±1.30 0.138 0.89 13.15±3.52 13.18±3.47 0.039 0.969 2.85±0.95 2.83±0.99 0.093 0.926术后2.59±0.69 1.54±0.42 8.323 0.001 9.72±1.65 6.30±1.05 11.197 0.001 1.95±0.52 1.32±0.25 6.992 0.001 t值6.577 12.28 5.650 12.151 5.321 9.467 P值0.001 0.001 0.001 0.001 0.001 0.001
2.3 两组患者手术前后的T淋巴细胞亚群比较 术前,两组患者的CD3+、CD4+、CD8+、CD4+/CD8+指标比较差异均无统计学意义(P>0.05);术后3 d,观察组患者的CD3+、CD4+、CD4+/CD8+明显高于对照组,而CD8+明显低于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者手术前后的T淋巴细胞亚群比较(±s)
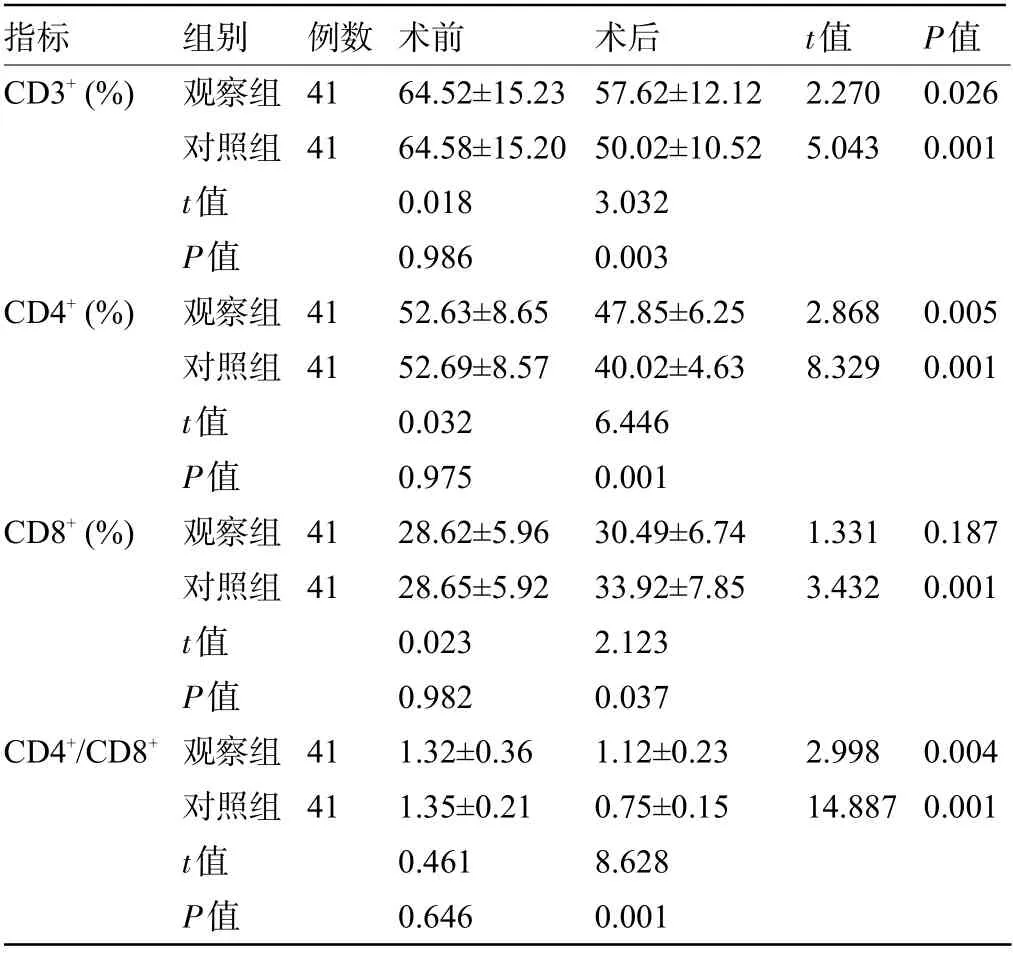
表3 两组患者手术前后的T淋巴细胞亚群比较(±s)
指标CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+组别观察组对照组t值P值观察组对照组t值P值观察组对照组t值P值观察组对照组t值P值例数41 41 41 41 41 41 41 41术前64.52±15.23 64.58±15.20 0.018 0.986 52.63±8.65 52.69±8.57 0.032 0.975 28.62±5.96 28.65±5.92 0.023 0.982 1.32±0.36 1.35±0.21 0.461 0.646术后57.62±12.12 50.02±10.52 3.032 0.003 47.85±6.25 40.02±4.63 6.446 0.001 30.49±6.74 33.92±7.85 2.123 0.037 1.12±0.23 0.75±0.15 8.628 0.001 t值2.270 5.043 2.868 8.329 1.331 3.432 2.998 14.887 P值0.026 0.001 0.005 0.001 0.187 0.001 0.004 0.001
2.4 两组患者手术前后的肝功能比较 重复测量方差分析结果显示,两组患者ALT、AST 的时点效应、组间效应、时点与组间的交互效应比较差异均有统计学意义(P<0.05)。两两比较显示,术前,两组患者的ALT、AST比较差异均无统计学意义(P>0.05);术后1 d、1个月,观察组患者的ALT、AST明显低于对照组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者手术前后的ALT、AST比较(U/L,±s)
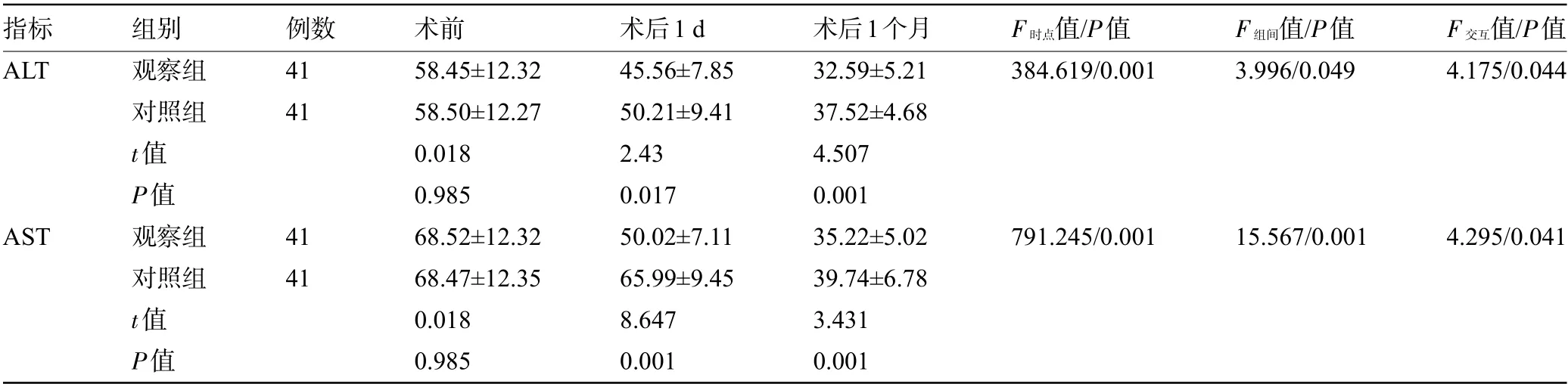
表4 两组患者手术前后的ALT、AST比较(U/L,±s)
指标ALT例数41 41 F 时点值/P值384.619/0.001 F 组间值/P值3.996/0.049组别观察组对照组t值P值观察组对照组t值P值术前58.45±12.32 58.50±12.27 0.018 0.985 68.52±12.32 68.47±12.35 0.018 0.985术后1 d 45.56±7.85 50.21±9.41 2.43 0.017 50.02±7.11 65.99±9.45 8.647 0.001术后1个月32.59±5.21 37.52±4.68 4.507 0.001 35.22±5.02 39.74±6.78 3.431 0.001 F 交互值/P值4.175/0.044 AST 41 41 791.245/0.001 15.567/0.001 4.295/0.041
2.5 两组患者的并发症比较 观察组患者总并发症发生率为7.23%,明显低于对照组的29.27%,差异有统计学意义(χ2=6.609,P=0.001<0.05),见表5。

表5 两组患者的并发症比较(例)
2.6 两组患者的预后比较 观察组患者1 年死亡率明显低于对照组,生存时间明显长于对照组,差异均有统计学意义(P<0.05),但两组患者的复发率比较差异无统计学意义(P>0.05),见表6。
表6 两组患者的预后比较[例(%),±s]
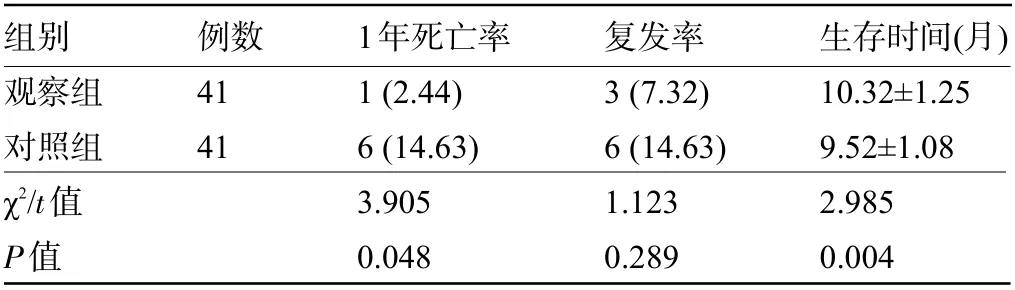
表6 两组患者的预后比较[例(%),±s]
组别观察组对照组χ2/t值P值例数41 41 1年死亡率1(2.44)6(14.63)3.905 0.048复发率3(7.32)6(14.63)1.123 0.289生存时间(月)10.32±1.25 9.52±1.08 2.985 0.004
2.7 影响患者预后的因素 以“手术方式、复发、并发症”作为协变量,将“1年生存率”作为因变量进行多因素分析。Cox 回归模型分析结果显示,开腹肝切除术是影响肝细胞癌患者1年生存率的独立危险因素(P<0.05),见表7。

表7 影响患者预后因素的Cox回归模型分析
3 讨论
HCC 是一种发生在正常肝脏组织细胞的恶性肿瘤。目前临床采用手术切除、肝脏移植等方法治疗。据临床调查,经手术切除术和肝脏移植术治疗的早期PHC患者,其五年平均生存率分别为53.0%、63.0%[4]。但肝脏移植术相比手术切除术,不仅具有较多的禁忌证,并且肝源稀缺,手术操作难度大,在一定程度上限制了该治疗方法的广泛推广;而手术切除术更适合临床推广,因此成为治疗PHC的首选。开腹切除术与腹腔镜切除术为临床常见术式。既往研究已证实开腹切除术的治疗效果,能较完整地切除病灶组织[5]。但也存在不足,如切口大、创伤大及术后恢复慢等。1994年中国完成首例腹腔镜肝切除术,加之其具有创伤小、术后恢复快等优势,在肝脏外科备受关注[6-7]。并且,近年来,随着各种腹腔镜外科器械的发展,在吲哚菁绿荧光引导下实施腹腔镜肝切除术,能实现精准切除病灶组织和清扫淋巴结的目标[8]。其中,吲哚菁绿是一种具备亲水性、亲脂性特点的三碳菁染料,通过与血浆蛋白、脂蛋白快速结合,穿过内皮细胞再由肝细胞选择性摄取,在荧光腹腔镜下呈蓝色或偏紫色影像,以帮助医师准确识别病灶位置,故而备受肝脏外科医生青睐[9]。另外,还具有以下几点优势[10-12]:①吲哚菁绿术前注射,能实现术中彻底清除显色区域淋巴结,避免遗漏及过度清扫情况发生;②准确定位肿瘤位置,实现精准切除,有利于降低吻合口复发率及切缘肿瘤阳性率;③荧光显像能及时发现变异情况及规避损伤,有利于减少并发症。
近年来,有关荧光腹腔镜与开腹切除术用于肝癌治疗报道较多,均显示荧光腹腔镜切除术治疗HCC疗效理想,能够实现与开腹切除术相当的远期疗效,但目前关于上述两种术式对免疫功能影响的报道研究较少。基于此,本研究着重分析荧光腹腔镜与开腹切除术对体液免疫和细胞免疫的影响,结果显示,上述两种手术均会对免疫功能起到抑制作用;但在组间比较中,发现实施开腹切除术治疗的对照组,其IgA、IgG、IgM、CD3+、CD4+、CD4+/CD8+下降程度较实施荧光腹腔镜肝切除术治疗的观察组更为明显,究其原因分析,可能与荧光腹腔镜肝切除术对机体损伤更小有关,故而免疫功能受到抑制程度也更轻[13]。上述已说到开腹切除术对机体具有较大的损伤,极易引起严重应激反应,导致免疫功能失衡[14]。另外,在肝功能方面,开腹切除术对其损伤更大,可能是在切除病灶组织的同时,也会损伤周围正常肝组织,进而造成肝功能短暂性受损[15-16]。研究结果中,术后1 d,对照组的ALT、AST 表达量高于观察组,1 个月后,其表达量逐渐下降,且下降至相对正常范围;而腹腔镜切除术在荧光的引导下能针对性切除病灶组织,对周围正常组织影响小,术后肝功能也基本正常[17-18]。同时,在死亡率和生存时间比较中,观察组随访1 年仅出现1例死亡,而对照组出现6例,观察组对预后改善也更为明显,且生存时间长于对照组,可能是与荧光腹腔镜肝切除术操作中无需大范围搬动和挤压肝脏有关,从而减少术中搬动及挤压引起的肿瘤细胞播散、转移风险,更有利于改善患者预后。另外,在Cox回归模型中也可见,手术方式是影响肝细胞癌患者预后的独立危险因素。
综上所述,荧光腹腔镜肝切除术与开腹肝切除术相比较,前者不仅对免疫功能影响小,并且预后转归也更优。
