基于STAT3通路探讨芍药苷对垂体瘤细胞增殖凋亡的影响
2022-09-03徐大伟刁玉领周文科汲乾坤
徐大伟,刁玉领,惠 磊,周文科,汲乾坤
垂体瘤是颅内常见的良性肿瘤,发生率占颅内肿瘤的10%~15%,仅次于脑胶质瘤和脑膜瘤,居第3位[1]。垂体瘤形态学表现为良性,但部分肿瘤呈侵袭性生长,可侵入邻近组织,引起各种并发症,影响病人内分泌及神经功能。垂体瘤具有恶性肿瘤特征,瘤细胞恶性增殖和侵袭性与复发及预后密切相关[2]。目前,垂体瘤的治疗方法主要包括手术、药物和放射,手术治疗引起一系列后遗症与并发症,放射治疗对垂体功能损伤较大[3]。因此,研发安全有效的药物意义重大。芍药苷是从毛茛科植物芍药中提取的一种单萜类葡萄糖苷化合物,是芍药的主要活性单体成分,具有抗炎、镇痛、抗氧化应激、扩张血管、神经保护等药理作用[4-5]。有研究显示,芍药苷对神经胶质瘤、胃癌、乳腺癌和肺癌等具有良好的抗肿瘤活性[6]。目前,关于芍药苷治疗垂体瘤的研究报道较少。本研究以人垂体瘤细胞为实验对象,探讨芍药苷对垂体瘤细胞增殖凋亡的影响及作用机制,为芍药苷相关药物的研发及垂体瘤的临床治疗提供参考。
1 材料与方法
1.1 实验材料
1.1.1 垂体瘤组织 垂体瘤标本由新乡医学院第一附属医院神经外科提供,经临床表现和病理组织学检查,手术中取新鲜垂体瘤组织块置于无菌生理盐水中,4 ℃保存。本研究经医院伦理委员会审核批准,且通过病人知情同意。
1.1.2 实验药品及试剂 芍药苷(HPLC>98%,上海融禾医药科技发展有限公司);四唑盐(MTT,美国Sigma公司);膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)凋亡检测试剂盒及核蛋白提取试剂盒(南京凯基公司);引物(上海生工生物工程股份有限公司);鼠抗人Janus激酶2(Janus kinase 2,JAK2)一抗、兔抗人磷酸化JAK2(p-JAK2)一抗、鼠抗人信号传导及转录激活因子3(signal transducers and activators of transcription,STAT3)一抗、兔抗人磷酸化STAT3(p-STAT3)一抗(美国Thermo Fisher Scientific公司);鼠抗人B淋巴细胞瘤-2基因(B cell lymphoma-2,Bcl-2)一抗、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)一抗和鼠抗人β-actin一抗(美国Santa Cruz公司);辣根过氧化物酶(HRP)标记的羊抗兔二抗、HRP标记的羊抗鼠二抗(英国Abcam公司);酶标仪(美国Thermo Fisher Scientific公司),蛋白凝胶电泳仪(上海天能科技有限公司),实时荧光定量聚合酶链式反应(RT-qPCR)仪(美国Bio-Rad公司),流式细胞仪(美国BD公司)。
1.2 实验方法
1.2.1 垂体瘤细胞的分离与培养 取新鲜垂体瘤组织,去除结缔组织、坏死组织及血块,剪碎至糊状。对其进行原代培养,0.25%胰蛋白酶消化1 h,待细胞分散良好后,加入含10%胎牛血清的RPMI 1640培养基终止消化,添加终浓度为0.87% NH4CI于37 ℃条件下作用5 min。100目细胞滤网过滤后,1 000 r/min(离心半径10 cm)离心10 min,弃上清液,加入含10%胎牛血清、2 mmol/L谷氨酰胺、100 U/mL青霉素和100 pg/mL链霉素的RPMI 1640培养基重悬细胞并使其分散,在37 ℃、5%CO2培养箱培养。2 d更换1次细胞培养液,直至细胞形成单层,使用0.25%胰蛋白酶消化,镜检计数,调整细胞密度为1×106/mL重新接种,传代培养。
1.2.2 MTT法测定细胞增殖 取对数期垂体瘤细胞,以1×105/mL的细胞密度接种于96孔板,每孔200 μL。待细胞贴壁后吸去培养基,加入不含血清的RPMI1640培养液饥饿培养12h后,更换不同浓度10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL、200 μg/mL、400 μg/mL、1 000 μg/mL芍药苷的RPMI 1640培养液,阴性对照组加入不含芍药苷培养液。每组设置3个复孔,孵育48 h。每孔加入MTT(5 mg/mL)20 μL,继续孵育4 h后终止培养,每孔加入二甲基亚砜(DMSO)150 μL,微振荡10 min。选择波长490 nm在酶标仪上读取各孔吸光度(A490 nm)值。实验重复3次,计算肿瘤细胞存活率:肿瘤细胞存活率(%)=(实验组吸光度值/阴性对照组吸光度值)×100%。选择细胞存活率为50%对应的芍药苷浓度作为后续实验的处理浓度,设置对照组、芍药苷组、JAK2/STAT3激动剂(Olanzapine)组和芍药苷+激动剂组,按照上述MTT法测定垂体瘤细胞存活率,实验重复3次。
1.2.3 流式细胞仪检测细胞凋亡 取对数生长期的垂体瘤细胞,以1×106/mL细胞密度接种于24孔板上。分别使用芍药苷(200 μg/mL)、JAK2/STAT3激动剂Olanzapine(20 μmol/L)、芍药苷(200 μg/mL)+JAK2/STAT3激动剂Olanzapine(20 μmol/L)处理垂体瘤细胞,对照组为不含血清的RPMI 1640培养液。48 h后收集细胞,以2 000 r/min(离心半径10 cm)离心5~10 min,使用预冷1×磷酸缓冲盐溶液(PBS)4 ℃重悬细胞,2 000 r/min(离心半径10 cm)离心5 min,洗涤细胞2次;加入300 μL的1×Binding Buffer悬浮细胞;先后加入5 μL的Annexin V-FITC和碘化丙啶(PI)避光室温孵育15min,采用流式细胞仪检测,实验重复3次。
1.2.4 RT-qPCR检测JAK2、STAT3、Bcl-2、Bax mRNA表达水平 收集各组细胞,PBS清洗细胞2次,按照Trizol试剂说明书提取总RNA,超微量分光光度计测定A260/280及其浓度。反转录体系:5×Mix 4 μL,RNA 1 μg,加DEPC-H2O至20 μL;反应程序:25 ℃ 10 min;42 ℃ 30 min;85 ℃ 5 min。逆转录产物稀释到1 mL作为cDNA。按照PCR试剂盒配制反应体系后进行反应,反应参数:95 ℃ 15 s;60 ℃ 15 s;72 ℃ 45 s。其中,95 ℃预变性60 s;共循环40次[7]。待测基因qPCR引物使用Primer 3.0设计,序列见表1。

1.2.5 蛋白免疫印迹法(Western Blot)检测JAK2、p-JAK2、STAT3、p-STAT3、Bcl-2、Bax蛋白表达 收集各组细胞,提取细胞总蛋白,BCA法检测样品浓度。蛋白变性,上样到10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),湿式转膜仪将其转移到NC膜上,5%脱脂牛奶室温封闭1 h,分别用JAK2(1∶500)、p-JAK2(1∶200)、STAT3(1∶500)、p-STAT3(1∶200)、Bcl-2(1∶200)、Bax(1∶200)、β-actin(1∶1 000)一抗4 ℃孵育过夜,TBST洗膜10 min×3次,再用HRP标记的二抗(1∶2 000)室温孵育1 h,TBST洗膜10 min×3次,电化学发光(ECL)暗室中显影,对感光胶片条带进行分析,目的蛋白条带灰度值/内参β-actin蛋白条带灰度值比值作为目的蛋白相对表达量。

2 结 果
2.1 芍药苷对垂体瘤细胞的生长抑制作用 与阴性对照组比较,不同浓度芍药苷作用于垂体瘤细胞48 h后,细胞生长受到抑制,随着芍药苷浓度升高细胞存活率下降。芍药苷>20 μg/mL,垂体瘤细胞存活率下降;芍药苷为40~1 000 μg/mL时,细胞存活率从85.35%降低至18.62%。芍药苷为200 μg/mL时,细胞存活率为50%。因此,选择200 μg/mL浓度芍药苷进行实验。详见图1。
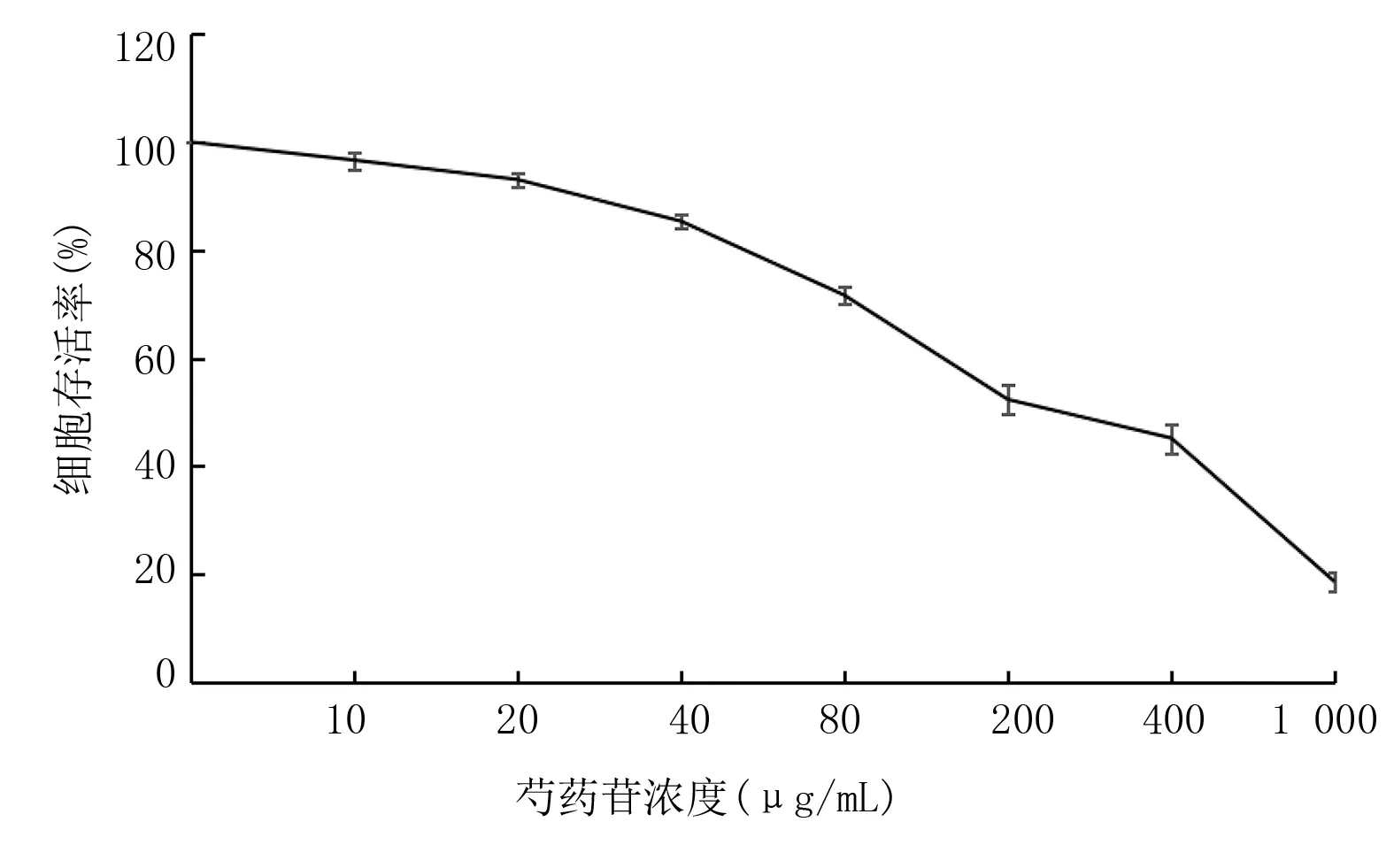
图1 不同浓度芍药苷对垂体瘤细胞存活率的影响
2.2 各组垂体瘤细胞存活率比较 各组垂体瘤细胞存活率比较,差异有统计学意义(P<0.001)。与对照组比较,芍药苷组垂体瘤细胞存活率降低,激动剂组垂体瘤细胞存活率升高(P<0.05);与芍药苷组比较,激动剂组、芍药苷+激动剂组垂体瘤细胞存活率升高(P<0.05);与激动剂组比较,芍药苷+激动剂组垂体瘤细胞存活率降低(P<0.05)。详见表1、图2。

表2 各组垂体瘤细胞存活率比较(±s,n=3) 单位:%
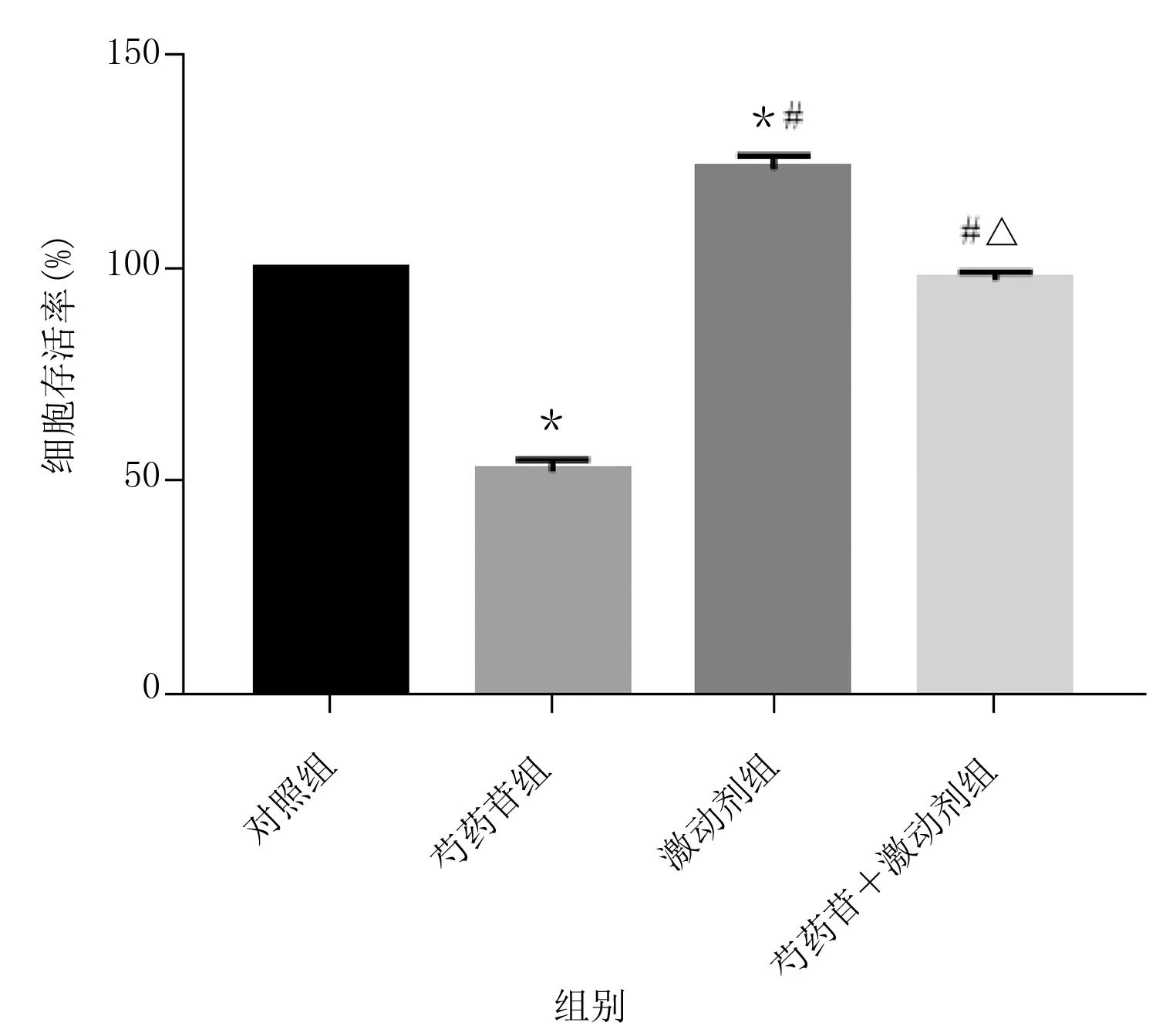
与对照组比较,*P<0.05;与芍药苷组比较,#P<0.05;与激动剂组比较,△P<0.05。图2 各组垂体瘤细胞存活率比较
2.3 各组垂体瘤细胞凋亡率比较 各组垂体瘤细胞凋亡率比较,差异有统计学意义(P<0.001)。与对照组比较,芍药苷细胞凋亡率升高,激动剂组垂体瘤细胞凋亡率降低(P<0.05);与芍药苷组比较,激动剂组、芍药苷+激动剂组垂体瘤细胞凋亡率降低(P<0.05);与激动剂组比较,芍药苷+激动剂组垂体瘤细胞凋亡率升高(P<0.05)。详见表3、图3。

表3 各组垂体瘤细胞凋亡率比较(±s,n=3) 单位:%
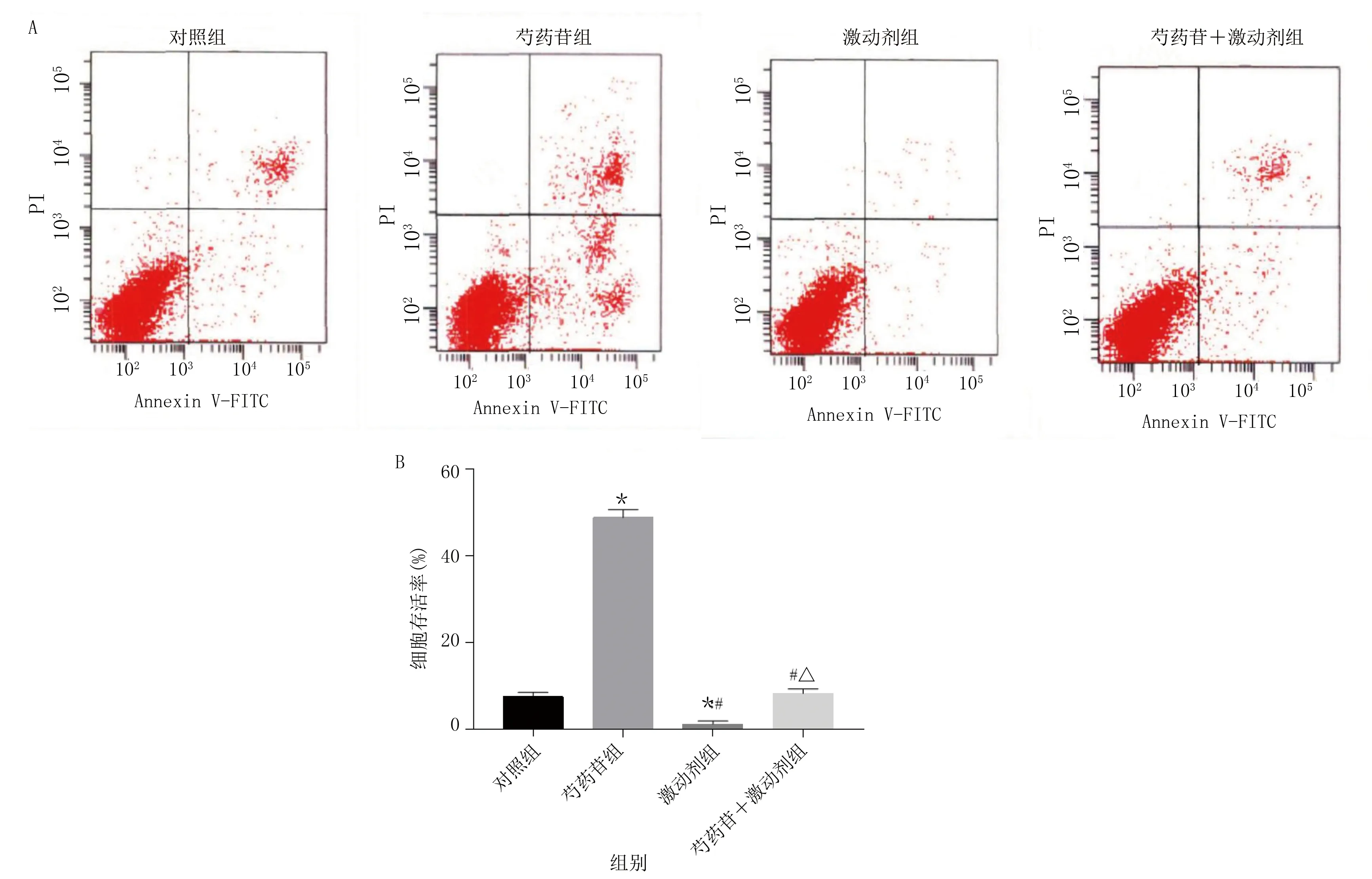
与对照组比较,*P<0.05;与芍药苷组比较,#P<0.05;与激动剂组比较,△P<0.05。图3 各组垂体瘤细胞凋亡情况(A为流式细胞术检测各组细胞凋亡情况;B为各组细胞凋亡率比较柱状图)
2.4 各组垂体瘤细胞JAK2、STAT3、Bcl-2和Bax mRNA水平比较 各组垂体瘤细胞Bcl-2和Bax mRNA相对表达量比较,差异有统计学意义(P<0.001)。与对照组比较,芍药苷组Bcl-2 mRNA相对表达量降低,Bax mRNA相对表达量升高,激动剂组Bcl-2 mRNA相对表达量升高,Bax mRNA相对表达量降低(P<0.05);与芍药苷组比较,激动剂组和芍药苷+激动剂组Bcl-2 mRNA相对表达量升高,Bax mRNA相对表达量降低(P<0.05);与激动剂组比较,芍药苷+激动剂组Bcl-2 mRNA相对表达量降低,Bax mRNA相对表达量升高(P<0.05)。各组JAK2、STAT3 mRNA表达比较,差异无统计学意义(P>0.05)。详见表4、图4。
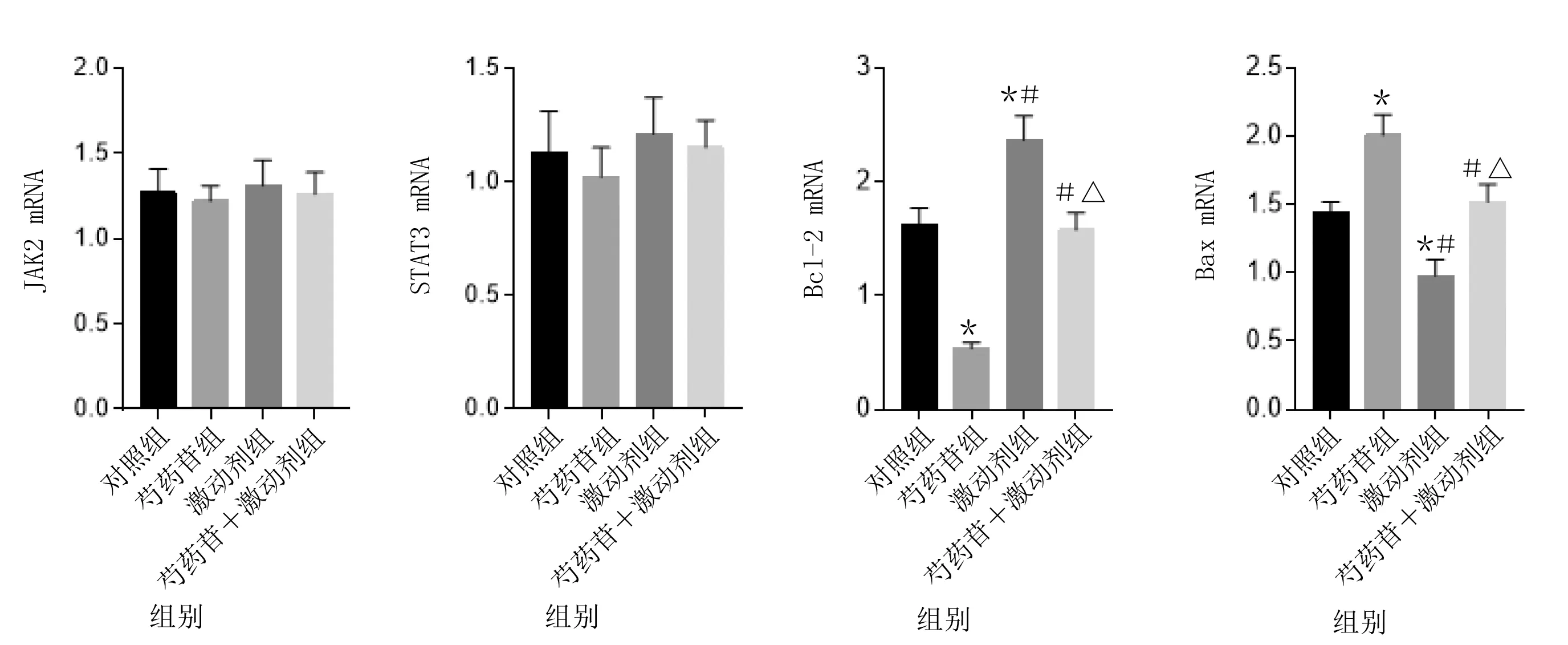
与对照组比较,*P<0.05;与芍药苷组比较,#P<0.05;与激动剂组比较,△P<0.05。图4 各组垂体瘤细胞JAK2、STAT3、Bcl-2和Bax mRNA水平比较柱状图
2.5 各组垂体瘤细胞JAK2/STAT3信号通路相关蛋白表达比较 各组垂体瘤细胞p-JAK2、p-STAT3、Bcl-2、Bax蛋白表达水平比较,差异均有统计学意义(P<0.001)。与对照组比较,芍药苷组p-JAK2、p-STAT3、Bcl-2蛋白表达减少,Bax蛋白表达增加,激动剂组p-JAK2、p-STAT3、Bcl-2蛋白表达增加,Bax蛋白表达减少(P<0.05);与芍药苷组比较,激动剂组和芍药苷+激动剂组p-JAK2、p-STAT3、Bcl-2蛋白表达增加,Bax蛋白表达减少(P<0.05);与激动剂组比较,芍药苷+激动剂组p-JAK2、p-STAT3、Bcl-2蛋白表达减少,Bax蛋白表达增加(P<0.05)。各组JAK2、STAT3蛋白表达比较,差异均无统计学意义(P>0.05)。详见表5、图5。

图5 各组垂体瘤细胞JAK2/STAT3信号通路相关蛋白表达条带图(A为对照组;B为芍药苷组;C为激动剂组;D为芍药苷+激动剂组)
3 讨 论
垂体瘤是常见的中枢神经系统肿瘤之一,流行病学研究表明,普通人群垂体瘤发病率为16.7%,目前的诊治难题包括肿瘤复发及药物抵抗等[8]。垂体瘤发病机制主要是异常的生理调节,由于靶腺负反馈调节的丧失或丘脑下部异常的正向调节,导致过度刺激增生,分化的、激素表达的垂体细胞谱系引起腺瘤发生,常伴有自发的激素超量分泌。不同的激素过量分泌取决于细胞起源。应答性下丘脑激素和旁分泌增殖信号导致垂体细胞周期失调,伴有非整倍性、染色体拷贝数变异和抑制恶性转化的细胞性衰老,癌基因激活或抑癌基因丧失[9]。垂体瘤的治疗以外科手术为主,由于肿瘤侵袭结构复杂,存在手术全切困难、全切率低,且有手术禁忌证、并发症、术后复发等局限性。药物作为重要的辅助治疗手段,可减少激素的异常分泌,降低激素高分泌水平状态,缓解内分泌症状,减小肿瘤体积甚至消除肿瘤,从而延缓肿瘤复发。
芍药苷是一种蒎烷单萜糖苷,具有多种生物学效应且毒副作用小[10]。相关研究表明,芍药苷具有抗癌活性,包括乳腺癌、胰腺癌、结直肠癌、胃癌、神经胶质瘤等[11-15]。抗肿瘤的作用机制为抑制肿瘤细胞的增殖和新血管形成,诱导细胞凋亡及抑制肿瘤侵袭和转移[6]。目前,芍药苷治疗垂体瘤的研究报道较少。本研究通过探讨芍药苷对垂体瘤细胞增殖凋亡的影响及作用机制,为芍药苷相关药物的研发及垂体瘤的临床治疗提供理论依据。结果显示,不同浓度芍药苷对垂体瘤细胞的增殖有抑制作用,细胞存活率呈浓度依赖性。流式细胞分析实验结果表明芍药苷可诱导垂体瘤细胞凋亡。
STAT3是一种细胞质转录因子,可调节细胞增殖、分化、凋亡和免疫反应等,参与启动凋亡相关基因Bcl-2、Bax等表达[16]。细胞外配体与膜受体结合引起受体亚基多聚化,JAK2在受体的胞浆侧募集,发生磷酸化,p-JAK2可使STAT3通过SH2区域发生同源二聚化,促使STAT3磷酸化,活化的STAT3借助于核转运蛋白α转移到细胞核,进而与特异性核酸序列结合,调节靶基因转录。相关研究显示,50%以上的肿瘤包括实体肿瘤和血液学肿瘤(卵巢癌、前列腺癌、肺癌、白血病、淋巴瘤等)的发生与STAT3信号通路激活有关[17-18]。Zheng等[14]研究表明,芍药苷通过抑制STAT3信号通路,抑制人胃癌细胞增殖。Nie等[15]研究表明,芍药苷通过抑制STAT3通路,降低下游与细胞增殖和抗凋亡相关基因Bcl-2表达,从而诱导神经胶质瘤细胞的生长抑制和凋亡。本研究取对数期垂体瘤细胞,经芍药苷、STAT3通路激动剂及芍药苷+激动剂处理后检测JAK2、STAT3、Bcl-2和Bax mRNA、蛋白表达及p-JAK2、p-STAT3水平。结果显示:芍药苷可下调垂体瘤细胞p-JAK2、p-STAT3、Bcl-2转录和表达,上调Bax转录和表达,抑制p-JAK2、p-STAT3激活,STAT3通路激动剂(Olanzapine)呈相反的作用效果,激动剂和芍药苷处理后,激动剂对相关基因转录和蛋白表达的促进或抑制作用被逆转,提示芍药苷通过调控STAT3信号通路抑制垂体瘤细胞增殖,促进其凋亡。
综上所述,芍药苷可抑制垂体瘤细胞增殖,诱导凋亡,其机制可能是通过抑制STAT3信号通路相关分子mRNA和蛋白表达,调控细胞增殖凋亡相关基因的表达,发挥抗肿瘤作用。本研究为芍药苷相关药物的研发及其应用于垂体瘤的临床治疗提供实验支持。
