外周血淋巴细胞及HIF⁃1α对CA患者光动力疗效的评估价值
2022-09-03姚涌晖王发武沈源基汪勤
姚涌晖 王发武 沈源基 汪勤
尖锐湿疣是一种常见的性传播疾病,主要由人乳头瘤病毒(human papilloma virus,HPV)感染肛门、会阴等生殖部位引起。由于与感染HPV 的人进行无保护的性接触,传播风险高达75%,使性活跃个体罹患终生尖锐湿疣的风险增加50%[1]。尖锐湿疣的传播能力强、复发率高,对患者身心健康及生活质量造成严重影响[2]。5⁃氨基酮戊酸光动力疗法(5⁃aminolevulinic acid⁃photodynamic ther⁃apy,ALA⁃PDT)是目前治疗尖锐湿疣的重要方式之一,其能直接去除疣体,有效清除HPV 亚临床性感染和潜伏病灶,避免尖锐湿疣的复发。近年来临床研究发现[3⁃4],机体免疫功能、细胞增殖与血管增生在尖锐湿疣的发生、发展和复发中起重要作用。外周血炎症指标淋巴细胞比值、缺氧诱导因子⁃1α(hypoxia inducible factor⁃1,HIF⁃1α)与尖锐湿疣ALA⁃PDT 治疗效果关系密切[5]。但关于如何尽快区分疗效显著与疗效不佳者的研究较为少见,因此本文旨在探讨外周血淋巴细胞及白细胞介素对尖锐湿疣患者光动力疗效的评估价值,现报道如下。
1 对象与方法
1.1 研究对象
选取2019年5月至2021年8月南京市浦口区中医院皮肤科收治的尖锐湿疣患者102 例为研究对象,采用ALA⁃PDT 对所有患者进行治疗,3 个月后根据患者治疗效果分为有效组(n=70)与无效组(n=32)。纳入标准:①符合《尖锐湿疣临床诊疗与防治指南》[6]尖锐湿疣的诊断标准并经临床病理学检查确诊;②首发尖锐湿疣;③皮损均原发于会阴部皮肤;④患者知情并签署同意书。排除标准:①合并其他自身免疫性疾病或其他性病;②患有神经系统疾病,如意识障碍、帕金森等,无法配合研究;③近一个月内接受过局部或全身治疗;④合并皮肤光过敏症、卟啉症;⑤妊娠期或哺乳期女性;⑥疣体位于阴道内、子宫颈或肛门内。两组一般资料比较,差异无统计学意义(P>0.05),见表1。本研究经南京市浦口区中医院医学伦理会审批并通过。
表1 两组一般资料比较[(±s),n(%)]Table 1 Comparison of general data between two groups[(±s),n(%)]

表1 两组一般资料比较[(±s),n(%)]Table 1 Comparison of general data between two groups[(±s),n(%)]
因素年龄(岁)性别t/χ2/Z 值0.720 0.049 P 值0.473 0.826病程(月)皮损部位男女 阴茎1.423 0.750 0.158 0.453肛周阴唇其他疣体数量单发多发(>1)有效组(n=70)64.52±5.17 41(58.57)29(41.43)2.43±0.85 18(25.71)23(32.86)20(28.57)9(12.86)31(44.29)39(55.71)无效组(n=32)63.74±4.87 18(56.25)14(44.75)2.68±0.76 8(25.00)7(21.88)10(31.25)7(21.88)15(46.87)17(53.13)0.060 0.807
1.2 方法
1.2.1 检测方法
分别于患者入院次日及3 次治疗结束后清晨采集所有患者空腹静脉血10 mL,注入含有抗凝剂的试管中混匀后于室温静置30 min,3 000 r/min 离心10 min(离心半径10 cm)后取上层血清,保存于-20℃冰箱中待测。采用FACSCalibur 流式细胞仪(美国BD 公司)检测所有患者外周血CD4+、CD8+淋巴细胞亚群的百分比。采用酶联免疫吸附实验使用ELISA 试剂盒(上海劲马实验设备有限公司)测定血清HIF⁃1α 水平。
1.2.2 治疗方法
对患者皮损部位进行常规消毒清洁后,采用温敏凝胶稀释ALA 粉末配制成20% ALA 新鲜溶液,用灭菌棉片沾满药液后均匀涂于皮损及其周围2 cm 范围,纱布、塑料薄膜封包,并用胶布固定。3 h 后用波长为635 nm 的ALA⁃PDT 激光治疗仪照射皮损部位30 min,根据患者耐受情况选择能接受的最大输出功率,标准为150 mW,根据光斑大小及照射时间计算激光照射总能量,使其达(60~100)J/cm2。治疗每周一次,共3 次。
1.2.3 疗效判定方法
治疗结束后对患者随访3 个月,观察并记录患者治疗效果及复发情况。疗效判定标准[7]:完全清除:患者疣体清除率为100%且未复发;部分清除:疣体清除率50%~99%但未复发:清除效果欠佳:疣体清除率<50%且短期内复发。将完全清除及部分清除患者共70 例纳入有效组,清除效果欠佳患者共32 例纳入无效组。
1.3 统计学方法
采用SPSS Statistics 21 统计学软件进行分析。计量资料以()表示,采用t检验;计数资料以n(%)表示,采用χ2检验,等级资料采用秩和检验。采用ROC 曲线分析各指标诊断价值,曲线下面积值(AUC)的比较采用非参数检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组治疗前后外周血CD4+、CD8+、NK 比值和HIF⁃1α 水平比较
有效组治疗前后外周血CD4+、NK 细胞比值均高于无效组,外周血CD8+细胞比值和HIF⁃1α水平均低于无效组,差异有统计学意义(P<0.05)。见表2。
表2 两组治疗前后外周血CD4+、CD8+、NK 比值和HIF⁃1α 水平比较(±s)Table 2 Comparison of peripheral blood CD4+,CD8+,NK ratio andHIF⁃1α levels before and after treatment between the two groups(±s)
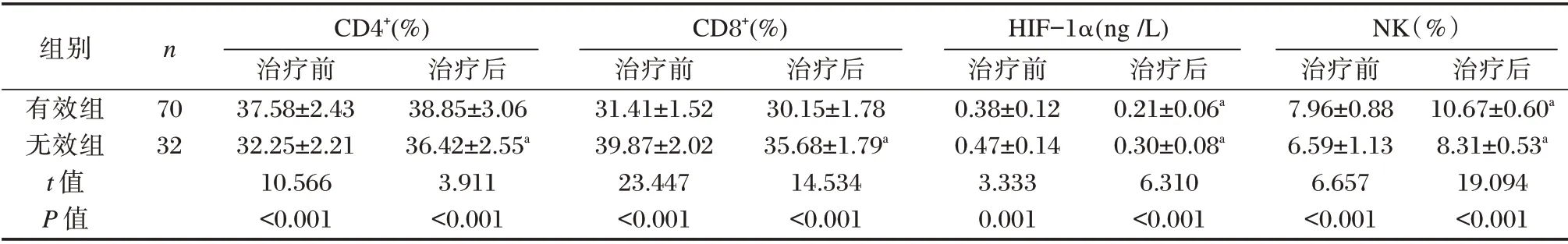
表2 两组治疗前后外周血CD4+、CD8+、NK 比值和HIF⁃1α 水平比较(±s)Table 2 Comparison of peripheral blood CD4+,CD8+,NK ratio andHIF⁃1α levels before and after treatment between the two groups(±s)
注:与同组治疗前比较,aP<0.05。
组别有效组无效组t 值P 值n 70 32 CD4+(%)治疗前37.58±2.43 32.25±2.21 10.566<0.001治疗后38.85±3.06 36.42±2.55a 3.911<0.001 CD8+(%)治疗前31.41±1.52 39.87±2.02 23.447<0.001治疗后30.15±1.78 35.68±1.79a 14.534<0.001 HIF-1α(ng /L)治疗前0.38±0.12 0.47±0.14 3.333 0.001治疗后0.21±0.06a 0.30±0.08a 6.310<0.001 NK(%)治疗前7.96±0.88 6.59±1.13 6.657<0.001治疗后10.67±0.60a 8.31±0.53a 19.094<0.001
2.2 ALA⁃PDT 疗效的多因素分析
多因素Logistic 回归分析显示,CD4+(β=0.513,OR=1.670)、CD8+(β=0.306,OR=1.358)、HIF⁃1α(β=0.894,OR=2.445)是ALA⁃PDT 疗效的独立影响因素(P<0.05)。见表3。
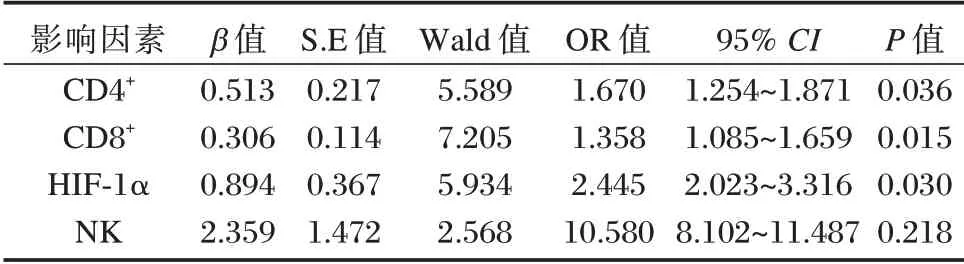
表3 ALA⁃PDT 疗效的多因素Logistic 回归分析Table 3 Multivariate Logistic Regression Analysis of ALA⁃PDT Efficacy
2.3 外周血CD4+、CD8+和HIF⁃1α 水平对ALA⁃PDT 疗效的评估价值
ROC 曲线显示,外周血CD4+、CD8+和HIF⁃1α三者联合检测时,预测ALA⁃PDT 疗效为有效的AUC 为0.907,敏感性、特异性分别为0.938、0.833,优于单一检测(P<0.05)。见表4、图1。

图1 ROC 曲线图Figure 1 ROC curve
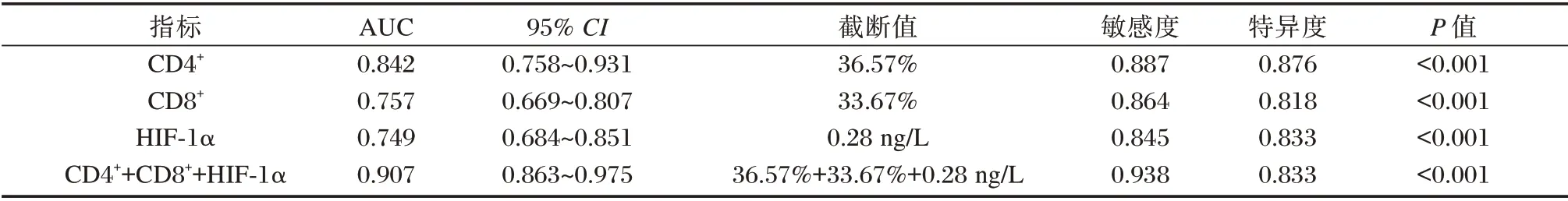
表4 外周血CD4+、CD8+和HIF⁃1α 水平对ALA⁃PDT 疗效的评估价值Table 4 The evaluation value of peripheral blood CD4+,CD8+and HIF⁃1α levels on the efficacy of ALA⁃PDT
3 讨论
尖锐湿疣是由HPV 感染等因素引起的性传播疾病,感染早期无明显症状,发病后3~6 个月可观察到明显的皮损征象。尖锐湿疣通常以扁平、花椰菜或带蒂等形式附着于肛门生殖器或口腔区域的湿润粘膜上,也可单独发展为孤立的角化性丘疹或斑块。其并发症包括瘙痒、灼热、接触衣物或性交时出血、排尿或排便困难等。该病治疗方式包括物理治疗(激光、微波、电离)和细胞毒药物等,但难以清除HPV 亚临床感染病灶,6 个月复发率高达69%[8]。ALA⁃PDT 目前广泛用于尖锐湿疣的治疗,5⁃氨基乙酰丙酸(5⁃aminolevulinic acid,5⁃ALA)局部应用于病灶区域,可选择性吸收病灶区域的过度增殖细胞,在体内将5⁃ALA 转化为具有强光敏性的原卟啉IX,在特定波长的光照射后,产生大量单线态氧和自由基,导致病灶区细胞凋亡、坏死,而对周围正常组织和细胞无损伤[9⁃10]。
临床研究表明[11],免疫功能低下是导致患者再次感染HPV 的关键,T 淋巴细胞和炎症因子可以直接反映机体的免疫功能状况。T 淋巴细胞是一类主要参与自身免疫性疾病的免疫细胞,在维持机体免疫稳态、调节免疫应答、抗细菌和病毒感染等方面发挥重要作用。Du 等[12]发现,与健康人群相比,尖锐湿疣患者外周血CD4+和CD4+/CD8+明显减少,而CD8+显著增加,表明尖锐湿疣患者T淋巴细胞亚群紊乱。本研究发现,有效组治疗前后外周血CD4+、NK 细胞比值均高于无效组,有效组治疗前后外周血CD8+细胞比值均低于无效组,这可能是因为无效组患者病损局部免疫功能受到抑制,CD8+细胞抗病毒能力受到明显抑制,CD4+细胞数量减少,不能抑制HPV 的生长,患者T 淋巴细胞的免疫水平受到明显抑制,T 淋巴细胞亚群失衡,即使通过ALA⁃PDT 治疗将疣体有效清除,但是未能及时调节患者的免疫功能,导致复发。此外,人体内NK 细胞具有识别正常和异常组织细胞的能力,在体内具有重要的免疫监视功能,NK 细胞活性下降可导致体内清除瘤细胞和清除病毒等免疫复合物的能力下降。而无效组患者外周血NK 细胞数量明显少于有效组,则尖锐湿疣损害越多。因此,治疗前免疫功能失调的尖锐湿疣患者的疗效不佳。宣晓梅等[13]也指出,尖锐湿疣患者在接受治疗前的细胞免疫水平与疾病复发之间存在密切联系,与本研究结果部分相符。国外研究显示[14],ALA⁃PDT 能靶向富集于所有HPV 感染组织,并在细胞内转化为具有光敏活性的原卟啉Ⅸ,在红光激发下发生光化学反应,引起感染细胞的坏死或凋亡。尖锐湿疣疣体具有快速增长、血运丰富的缺氧肿瘤性生长的特性,而HIF⁃1α 作为对缺氧反应的关键调节因子,与细胞增殖和血管增生关系密切。HIF⁃1α 活性的下调可能会对其靶基因产生影响,抑制肿瘤生长并维持侵略性表型。本研究中有效组治疗前后HIF⁃1α 水平均低于无效组,与刘广悦等[15]的研究结果部分一致。本研究将外周血CD4+、CD8+和HIF⁃1α 三者联合检测时,预测ALA⁃PDT 疗效为有效的AUC 为0.907,可见动态观察外周血CD4+、CD8+淋巴细胞比值、HIF⁃1α 水平变化,有利于临床医师尽早发现疗效不佳患者。
综上所述,通过检测尖锐湿疣患者治疗前的外周血CD4+、CD8+淋巴细胞比值、HIF⁃1α 水平并监测治疗过程中的动态变化,可预测ALA⁃PDT 治疗的近期疗效,为尽早发现治疗疗效不佳患者提供了一定指导意义。
