血清Galectin⁃9和PD⁃L1对慢性乙型肝炎肝脏炎症程度的诊断价值
2022-09-03贾梦山刘加敏杨艳霞
贾梦山 刘加敏 杨艳霞
慢性乙型肝炎(Chronic hepatitis B,CHB)是乙型肝炎病毒(HBV)感染引起的世界性传染病。我国是CHB 高发国家,据统计,我国每年死于CHB相关肝硬化、肝癌等疾病的人高达100 多万[1⁃2]。目前,评价肝脏病理状态仍是CHB 基础与临床研究的热点问题。肝脏炎症是CHB 发展至肝硬化、肝癌的病理基础[3]。因此,早期诊断CHB 肝脏炎症程度具有重要临床意义。CHB 病机主要是免疫反应介导的肝损伤,机体免疫水平与病情进展及预后密切相关[4]。半乳糖凝集素⁃9(Galectin⁃9)是T 细胞免疫球蛋白域粘蛋白域蛋白⁃3(Tim⁃3)配体,研究表明,Tim⁃3/Galectin⁃9 信号通路活化可抑制T 细胞活化及Th1 免疫[5]。相关研究已证实,Galectin⁃9 在多种自身免疫性疾病、炎性疾病、肿瘤等发生及进展过程中起到重要作用[6]。程序性死亡受体⁃配体1(Programmed death ligand⁃1,PD⁃L1)是程序性死亡受体⁃1(PD⁃1)主要配体,可负向调节免疫应答,近年来,其在CHB 患者免疫调节中的作用日益受到重视[7]。目前,关于血清Galectin⁃9、PD⁃L1 对CHB 肝脏炎症程度的诊断价值,临床研究较少。本研究对此展开探讨,旨在为临床提供数据支持。报道如下。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年7月周口市疾控中心专科病医院CHB 患者126 例为观察组,同期选取45 名健康体检者为对照组。观察组纳入标准:均符合《慢性乙型肝炎防治指南(2019年版)》[8]中CHB 诊断标准;患者及家属知情同意。对照组纳入标准:病毒性肝炎抗体、肝肾功能、血常规、腹部彩超、肿瘤系列等体检均正常;入试者均知情同意。排除标准:曾接受干扰素⁃α 类、核苷(酸)类等药物治疗;其他病毒性肝炎;自身免疫性肝病;失代偿期肝硬化;恶性肿瘤;凝血功能障碍;妊娠或哺乳期女性。本研究经本院医学伦理委员会批准。
1.2 方法
1.2.1 临床特征收集
包括年龄、性别、肝功能指标、HBV⁃DNA、肝脏炎症分级、纤维化分期[9]等。HBV⁃DNA 及肝功能指标[谷丙转氨酶(Aspar⁃tate transaminase,AST)、谷草转氨酶(Alanine aminotransferase,ALT)、总胆红素(Total bilirubin,TBil)、凝血酶原时间(Pro⁃thrombin time,PT)、白蛋白(Albumin,Alb)]采用罗氏全自动生化分析仪检测;炎症活动度分级(G)为0~4 级,轻度肝脏炎症(G0+G1),显著肝脏炎症(G2+G3+G4);肝纤维化分期(S)为0~4 期,轻度肝纤维化(S0+S1),显著肝纤维化(S2+S3+S4)。观察组HBV⁃DNA 为(8.27±1.09)×103拷贝/mL;炎症分级:G0=23 例,G1=47 例,G2=34 例,G3=18 例,G4=4例;纤维化分期:S0=47 例,S1=40 例,S2=32 例,S3=5 例,S4=2 例。
1.2.2 血清Galectin⁃9、PD⁃L1 检测
采集空腹肘静脉血3 mL,离心(时间15 min,半径8 cm,转速3 500 r/min),取血清,采用酶联免疫吸附试验测定Galectin⁃9,上海纪宁生物制剂公司试剂盒;采用流式细胞仪检测PD⁃L1。
1.3 统计学处理
采用统计学软件SPSS 22.0 处理数据,计量资料以()描述,t检验;计数资料用n(%)表示,χ2检验;影响因素采用Logistic 回归分析;采用Spearman、Pearson 分析相关性;诊断价值采用受试者工作特征(ROC)曲线,获取AUC、置信区间、敏感度、特异度,联合预测实施Logistic 二元回归拟合,返回预测概率logit(p),将其作为独立检验变量。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床特征及血清Galectin⁃9、PD⁃L1 水平
两组年龄、性别、肝功能指标(AST、ALT、TBil、PT、Alb)比较,差异无统计学意义(P>0.05);观察组血清Galectin⁃9、PD⁃L1 水平高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组临床特征及血清Galectin⁃9、PD⁃L1 水平[n(%),(±s)]Table 1 Clinical characteristics and serum levels of Galectin⁃9 and PD⁃L1 in the two groups[n(%),(±s)]

表1 两组临床特征及血清Galectin⁃9、PD⁃L1 水平[n(%),(±s)]Table 1 Clinical characteristics and serum levels of Galectin⁃9 and PD⁃L1 in the two groups[n(%),(±s)]
指标观察组(n=126)对照组(n=45)t/χ2值P 值年龄≥40 岁<40 岁性别58(46.03)68(53.97)21(46.67)24(53.33)0.005 0.942男女0.058 0.809肝功能指标AST(U/L)ALT(U/L)TBil(μmol/L)PT(s)Alb(g/L)HBV⁃DNA(×103拷贝/mL)Galectin⁃9(ng/mL)PD⁃L1(%)73(57.94)53(42.06)33.31±7.25 32.58±8.96 16.94±5.06 12.84±1.36 40.61±3.87 8.27±1.09 1.92±0.55 1.52±0.34 27(60.00)18(40.00)32.79±6.84 31.55±8.43 16.31±4.28 12.62±1.13 41.15±4.16 0.419 0.672 0.745 0.972 0.788 0.676 0.503 0.457 0.333 0.432 0.33±0.15 0.38±0.17 19.108 21.523<0.001<0.001
2.2 CHB 患者血清Galectin⁃9、PD⁃L1 水平与主要临床特征相关性
CHB 患者血清Galectin⁃9、PD⁃L1 水平与HBV⁃DNA、炎症分级、纤维化分期均呈正相关(P<0.05)。见表2。

表2 CHB 患者血清Galectin⁃9、PD⁃L1 水平与主要临床特征相关性Table 2 Correlations between serum Galectin⁃9 and PD⁃L1 levels and main clinical characteristics in CHB patients
2.3 CHB 患者显著肝脏炎症单因素分析
126 例CHB 患者中,轻度肝脏炎症(G0+G1)69 例,显著肝脏炎症(G2+G3+G4)57 例。HBV⁃DNA、Galectin⁃9、PD⁃L1 均为CHB 患者显著肝脏炎症相关因素(P<0.05)。见表3。
2.4 CHB 患者显著肝脏炎症多因素Logistic 回归分析
以CHB 患者肝脏炎症程度为因变量(赋值:轻度肝脏炎症=1,显著肝脏炎症=2),将表3中差异有统计学意义的项作为自变量(赋值:实际值),应用Logistic 回归模型分析,结果显示,HBV⁃DNA 及血清Galectin⁃9、PD⁃L1 水平升高均为CHB 患者显著肝脏炎症独立危险因素(P<0.05)。见表4。
表3 CHB 患者显著肝脏炎症单因素分析[n(%),)(±s)]Table 3 Univariate analysis of significant liver inflammation in CHB patients[n(%),)(±s)]
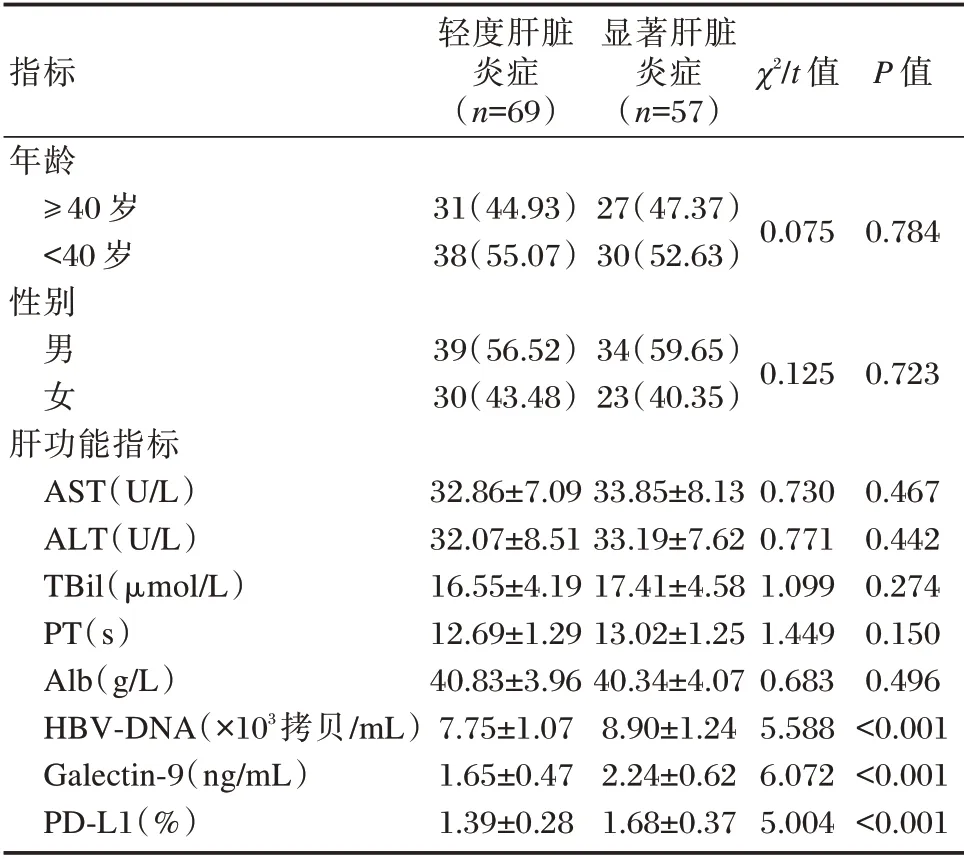
表3 CHB 患者显著肝脏炎症单因素分析[n(%),)(±s)]Table 3 Univariate analysis of significant liver inflammation in CHB patients[n(%),)(±s)]
指标年龄≥40 岁<40 岁性别轻度肝脏炎症(n=69)显著肝脏炎症(n=57)χ2/t 值P 值31(44.93)38(55.07)27(47.37)30(52.63)0.075 0.784男女39(56.52)30(43.48)34(59.65)23(40.35)0.125 0.723肝功能指标AST(U/L)ALT(U/L)TBil(μmol/L)PT(s)Alb(g/L)HBV⁃DNA(×103拷贝/mL)Galectin⁃9(ng/mL)PD⁃L1(%)32.86±7.09 32.07±8.51 16.55±4.19 12.69±1.29 40.83±3.96 7.75±1.07 1.65±0.47 1.39±0.28 33.85±8.13 33.19±7.62 17.41±4.58 13.02±1.25 40.34±4.07 8.90±1.24 2.24±0.62 1.68±0.37 0.730 0.771 1.099 1.449 0.683 5.588 6.072 5.004 0.467 0.442 0.274 0.150 0.496<0.001<0.001<0.001

表4 CHB 患者显著肝脏炎症多因素Logistic 回归分析Table 4 Multivariate Logistic regression analysis of significant liver inflammation in CHB patients
2.4 血清Galectin⁃9、PD⁃L1 对CHB 患者肝脏炎症程度的诊断价值
以显著肝脏炎症患者血清Galectin⁃9、PD⁃L1 水平为阳性样本,以轻度肝脏炎症患者血清Galectin⁃9、PD⁃L1 水平为阴性样本,绘制各指标诊断肝脏炎症程度的ROC 曲线,结果显示,Galectin⁃9、PD⁃L1 估于 单⁃诊断联合诊断AUC 最大,为0.850。见表5、图1。
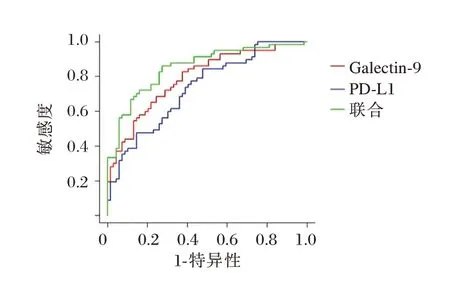
图1 血清Galectin⁃9、PD⁃L1诊断肝脏炎症程度的ROC曲线Figure 1 ROC curve of serum Galectin⁃9 and PD⁃L1 in the diagnosis of liver inflammation
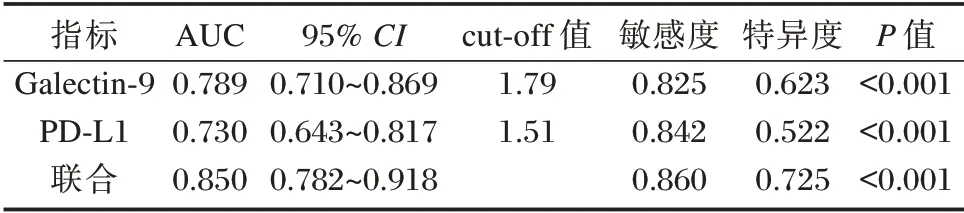
表5 血清Galectin⁃9、PD⁃L1 对肝脏炎症程度的诊断价值Table 5 The diagnostic value of serum Galectin⁃9 and PD⁃L1 on the degree of liver inflammation
3 讨论
CHB 具有发病率高、传染性强、难治愈等特点,病理改变主要为肝组织炎症坏死,活动性慢性炎症是导致CHB 肝纤维化、肝硬化,甚至肝癌的重要因素[10]。因此,早期评价显著肝脏炎症,及时采取个体化治疗,对抑制CHB 疾病进展,改善患者预后具有重要价值。但目前,临床仍缺乏可快速、有效评价肝脏炎症进展程度的手段,成为亟待解决的难题。
Galectin⁃9 属半乳凝素家族成员,是Tim⁃3 配体,作为新型酸性粒细胞驱化物,具有诱导T 细胞凋亡、促进酸性粒细胞趋化等多种生物学功能,参与自身免疫性疾病、急性炎性反应、过敏等的发生发展过程[11]。本研究显示,CHB 患者血清Galectin⁃9呈异常高表达,且CHB 患者血清Galectin⁃9 水平与HBV⁃DNA、炎症分级、纤维化分期均呈正相关,与相关研究[12]一致,提示Galectin⁃9 可能参与CHB 发生及病情进展。HBV 感染的慢性化与机体固有免疫及适应性免疫损伤密切相关,尤其T 细胞功能耗竭[13]。耗竭的T 细胞毒性杀伤、分泌效应因子及增殖能力降低,无法有效清除HBV,同时,过表达一些抑制性表面分子,如Tim⁃3、PD⁃L1 等,Tim⁃3 通过结合配体Galectin⁃9,诱导T 细胞功能耗竭[14]。多项研究表明,作为凝集素家族重要成员之一,Galectin⁃9 是病毒感染过程中发挥关键作用的免疫调控分子,发挥多种生物效应,如调控细胞黏附、影响树突状细胞成熟及Treg 细胞分化、抗病原微生物等[15]。HBV 感染后,肝内分泌大量干扰素(IFN)⁃β、IFN⁃γ,诱导Galectin⁃9 大量表达,与Tim⁃3结合后,使CD8+T 细胞增殖及分泌细胞因子的能力显著降低,进而促进病情进展[16]。Logistic 回归模型分析显示,血清Galectin⁃9 水平升高均为CHB患者显著肝脏炎症独立危险因素,进一步证实应用Galectin⁃9 有助于监测CHB 疾病进展。
CHB 免疫学机制一直是临床研究重点,患者一旦出现特异性T 细胞功能减退,就无法清除病毒,引起HBV 慢性化[17]。多项研究表明,PD⁃1/PD⁃L1信号通路可降低T 细胞表面受体传导的抗原信号,起到负性调节作用,可能在降低机体免疫清除HBV 能力方面起重要作用[18]。本研究结果也提示PD⁃L1 参与CHB 发生及发展。PD⁃L1 是PD⁃1 主要配体,属B7 家族成员,可负向调节免疫应答,这点不同于其他B7 家族分子。生理状况下,T 细胞、单核细胞、B 细胞PD⁃L1 表达处于较低水平,而HBV 感染后,淋巴细胞活化,PD⁃L1 表达增加(尤其T 细胞),肿瘤坏死因子⁃α(IFN⁃α)、粒细胞⁃巨噬细胞集落刺激因子(GM⁃CSF)、白介素⁃4(IL⁃4)等多种因子均可引起淋巴细胞表达PD⁃L1 增加[19]。另外,相较于PD⁃1 表达,PD⁃Ll 更加广泛,可在T 细胞、巨噬细胞、树突状细胞、B 细胞、肝细胞、多种间质细胞等表面表达,在多种组织上调节免疫应答[20]。另ROC 曲线显示,血清Galectin⁃9、PD⁃L1 在肝脏炎症程度的诊断方面均具有一定价值,且二者联合诊断的AUC 达0.850,可为CHB 患者肝脏炎症程度诊断提供更准确数据参考。Galectin⁃9、PD⁃L1 参与CHB 患者免疫调节的作用机制不同,二者联合可更全面反映病变情况,从而为显著肝脏炎症评价提供更全面信息。
综上可知,CHB 患者血清Galectin⁃9、PD⁃L1 异常高表达,且可较准确地诊断肝脏炎症程度,利于监测CHB 疾病进展。但调节Galectin⁃9、PD⁃L1 相关通路可否改善CHB 患者免疫状态,达到抑制病情进展的目的,尚待进一步研究。
