姜黄素介导光动力处理牡蛎的安全性评价
2022-09-02智锦锦王志广吴双杰李兆杰薛长湖唐庆娟
智锦锦,王志广,吴双杰,李兆杰,薛长湖,唐庆娟
(中国海洋大学食品科学与工程学院,山东青岛 266003)
牡蛎是一种双壳软体贝类,产量高居贝类之首[1,2],其营养丰富,肉质鲜美[3],深受消费者青睐。牡蛎具有滤食性摄食特性,能够富集环境中大量微生物和其他有害污染物[4]。作为水产品,牡蛎蛋白质丰富,含水量较大[3],加之体内容易滤食大量微生物等特点, 使其在储运过程中极易发生品质劣化,导致卫生质量降低、货架期较短等问题,给消费者的健康带来巨大隐患[5-7]。随着生鲜牡蛎的普及与人们安全意识的提升,生食牡蛎的安全问题愈发成为大众关注的焦点。因此目前迫切需要开发一种新型应用技术,在不影响外观与营养品质的基础上保证牡蛎的食用安全性。
光敏剂介导的光动力灭菌技术(photodynamic sterilization technology,PDST),以下简称光动力,是一种新型非热力杀菌技术,通过光敏剂在特定波长光的激活下生成活性氧物质,其具有的强氧化作用可以灭活各种微生物[8]。姜黄素属于国标认可的一种安全无毒的食品添加剂[9],可作为新型光敏剂,在波长420 nm的可见光下具有强烈的吸收峰,光敏性好,广泛应用于杀菌、治疗皮肤病和抗肿瘤中[10-12]。现有报道表明,姜黄素介导的光动力技术可以在不影响牡蛎营养品质的同时,有效杀灭其中的微生物[13-15],延缓品质劣化和延长货架期[16-18]。为将该技术在贝类加工中推广应用,需要对光动力处理的牡蛎进行安全性评价。
现有研究证实,单纯的姜黄素属于实际无毒化合物,未见潜在的遗传毒性作用和致突变性,无明显亚慢性毒性[19-21],且其主要光降解产物香草醛和阿魏酸也不存在毒性作用[22]。本课题组前期从细胞水平初步证实光敏化姜黄素和光动力处理后的牡蛎,在实验条件下不具有明显毒性作用[23,24]。然而,考虑到体外与体内实验的差异,仍需要对光动力处理牡蛎的食用安全性进行进一步探究。因此,本文将通过构建大鼠和小鼠安全评价模型,开展急性经口毒性试验和28 d经口毒性试验评价光动力处理牡蛎的食用安全性,以期为姜黄素介导的光动力技术在贝类加工中的实际应用提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂
鲜活太平洋牡蛎(Crassostrea gigas),质量为130±10 g,青岛市市南区金海利达水产营业部;姜黄素(食品级添加剂,纯度>95%),陕西慈缘生物技术有限公司;食品级乙醇(纯度95%),济宁高科工业水处理化工有限公司;海水素,广州益尔生物技术有限公司;葡萄糖试剂盒、白蛋白试剂盒、总胆固醇试剂盒、谷丙转氨酶试剂盒、谷草转氨酶试剂盒、甘油三酯试剂盒、肌酐试剂盒、尿酸试剂盒和尿素氮试剂盒,南京建成生物工程研究所;BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;AIN93G标准饲料,南通特洛菲饲料科技有限公司;普通棒状饲料,青岛大任富城畜牧有限公司。
1.1.2 实验动物
SPF级健康KM小鼠(4周龄,18~22 g)、SPF级健康SD大鼠(4周龄,60~80 g),供应商为北京维通利华动物技术有限公司,动物许可证号SCXK(京)2016-0011。所有动物实验均得到中国海洋大学食品科学与工程学院动物伦理委员会批准,动物饲养环境温度23±2 ℃、相对湿度为50%±10%、光照/黑暗周期为12 h。
1.1.3 仪器与设备
BC-5000Vet全自动血细胞分析仪,迈瑞生物医疗电子股份有限公司;URIT-500B尿液分析仪,桂林优利特医疗电子有限公司;JL-420-590多功能LED光源仪,青岛建亮科技有限公司;NIKON/Ni-E电动荧光显微镜,日本尼康公司;SPARK 10M酶标仪,帝肯(上海)贸易有限公司;B E-9008微孔板恒温震荡器,上海坤诚科学仪器有限公司;CP224C电子天平,奥豪斯仪器(上海)有限公司;JYL-C022E九阳料理机,九阳股份有限公司;Neofuge 13R台式高速冷冻离心机,上海力申科学仪器有限公司。
1.2 实验方法
1.2.1 牡蛎样品的制备
选取大小均匀的鲜活牡蛎,洗净外壳后置于盐度为33 g/L的人工海水中暂养24 h,充分吐沙。将暂养后的牡蛎随机分为未光动力处理组(无姜黄素,无光照)和光动力处理组(姜黄素浓度10 µmol/L,有光照),放入人工海水中暂养3 h,贝水质量之比为1:5。将各组牡蛎开壳取肉,整个过程尽可能在洁净弱光条件下进行。将光动力组牡蛎于波长420 nm的LED蓝色光源下(光功率密度60 mW/cm2,光源距样品7.5 cm,光照强度1745 Lux)照射2 min,即光能量密度为7.2 J/cm2。之后,将各组牡蛎肉分别匀浆,真空冷冻干燥48 h。将冻干后的牡蛎置于研钵中研磨成粉末状(此干粉0.18 g相当于牡蛎湿重1 g),并过80目网筛,在避光环境下密封保存于干燥器备用。灌胃之前,将牡蛎干粉用蒸馏水配置成混悬液,现配现用。
1.2.2 小鼠急性经口毒性试验(限量法)[25]
将牡蛎干粉用蒸馏水配制成一定浓度的混悬液,以12号灌胃针头连接1 mL注射器筒抽取药液未见明显堵塞,且可顺畅通过针头为准,测得此时牡蛎干粉浓度为0.24 g/mL,设此浓度为最大给药浓度。
SPF级健康KM小鼠60只,经适应性喂养一周后,将雌雄小鼠各随机分为正常组(NC)、光动力组(PDT)和未光动力组(NP),每组20只,雌雄各半。为提高给药剂量,以小鼠最大灌胃体积、最大灌胃浓度进行实验。实验前禁食不禁水12 h后,NC组灌胃蒸馏水,PDT组灌胃光动力处理的牡蛎,NP组灌胃未光动力处理的牡蛎,每次灌胃10 mL/kg·bw,24 h内灌胃三次,每次间隔3 h,灌胃总体积为30 mL/kg·bw,总剂量为40 g/kg·bw。灌胃完成后禁食不禁水1 h后恢复饮食。实验期间使用标准棒状动物饲料饲养小鼠。首日三次灌胃后持续观察14 d,并记录实验过程中小鼠的临床状态、毒性反应及死亡情况。实验结束时,摘眼球采血,进行血常规检查。血常规检查指标包括白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白浓度(HGB)、血小板计数(PLT)、红细胞压积(HCT)、中性粒细胞百分比(Neu%)、淋巴细胞百分比(Lym%)、单核细胞百分比(Mon%)、嗜酸性粒细胞百分比(Eos%)、嗜碱性粒细胞百分比(Bas%)。取血后进行大体解剖检查,称量心、肝、脾和肾的绝对重量,运用式(1)计算脏器指数;同时进行HE染色,分析组织病理变化情况。
1.2.3 28 d经口毒性试验[26]
SPF级健康SD大鼠60只,经适应性喂养4 d后,将雌雄大鼠随机分为正常组(NC)、光动力组(PDT)、未光动力组(NP),每组20只,雌雄各半,分别灌胃蒸馏水、光动力处理的牡蛎、未光动力处理的牡蛎,灌胃剂量均为10 g/kg·bw,灌胃体积10 mL/kg·bw(此时牡蛎干粉浓度为0.18 g/mL),每天一次,连续灌胃28 d。实验期间各组大鼠食用普通棒状动物饲料,自由摄食与饮水,每天观察并记录大鼠的行为表现、饮食、中毒程度及死亡情况;每3 d称量一次大鼠体重和摄食量,并及时换算灌胃剂量。实验末期,对各组大鼠进行尿常规检查。实验结束时,眼眶采血、分离血清检测大鼠血清生化指标;腹主动脉取全血,测定血常规指标;取心、肝、脾、肾、睾丸和卵巢称重,计算脏器指数;进行病理学检查,观察脏器组织结构及细胞形态。
1.3 统计分析
实验数据均以(Mean±SEM)表示,运用GraphPad Prism 8.0软件作制图,SPSS 22.0软件统计分析。用单因素方差分析方法(One-Way ANOVA)分析,同时进行LSD组间比较。以p<0.05表示差异具有统计学意义。
2 结果与分析
2.1 急性经口毒性试验
2.1.1 小鼠一般临床状态和LD50
实验期间,各组小鼠行为表现、自主活动、饮水摄食、被毛、分泌物等均未见异常,无死亡或任何中毒反应症状出现。由表1可知,光动力处理牡蛎的LD50>40 g/kg bw,参照急性毒性分级表[25],属于实际无毒级别。
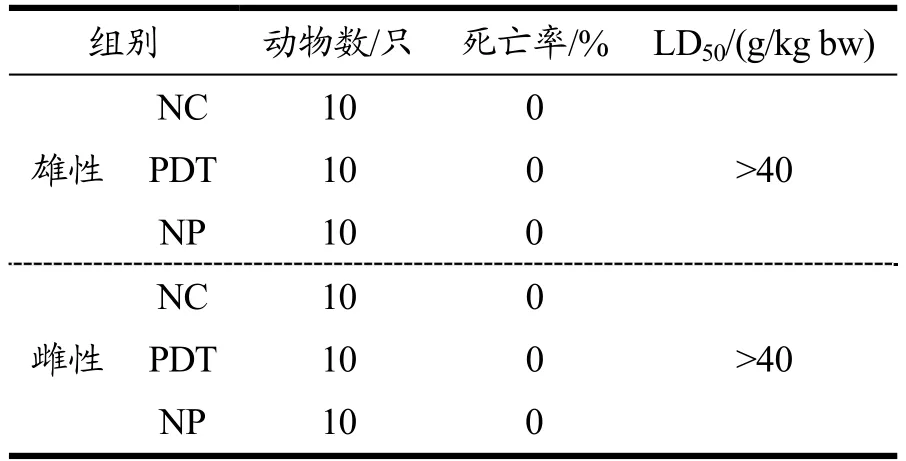
表1 光动力处理牡蛎对小鼠LD50的影响 Table 1 Effect of photodynamically treated oysters on LD50 of mice
2.1.2 对小鼠体重和食物利用率的影响
2.1.3 对小鼠血常规的影响
喂养期间,记录各组小鼠灌胃后14 d的摄食量及体重,计算食物利用率,计算方法如公式(4)。如表2所示,与NC组和NP组相比,PDT组雌、雄小鼠体重增量、摄食量以及食物利用率均不存在显著差异(p>0.05)。表明光动力处理牡蛎未对小鼠体重和摄食产生不良影响。
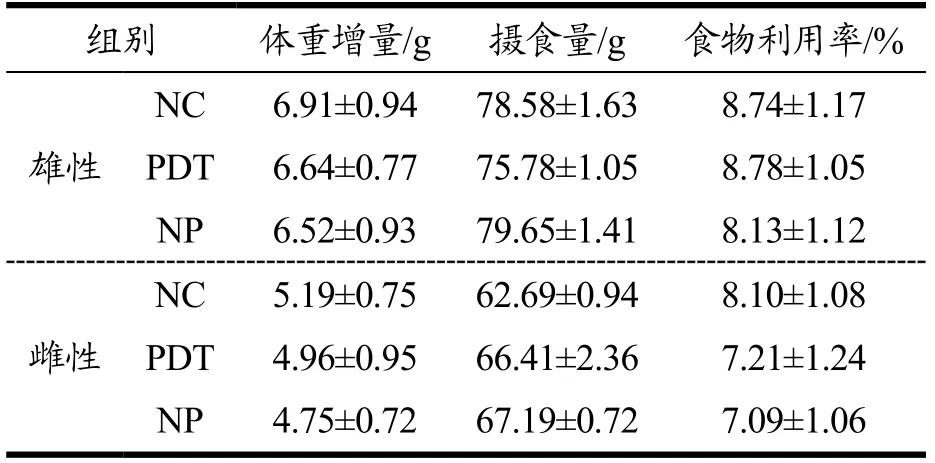
表2 光动力处理牡蛎对小鼠食物利用率的影响 Table 2 Effect of photodynamically treated oysters on food utilization rate in mice
血常规检测很多指标对机体内许多病理改变都有敏感反应,可反应一些血液学疾病和机体组织器官的病变情况,以评估受试物在动物体内的毒性[27]。小鼠血常规检测结果如表3所示。PDT组雄性小鼠中性粒细胞百分比(Neu%)与NC组相比显著增加,具有统计学意义(p<0.05),但与NP组相比差异无统计学意义(p>0.05),且其百分含量在正常参考范围内(6.5%~50%)。NP组雄性小鼠嗜酸性粒细胞百分比(Eos%)与NC组相比显著增加,具有统计学意义(p<0.05),但与PDT组相比没有统计学意义(p> 0.05),且其百分含量在正常参考范围内(0~7.5%)。结合其他检测指标综合分析认为,上述变化不具有毒理学意义。其余血常规各项指标,包括白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白浓度(HGB)、红细胞压积(HCT)、血小板计数(PLT)、淋巴细胞百分比(Lym%)、单核细胞百分比(Mon%)、嗜碱性粒细胞百分比(Bas%),各实验组之间都不具有显著性差异(p>0.05)。综上,光动力处理牡蛎对小鼠血常规各项指标未产生显著影响。
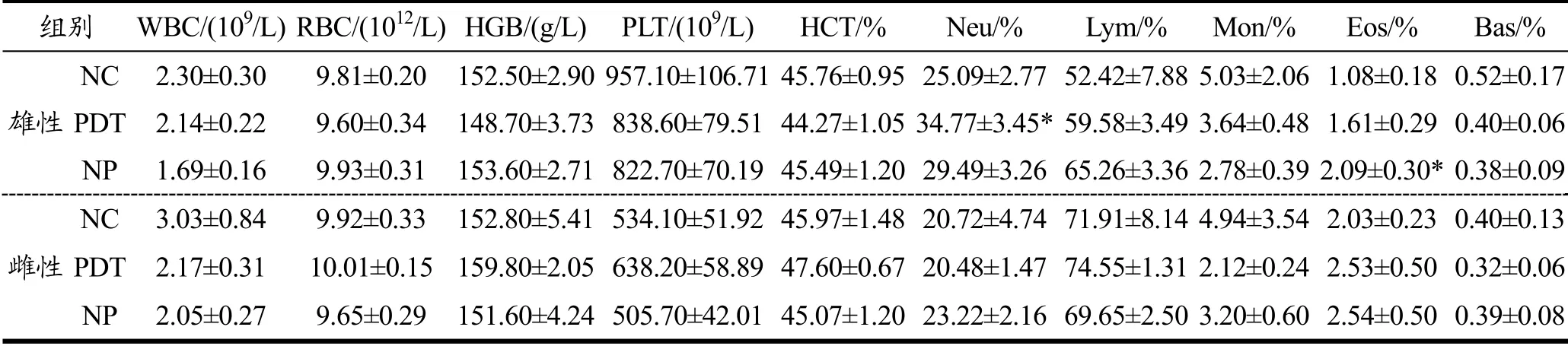
表3 光动力处理牡蛎对小鼠血常规的影响 Table 3 Effect of photodynamically treated oysters on hematological parameters in mice
2.1.4 对小鼠脏器指数的影响
脏器指数可在一定程度上体现各脏器的功能强弱和病变情况[28]。表4为各组小鼠的脏器指数。与NC组和NP组相比,PDT组小鼠的心脏、肝脏、脾脏和肾脏指数均无显著性差异(p>0.05),说明光动力处理牡蛎未对小鼠的主要脏器组织产生不良影响。

表4 光动力处理牡蛎对小鼠脏器指数的影响 Table 4 Effect of photodynamically treated oysters on organ index of mice
2.1.5 组织病理学检查
实验结束,先对各组小鼠进行大体解剖,检查心、肝、脾、胃、肠道以及生殖腺等组织器官的外形、颜色及大小,均未见异常改变。之后对各组小鼠的心、肝、脾、肾等主要器官进行组织病理学分析。由图1可见,NC组和NP组相比,PDT组小鼠的受检脏器均未观察到明显病理变化。
2.2 28 d经口毒性试验
2.2.1 对大鼠生长发育和食物利用率的影响
中毒症状、体重、摄食及饮水等临床表现可以反应动物的生长状态[29],能够表征受试物对大鼠的大体毒性效应。实验过程中,受试大鼠未见异常体征,无死亡或任何毒性反应症状出现;与NC组和NP组相比,大鼠摄食饮水、活动状况等临床指标均无显著差异。由图2可知,各组大鼠体重均呈稳步增长趋势,且雄鼠的体重增长速度明显大于雌鼠。同时,各组大鼠的食物利用率无显著性差异(p>0.05),见表5。以上结果表明大鼠的临床状态良好,光动力处理牡蛎对大鼠的生长发育和食物利用率未产生不良影响。
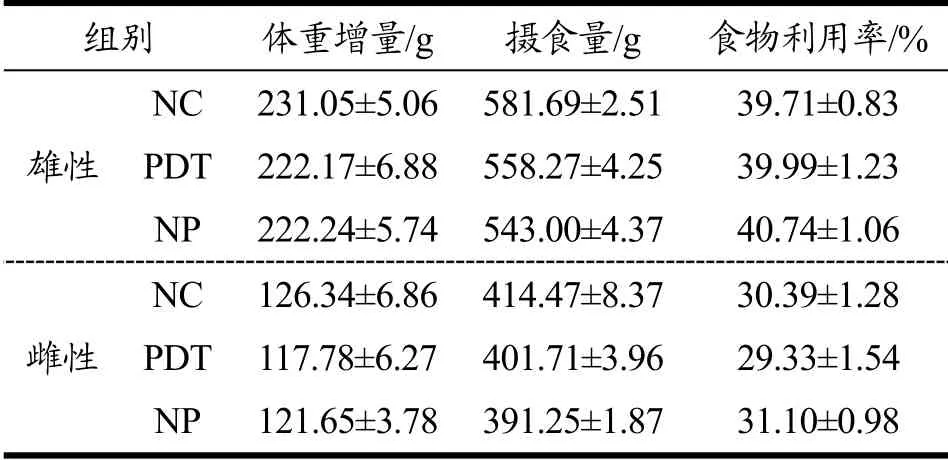
表5 光动力处理牡蛎对大鼠食物利用率的影响 Table 5 Effect of photodynamically treated oysters on food utilization rate in rats
2.2.2 对大鼠尿常规的影响
尿液可以反映机体代谢情况,尿常规检查能够了解受试动物肾脏代谢、机体酸碱平衡、营养等生理状况,作为肾脏和泌尿道疾病的征兆[30]。各组大鼠尿液外观呈澄清透明状,未见异常。由表6可知,与NC组和NP组相比,PDT组大鼠尿液相对密度(SG)、pH值、隐血(BLD)、尿蛋白(PRO)、白细胞(WBC)、葡萄糖(GLU)、亚硝酸盐(NIT)、尿胆原(URO)、胆红素(BIL)和维生素C(VC)指标均无显著性差异(p>0.05)。以上结果表明,光动力处理牡蛎对大鼠的泌尿系统和肾脏功能未造成不良影响。
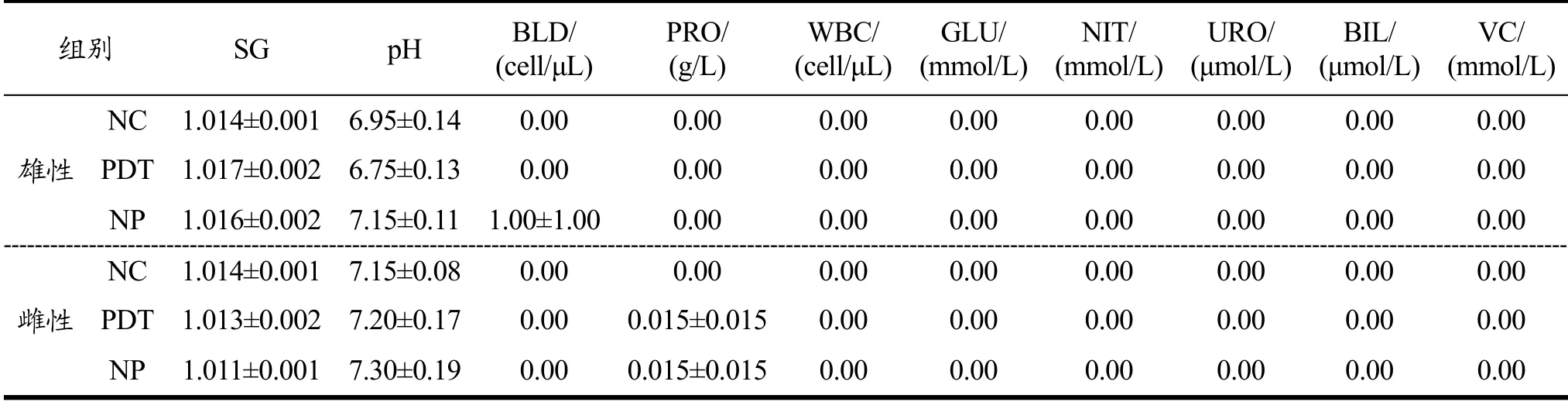
表6 光动力处理牡蛎对大鼠尿常规的影响 Table 6 Effect of photodynamically treated oysters on urine index in rats
2.2.3 对大鼠血常规的影响
测得大鼠血常规结果见表7。与NC组和NP组相比,PDT组大鼠血常规各项检测指标均未表现出明显差异(p>0.05)。上述结果表明,光动力处理牡蛎对大鼠血液学未产生不利影响。
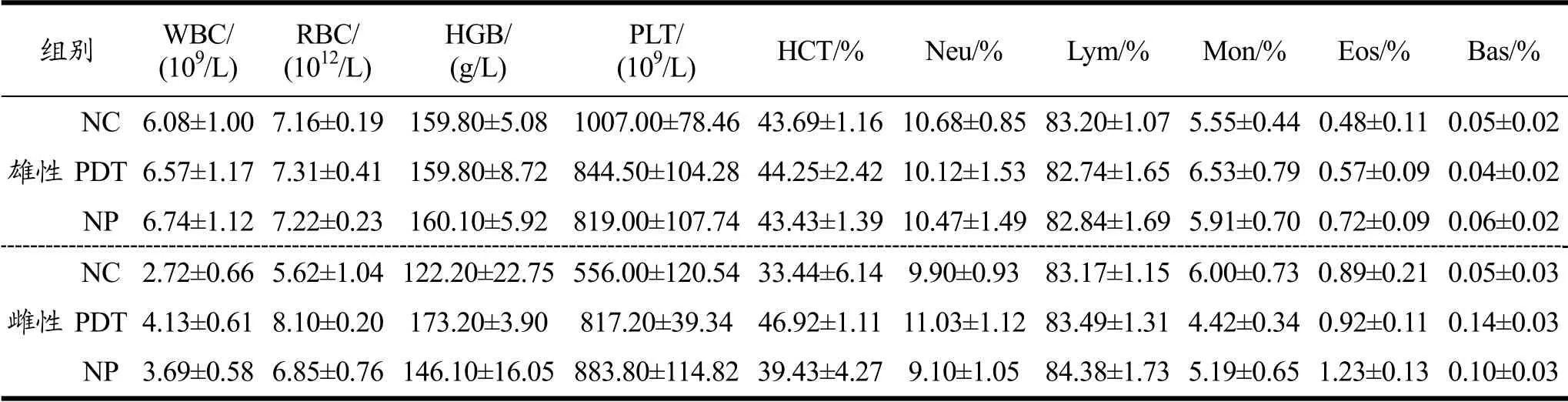
表7 光动力处理牡蛎对大鼠血常规的影响 Table 7 Effect of photodynamically treated oysters on hematological parameters in rats
2.2.4 对大鼠血清生化的影响
血清生化是评估药物对动物毒性作用的重要指标,相关指标不仅能够检测靶器官毒性,而且可以预测毒性即将发生时的变化[31]。测得大鼠血清生化指标结果见表8。与NC组和NP组相比,PDT组大鼠的葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TG)、总蛋白(TP)、白蛋白(ALB)、谷丙转氨酶(ALT)、和谷草转氨酶(AST)、肌酐(CRE)、尿酸(UA)和尿素氮(BUN)指标没有显著差异,不具有统计学意义(p>0.05)。由此说明,光动力处理牡蛎对大鼠的血糖血脂调节功能、肝功及肾功等都无明显损害作用。
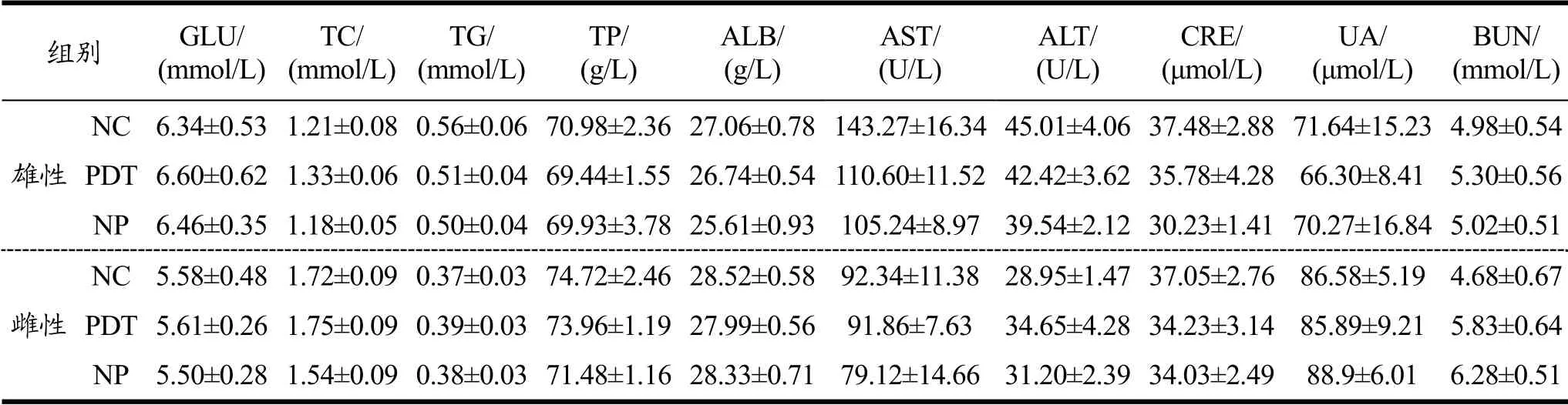
表8 光动力处理牡蛎对大鼠血清生化的影响 Table 8 Effect of photodynamically treated oysters on Serum chemistry profile in rats
2.2.5 对大鼠脏器指数的影响
各组大鼠脏器指数分析结果见表9。与NC组和NP组相比,PDT组大鼠的心脏、肝脏、脾脏、肾脏、睾丸和卵巢指数均无显著性差异(p>0.05)。因此,光动力处理牡蛎对大鼠主要的组织器官没有产生不良影响。
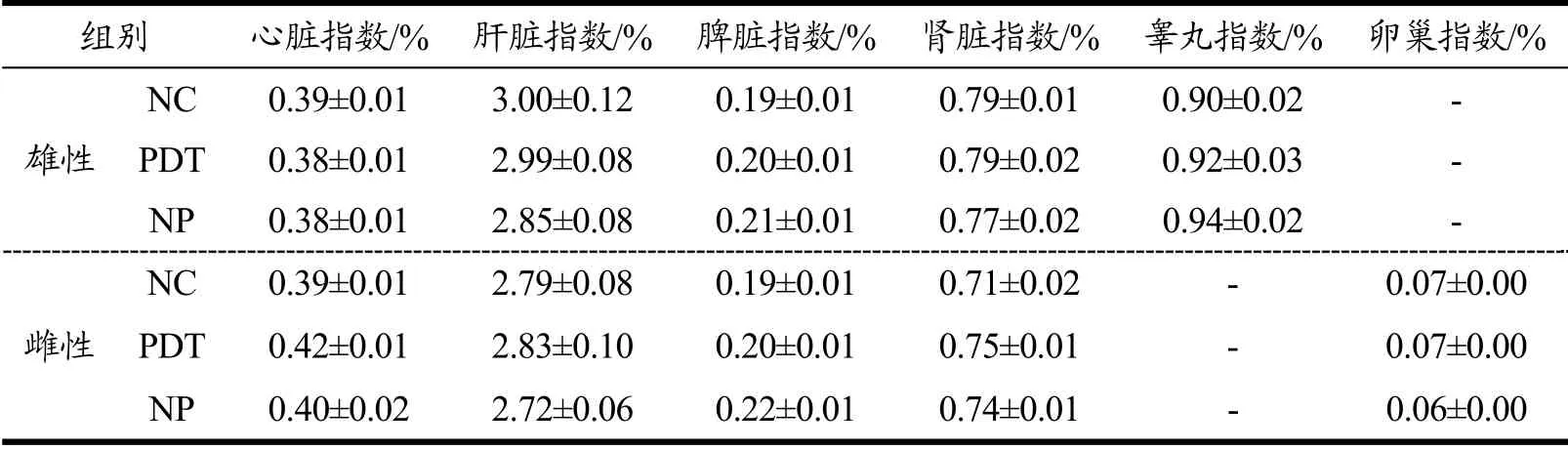
表9 光动力处理牡蛎对大鼠脏器指数的影响 Table 9 Effect of photodynamically treated oysters on organ index of rats
2.2.6 对大鼠组织病理学的影响
实验完成后,对各组大鼠进行大体解剖检查,肉眼观察胃、心、肝、脾、肠、肺、肾、胸腺、睾丸、卵巢等脏器的外观形态,发现各器官组织形态正常,未见组织有异常改变。同时,分别对心、肝、脾、肾、睾丸和卵巢进行组织病理学分析,如图3所示,各脏器组织均未出现异常病变。
3 讨论
3.1 目前,光动力技术在食品领域中多应用于杀菌与保鲜,普遍认为该技术是安全无毒的,但对于具体光敏剂介导光动力技术的毒理学研究甚少,而安全性是任何新技术首先考虑的因素。本研究以《食品安全性毒理学评价程序》(GB 15193.1-2014)为依据,对姜黄素介导光动力处理的牡蛎开展了急性经口毒性试验以及28 d经口毒性试验[32]。姜黄素作为天然着色剂,其添加量应符合《食品添加剂使用标准》(GB 2760-2014)中的限量标准[33]。本课题组之前的研究表明,光动力组牡蛎的姜黄素富集量为0.152 mg/g牡蛎肉,符合食品中姜黄素添加标准,且姜黄素介导的光动力处理后可以保留牡蛎的外观和风味[15,34]。因此,食品安全应用中,理想的光敏剂不仅可以产生较好的杀菌效果,而且要安全无毒和毒副产物低、天然且对感官品质无不利影响[35,36]。基于中国居民平衡膳食宝塔(2019版)中水产品每日推荐摄入量(40~75 g)以及人均日摄入量[37,38],建立本研究牡蛎灌胃剂量。在急性经口毒性试验中运用最大灌胃剂量法,灌胃剂量为40 g/kg·bw,相当于成人一天食用192 g牡蛎,可在经口接触情况下,研究受试物短期内所产生的健康危害信息,并依此对急性毒性进行分级。28 d经口毒性试验灌胃剂量为10 g/kg·bw,相当于成人每天食用牡蛎96 g,重复给药28 d,以期观察连续接触受试物后产生的毒性效应,了解受试物剂量-反应关系,并确定毒作用靶器官,进一步评价光动力处理牡蛎的经口安全性。研究结果表明,在本实验条件下,NC组、PDT组和NP组之间的摄食量和体重增量基本相同,且实验期间小鼠和大鼠的体重均保持稳定增长,可以初步判断牡蛎和姜黄素降解产物对实验动物的摄食及生长发育无不良影响。在28 d经口毒性实验中,尿常规、血常规及血清生化等指标结果证明了大鼠的主要器官特别是代谢排毒器官肝脏和肾脏未受损。上述实验结果均表明姜黄素介导的光动力处理牡蛎是安全无毒的。这一方面是因为姜黄素本身无毒,同时也说明牡蛎富集姜黄素以及光降解过程中均未产生其他明显有毒物质。
3.2 值得注意的是,相对于其他检测指标,急性经口毒性试验中PDT组雄性小鼠的中性粒细胞百分比(Neu%)与NC组相比显著增高,但是由于同组雌性小鼠增加不明显,且在28 d经口毒性试验中该变化趋势也不适用,因此认为不具有毒理学意义。另外一组具有显著性差异的参数是嗜酸性粒细胞百分比(Eos%),急性经口毒性试验中NP组雄性小鼠与NC组相比显著增加,PDT组介于NP组和NC组之间。在其他试验组中虽然无显著性差异,但是都有相同的规律。推测这可能是因为在冻干处理过程中寄生虫卵未被完全杀死导致部分小鼠感染寄生虫,而姜黄素对寄生虫有一定的杀灭作用[39],因此PDT组嗜酸性粒细胞百分比相对NP组有所降低。但由于各组嗜酸性粒细胞百分比的值都在参考范围内(0~7.5%),产生该现象的原因还需要进一步探讨。
4 结论
综上所述,在实验剂量范围内,本文初步证实了姜黄素介导的光动力处理牡蛎不具有急性毒性和亚急性毒性作用,具有较高的食用安全性,为该技术在贝类加工中的推广应用提供更为全面的科学依据。然而,本研究只是对姜黄素介导光动力处理牡蛎的动物毒性进行了初探,后续尚需要开展遗传毒性、亚慢性、生殖毒性乃至人体实验探究其食用安全性。另外,本文使用的光动力杀菌技术,其光敏剂、光源以及光照强度均基于课题组的前期研究进行设计。在光动力技术实际研究与应用中,为达到最佳的杀菌效果,往往会选择不同的光敏剂、穿透力强的光源或光照强度等,这些因素的改变是否会导致毒性作用的变化,仍需进一步探究。
