血液科伏立康唑血药浓度监测60 例结果分析
2022-09-02黄小鹰王敏宋小玲陈晓冬彭洪薇
黄小鹰,王敏,宋小玲,陈晓冬,彭洪薇
1.上海市东方医院吉安医院,江西 吉安 343000;2.南昌大学第一附属医院,江西 南昌 330000
血液科患者由于广泛使用免疫抑制剂、治疗中接受放化疗等因素增加了侵袭性真菌感染发生的风险[1]。近年报道,曲霉菌在血液系统恶性肿瘤患者当中的感染率超过念珠菌,成为血液科侵袭性真菌感染的主要病原体。感染死亡率很高[2-3]。
由于念珠菌和曲霉菌对伏立康唑有良好的敏感性,现已作为血液病患者化疗及造血干细胞移植等过程中预防及治疗真菌感染的常规用药。但伏立康唑体内药物代谢动力学呈非线性代谢且患者基因多态性、用药等因素对其存在一定影响,可能导致伏立康唑临床疗效不佳。现通过回顾性病历分析血液科患者伏立康唑的血药浓度,分析影响伏立康唑血药浓度的因素,为指导伏立康唑临床合理使用提供参考。
1 资料与方法
1.1 资料收集
数据收集采集2019 年4 月至2021 年3 月南昌大学第一附属医院血液科伏立康唑血药浓度。根据排除及纳入标准筛选病例,通过电子病历系统查阅病历收集患者基本资料及相关用药情况。本研究符合医学伦理原则要求,所有患者均知情并签署知情同意书。
1.2 病例选择
纳入标准:2019 年4 月至2021 年3 月南昌大学第一附属医院血液科伏立康唑血药浓度监测数据60例;使用伏立康唑已达稳态血药浓度的患者。排除标准:伏立康唑血药浓度未达稳态血药浓度的患者。
1.3 方法
1.3.1 血药浓度取血时间伏立康唑给药剂量按患者公斤体重计算,负荷剂量(6 mg·kg-1·12 h-1)后予以维持剂量(4 mg·kg-1·12 h-1)。首次检测时间为第5 次给药前半小时采集静脉血进行测定谷浓度,重复监测血药浓度时间为调整药物剂量后第4~7 天采集静脉血进行测定。
1.3.2 血药浓度的测定方法伏立康唑血药浓度采用反相高效液相色谱法(RP-HPLC)测定,其色谱条件如下:色谱柱:ZORBAX-C18(150 mm×4.6 mm,5 μm),流动相:甲醇∶水=60∶40,检测波长:255 nm,流速:1.0 mL/min,柱温:35 ℃,进样量:20 μL。
1.4 统计学方法
所有数据通过SPSS 23.0 软件进行分析,计量资料以表示,对所有计量资料进行正态分布、方差齐性检验,服从正态分布的数据,使用独立样本t检验;不服从正态分布的计量资料,使用非参数检验(Mann-Whitney U test);计数资料采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 患者基本资料
本研究纳入患者60 名,均为血液科使用伏立康唑患者,共60 例伏立康唑血药谷浓度监测结果,人员组成分析,见表1
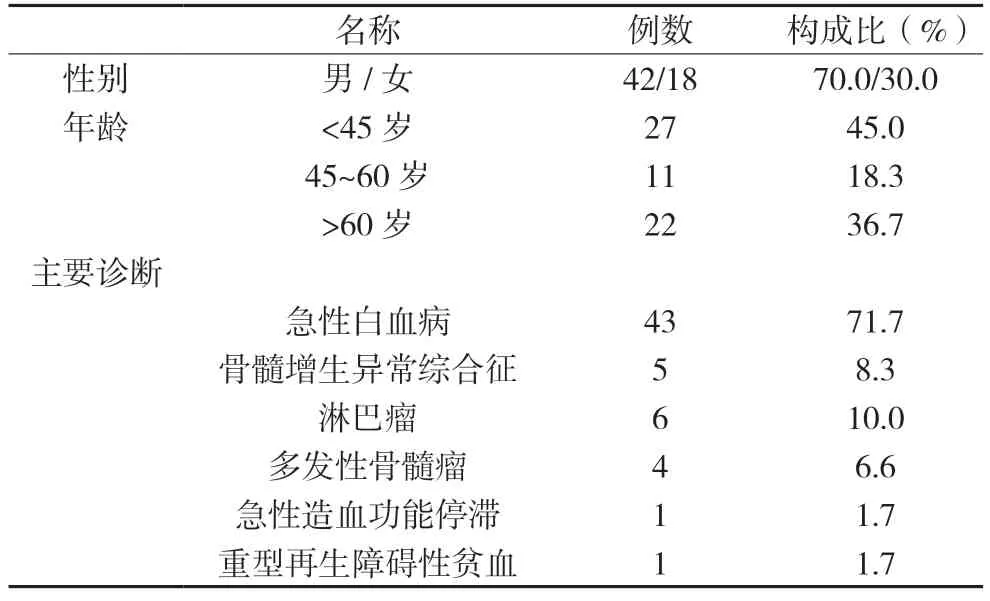
表1 纳入患者60名组成分析
2.2 伏立康唑血药浓度分布情况
60 例伏立康唑测定的血药浓度(4.16±0.39)μg/mL,最低浓度为0.41 μg/mL,最高浓度为12.71 μg/mL。对纳入的60 例血药浓度监测结果见表2。
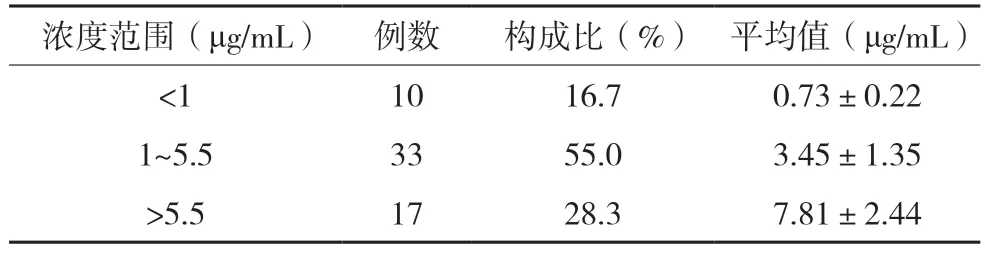
表2 血药浓度结果构成分析
2.3 联用质子泵抑制剂(奥美拉唑或泮托拉唑)对伏立康唑血药浓度的影响
使用Mann-Whitney U 检验判定联合使用PPI与否对伏立康唑谷浓度有影响。未联合使用PPI 组的伏立康唑血药谷浓度的中位数为3.78 μg/mL,联合使用 PPI 组伏立康唑血药谷浓度的中位数为3.57 μg/mL,Mann-Whitney U 检验结果显示两组间差异无统计学意义。结果见表3。
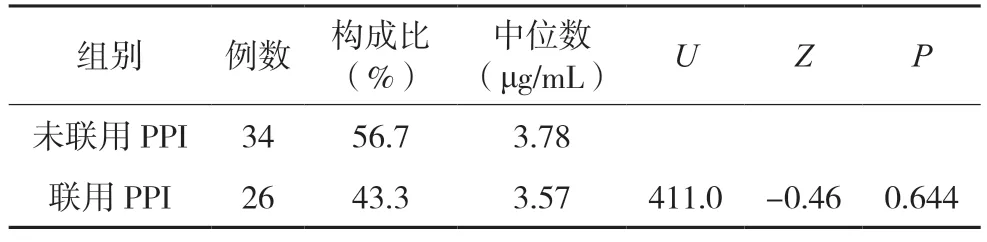
表3 伏立康唑联合使用PPI血药浓度对比分析
2.4 联用糖皮质激素类药物对伏立康唑血药浓度的影响
采用Mann-Whitney U 检验,未联合使用糖皮质激素组与联合使用糖皮质激素组比较两组血药浓度差异无统计学意义。我们比较了地塞米松、甲泼尼龙、泼尼松3 种临床常用的糖皮质激素单独与伏立康唑联用时对伏立康唑血药浓度的影响,发现泼尼松组(P=0.048)对伏立康唑血药浓度的降低差异有统计学意义,地塞米松组与甲泼尼龙组结果差异无统计学意义。但分析样本量较少,对实验结果存在影响。结果见表4。
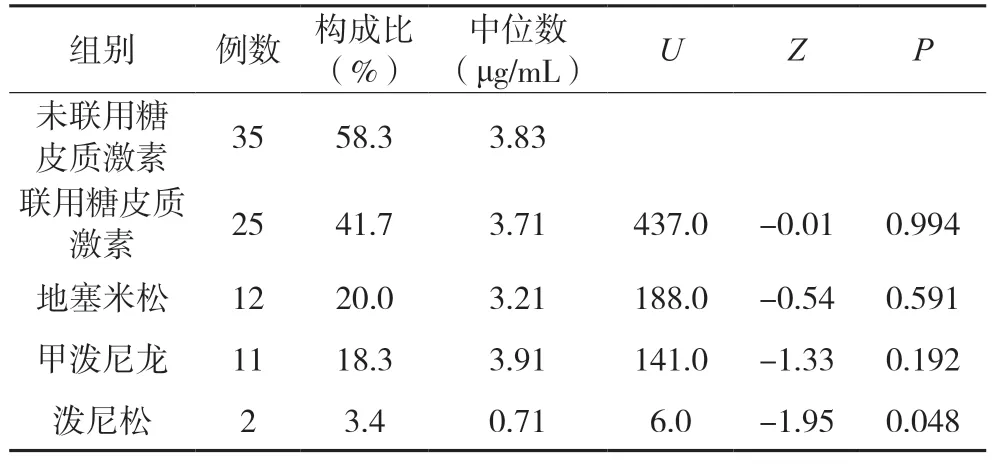
表4 伏立康唑联合使用不同糖皮质激素血药浓度对比分析
2.5 不同给药途径对伏立康唑血药浓度的影响
依据给药途径不同,分为口服组和静脉组。伏立康唑口服组血药浓度中位数低于静脉组,差异有统计学意义(Z=-1.97,P=0.049)。结果见表5。
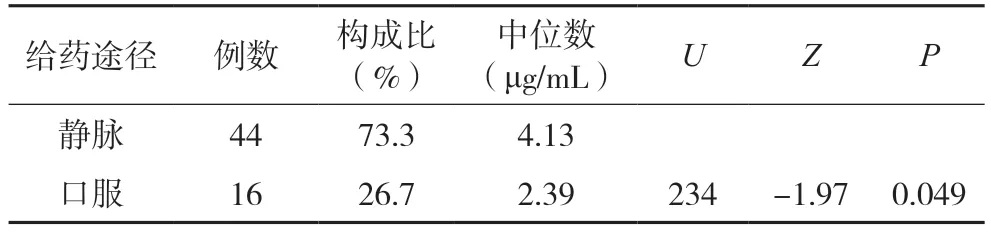
表5 不同给药途径的伏立康唑血药浓度对比分析
2.6 不同厂家对伏立康唑血药浓度的影响
将入组患者按照用药厂家品种分为4 组,国产伏立康唑静脉组和进口伏立康唑静脉组、国产伏立康唑口服组和进口伏立康唑口服组分别比较,采用Mann-Whitney U 检验进行统计学分析。结果可见,两种给药途径,伏立康唑进口和国产药品对血药浓度的影响均差异无统计学意义。见表6。

表6 不同厂家药品对伏立康唑血药浓度影响的对比分析
2.7 低蛋白血症对伏立康唑血药浓度的影响
本研究采取Mann-Whitney U 检验判断轻度低蛋白血症(30 g/L ≤ALB<35 g/L)、中度低蛋白血症(25 g/L ≤ALB<30 g/L)、重度低蛋白血症(<25 g/L)3 种情况对伏立康唑血药浓度的影响,结果可见,低蛋白血症组血药浓度中位数(4.13 μg/mL)明显高于无低蛋白血症组的中位数(1.98 μg/mL),Mann-Whitney U 检验结果表明低蛋白血症可以明显升高伏立康唑的稳态血药谷浓度的中位数(U=131.5,Z=-2.35,P=0.019)。轻度低蛋白血症组与中度低蛋白血症组、轻度低蛋白血症组与重度低蛋白血症组之间比较发现,组间均差异有统计学意义(Z=-2.14、-2.06,P=0.033、0.039)。见表7。
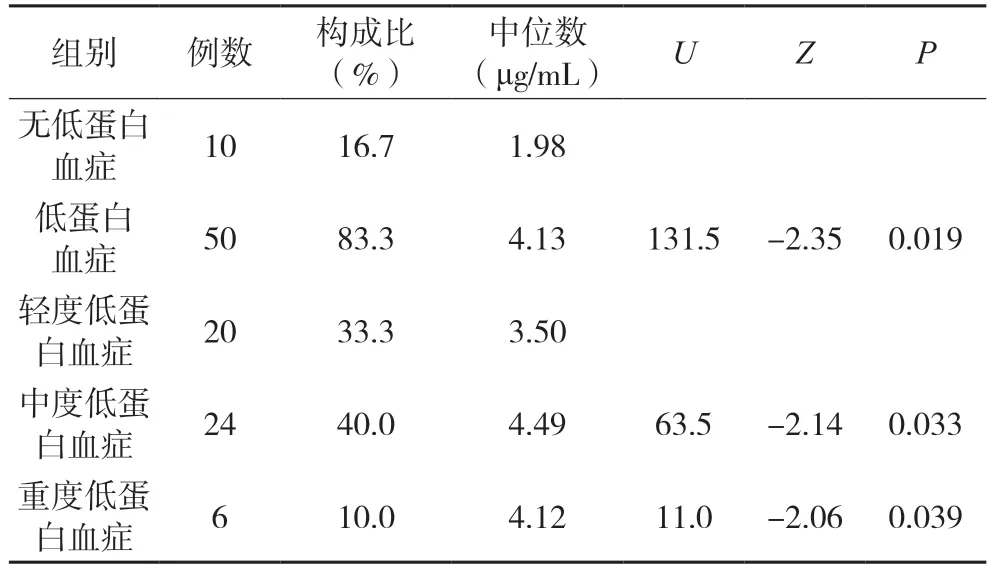
表7 不同病理状态对伏立康唑血药浓度的影响分析
3 讨论
伏立康唑具有高度亲脂性,在体内主要由细胞色素P450 中CYP2C19 代谢,其次为CYP2C9、CYP3A4。而质子泵抑制剂(PPIs)体内主要经CYP2C19 代谢,其次是CYP3A4 代谢,两者联用必然会影响各自的血药浓度。但有研究表明[5],不同PPI 对伏立康唑的血药浓度影响程度存在差异,奥美拉唑对其影响最大。本研究表明,联合使用PPI的患者与未联用PPI 组的伏立康唑初始血药浓度差异无统计学意义。因此,联合使用PPI 对伏立康唑的浓度影响意义不大。
由于伏立康唑对多种真菌具有良好活性,根据临床诊疗指南推荐对具有侵袭性真菌感染高危因素的患者应预防用药,其中推荐使用伏立康唑(4 mg/kg,2 次/d,静脉序贯口服)。伏立康唑存在较大的个体内和个体间变异,监测伏立康唑对指导个体化用药意义重大[4]。
多种血液系统疾病常需糖皮质激素治疗,主要为两种情况:一是治疗自身免疫性疾病;二是利用糖皮质激素溶解淋巴细胞的作用,将其作为联合化疗方案的组分之一。多数报道认为糖皮质激素是肝药酶P450 的诱导剂,对药物代谢可能产生影响[6]。但本研究结果显示,联用糖皮质激素组与未联用糖皮质激素组之间差异无统计学意义,只有泼尼松组的伏立康唑血药浓度降低,但考虑样本量较少,存在一定程度的误差。还须更大的样本量来证实泼尼松会降低伏立康唑血药浓度。
伏立康唑分为两种剂型,静脉和口服制剂。由于原研伏立康唑价格昂贵,国产伏立康唑也成为一种不错的选择。本研究从伏立康唑血药浓度角度分析,产地不同组伏立康唑的谷浓度,差异均无统计学意义。但对于不同给药途径的谷浓度比较,静脉给药组的中位数明显高于口服给药组。有研究表明[7-8]伏立康唑口服生物利用度并不一致,波动较大(60%~96%)。虽然伏立康唑口服的生物利用度高、不受胃肠道pH 值的影响,但会受到食物的影响,食物会降低伏立康唑生物利用度,进而影响其血药峰浓度[9]。推荐在餐前后1~2 h 服用,以避开食物的影响[10]。所以静脉伏立康唑改为序贯口服治疗时,应做好用药教育,避免与食物同服,尤其是高脂肪食物,且应定期监测血药浓度。
本研究发现伏立康唑谷浓度与白蛋白水平之间也有显著的相关性,这与文献报道一致[11-12]。邵贝贝等[11]研究表明低蛋白血症是伏立康唑血药谷浓度升高的影响因子。徐丙发等[12]研究得出白蛋白<35 g/L 组伏立康唑初始血药浓度明显高于白蛋白≥35 g/L 组(P=0.02)。本研究未进行多因素分析,还需完善试验设计和更大的样本量来证实低蛋白水平与伏立康唑血药浓度之间的关系。
本研究通过对使用伏立康唑患者的血药浓度进行比较分析表明:口服伏立康唑的血药浓度中位数低于静脉,联合使用PPI 对伏立康唑血药浓度无显著影响,低蛋白血症的患者血液中伏立康唑的血药浓度明显高于正常组。综上所述,伏立康唑血药浓度监测对指导临床合理用药,提高疗效具有指导意义。
