菜豆植物凝集素的理化性质及活性研究
2022-09-02何青松陈禅友
陈 高,朱 洵,曾 芬,何青松,陈禅友
(江汉大学 生命科学学院,湖北省豆类(蔬菜)植物工程技术研究中心,湖北 武汉 430056)
凝集素(lectin/hemagglutinin)是一类非酶催化活性、非免疫源性的蛋白质或糖蛋白,能与糖基专一旦多阶地非共价可逆结合,不改变所结合糖基的共价键结构,并具有凝集细胞和沉淀聚糖或糖复合物的作用[1]。菜豆植物凝集素(Phytohaemagglutinin,PHA)含有4个亚基,亚基有两种,E亚基可以凝集红血球,L亚基可以凝集白细胞且具有有丝分裂原活性[2]。
近年来,国内外因食用生的或烹饪不充分的菜豆而引起中毒的事件时有发生[3-4],但由于菜豆品种繁多,毒性成分各不相同,其中毒原因至今尚无全面阐述。目前,人们普遍认为菜豆凝集素是食用菜豆中毒的主要毒性成分[5]。菜豆凝集素是菜豆植物体内主要的自我防卫机制之一,可以特异性地结合昆虫小肠表面的糖结合位点,阻碍昆虫对营养物质的吸收,并伴随着一系列的并发反应,导致昆虫停止生长及多种病变,严重时导致死亡[6];菜豆凝集素还可以特异性地与真菌、细菌等微生物表面的各种糖结合蛋白相结合,进而干扰其细胞壁的合成,从而影响到其细胞的正常代谢,对菌类产生抑制作用[7]。因此,菜豆凝集素具有作为一种高效又安全的植物源生物农药的潜质,有潜在的商业应用前景。
目前国内外已经在抗虫、抗菌、抗肿瘤细胞、抗HIV、细胞凝集及促进有丝分裂等多个方面对凝集素展开相关研究[8-9],并将其广泛运用于抗虫转基因、血型鉴定、亲和层析和靶向药物载体等多个领域[10-11],但对于菜豆凝集素理化性质的研究还较少。本文探究了菜豆凝集素的理化性质与生物活性,为进一步明晰菜豆中毒原理和解决菜豆不当食用中毒的实际问题提供思路,同时亦可利用其凝集特性与毒性作用开发生产相关产品或制作植物源生物农药。
1 材料与方法
1.1 材料与试剂
菜豆凝集素标准品购自Sigma-aldrich;葡萄糖、D-甘露糖、D-半乳糖、乳糖、D-海藻糖、L-鼠李糖、蔗糖、D-麦芽糖、D-果糖、D-木糖、盐酸胍、脲、SDS、氯化钾、氯化钠、醋酸、氢氧化钠、Tris、无水乙醇、碳酸氢钠、十二水合磷酸氢二钠、两水合磷酸二氢钠、柠檬酸、柠檬酸钠、氯化钠等均为分析纯,购自国药集团化学试剂有限公司。9种豆科植物材料由湖北省豆类(蔬菜)植物工程技术研究中心提供。
1.2 测定方法
1.2.1 凝集素的血凝活性检验 菜豆凝集素的血凝活性检测采用血凝法[12]。在96孔V型血凝板检的每一孔中加入25μL 0.01 mol/L PBS缓冲液(pH=7.2),然后取25μL样品溶液,加入第一孔,混匀后,取出25μL加至第二孔,混匀后再取25μL,加至第三孔,以此类推,做倍比稀释。同时每孔加入25μL 2%的兔红细胞悬液,并将V型血凝板放在微型振荡器上振荡1 min,25℃下放置2 h,肉眼观察血凝结果。当血红细胞凝成一片时为完全凝集;当血红细胞自然沉降,中间形成小红点时为无凝集;当一半血红细胞凝成一片,一半血红细胞自然沉降,中间小红点为无凝集现象时的一半,此时为半凝集。
凝集素的血凝活性用凝集活力(HU)表示,HU=2n/50μL,其中n为样品在96孔V型板中半凝集时,倍比稀释的孔数。2n为倍比稀释的倍数,即为血凝滴度。
1.2.2 热稳定性的测定 将菜豆凝集素用0.01 mol/L的PBS缓冲液(pH=7.2)配成初始浓度为1 mg/mL的溶液,在水浴中进行加热处理,按照20、30、40、50、60、70、80、90、100℃依次提高温度,每10℃保持恒温5 min,使用血凝法检测血凝活性。
1.2.3 酸碱稳定性测定 将菜豆凝集素0.01 mol/L的PBS缓冲液(pH=7.2)配成初始浓度为1 mg/mL的溶液,分别测定其在pH值2~13条件下的血凝活性。其中,pH 2~3,采用0.1 mol/L的KCl-HCl缓冲液;pH 4~5,采用0.1 mol/L的Na Cl-Hac缓冲液;pH 6~7,采用0.1 mol/L的NaH2PO4-Na2HPO4缓冲液;pH 8~9,采用0.1 mol/L的Tris-HCl缓冲液;pH 10~11,采用0.1 mol/L的Na HCO3-Na OH缓冲液;pH 12~13,采用0.1 mol/L的KCl-Na OH缓冲液。
1.2.4 金属离子结合特性 将菜豆凝集素用0.01 mol/L的PBS缓冲液(pH=7.2)配成初始浓度为1 mg/mL的溶液,并对0.02 mol/L的EDTA溶液充分透析,再使用3 kD的超滤离心管加入0.2 mol/L的PBS缓冲液(pH=7.2)离心数次,充分去除溶液中的EDTA。向96孔V型凝血板中分别加入0.01 mol/L的各种金属离子溶液25μL,使用血凝法检测血凝活性。
1.2.5 糖结合特异性 将菜豆凝集素用0.01 mol/L的PBS缓冲液(pH=7.2)配成初始浓度为1 mg/mL的溶液。并分别配制0.5 mol/L的葡萄糖、D-甘露糖、D-半乳糖、乳糖、D-海藻糖、L-鼠李糖、蔗糖、D-麦芽糖、D-果糖、D-木糖溶液,再分别向96孔V型血凝板加入25μL,使用血凝法检测血凝活性。
1.2.6 变性剂对凝集素血凝活性的影响 考查了3种变性剂对凝集素活性的影响,分别配制不同浓度的变性剂溶液,将2 mg/mL菜豆凝集素与不同浓度的变性剂混合,室温放置2 h后,倍比稀释测检血凝活性。其中盐酸胍溶液浓度设定为0.5、1、3、6 mol/L;脲溶液浓度设定为2、4、5、6、8 mol/L;SDS溶液浓度设定为1、5、10、20 mmol/L。
1.2.7 9种豆科植物凝集素血凝活性的检测 分别选取菜豆、刀豆、猫豆、扁豆、四棱豆、决明子、饭豆、豇豆、荷包豆的商品成熟荚,加入0.01 mol/L PBS缓冲液(pH=7.2)1∶1冰浴研磨,离心取上清液,采用血凝法测量其血凝活性。
1.3 统计分析
数据分析软件为WPS office 2016和IBM SPSS26.0,所有数据进行3次重复。显著性分析使用单因素ANOVA检验,后期进行多重比较。
2 结果与分析
2.1 菜豆PHA的理化性质
菜豆PHA的pH稳定性如图1A所示。菜豆PHA的凝集活力在pH值2~10之间均无显著变化,保持在5.12 HU;至pH值11时才有部分下降;至pH值13时,降到了1.28 HU,下降了75%。结果表明菜豆凝集素保持较强的酸碱稳定性,并且在强酸强碱条件下依然可以保持有较高的血凝活性。整体上菜豆凝集素在酸性条件下的耐受性比碱性条件下强,这可能与菜豆凝集素的等电点在5.5~6.0之间有关。
PHA的热稳定性试验结果如图1B所示。随着温度升高,菜豆凝集素的血凝活性先上升后下降,温度为30℃时有最大凝集活力,为8.53 HU;从50℃开始明显下降;80℃时凝集活力降到了1.71 HU,活力降低了80%;并在90℃时彻底失去活性。结果表明菜豆凝集素具有极强的热稳定性,这也是导致人们食用未熟透菜豆中毒的原因之一。
PHA的糖基稳定性试验结果如图1C所示,添加大部分糖基后菜豆凝集素的凝集活力为2.56 HU,与空白一致;而添加D-果糖和L-鼠李糖后,菜豆凝集素的凝集活力降为1.71 HU,凝集活力下降了33.3%。由此可见,菜豆凝集素可特异性结合D-果糖和L-鼠李糖,其他寡糖对菜豆凝集素无明显抑制作用。在反应中,D-果糖和L-鼠李糖特异性地占据了菜豆凝集素的糖结合位点,使之不能与血红细胞结合,从而降低了菜豆凝集素的血凝活性,对菜豆凝集素的活性表现出抑制作用。而其他的D-甘露糖、D-半乳糖、乳糖、D-海藻糖、蔗糖、D-麦芽糖、D-木糖均不能与菜豆凝集素特异性结合,因而无法抑制菜豆凝集素的血凝活性。
PHA经EDTA处理后重金属的稳定性试验如图1D所示。经EDTA处理后加入Ca2+、Mg2+、Zn2+,菜豆凝集素的凝集活力均为0;经EDTA处理后加入Fe2+,菜豆凝集素的凝集活力为5.21 HU;经EDTA处理后加入Cu2+,菜豆凝集素的凝集活力为0.72 HU。当用EDTA处理菜豆凝集素提取液时,其失去血凝活性,加入Fe2+和Cu2+后菜豆凝集素回复了血凝活性,而Ca2+、Mg2+、Zn2+均不能使菜豆凝集素回复血凝活性。大多数凝集素表现出凝集活力都需要依赖于金属离子,本研究中菜豆凝集素依赖于Fe2+和Cu2+,其中对于Fe2+的依赖性更强。
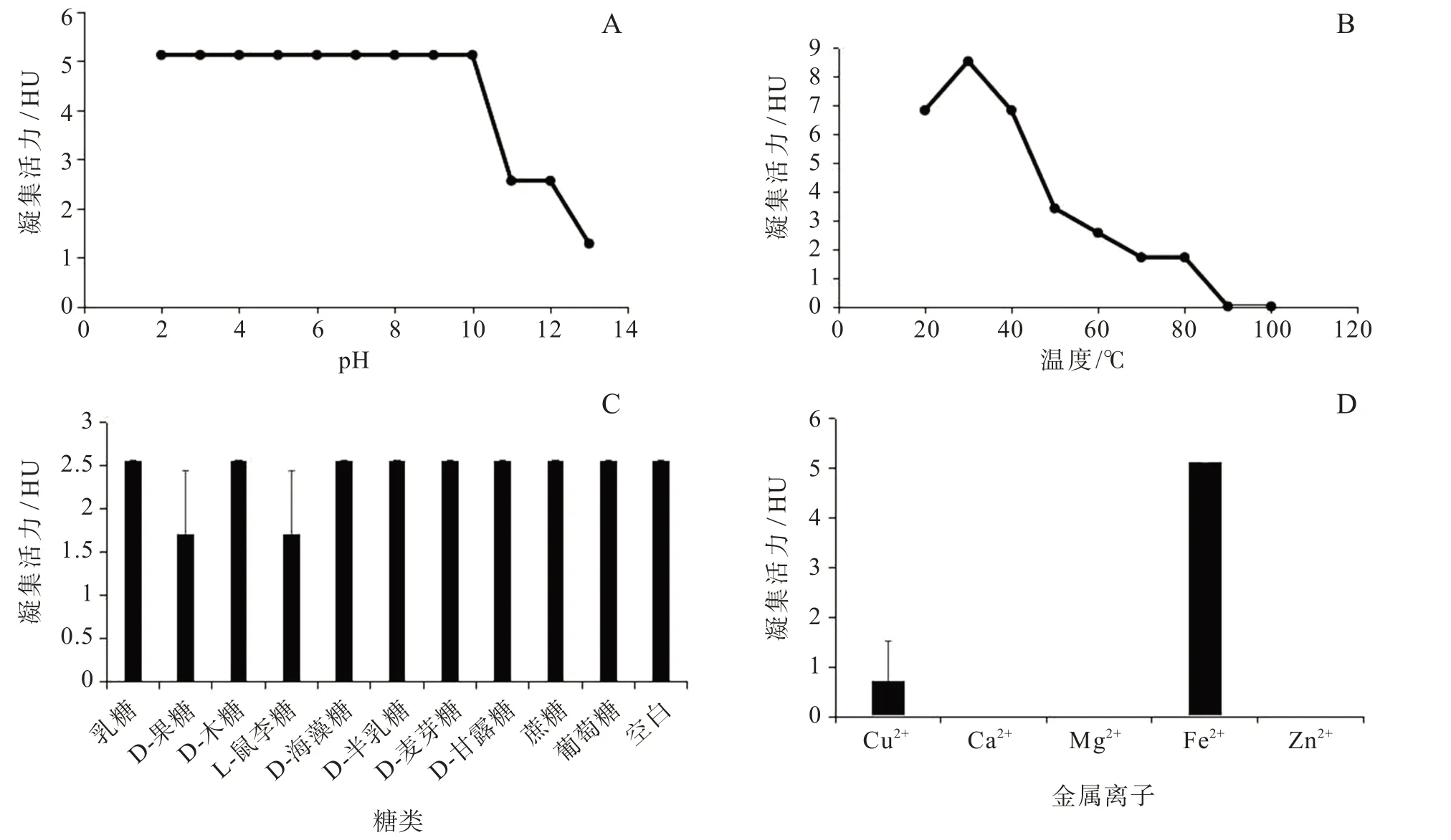
图1 菜豆凝集素的理化性质Fig.1 Physicochemical properties of PHA
2.2 变性剂对凝集素凝血活性的影响
凝集素对于不同的变性剂有着不同的抗性。如图2A所示,随着脲浓度的提高,菜豆凝集素的凝集活力呈下降趋势,由2.56 HU下降到1.28 HU,活性降低了50%,可见脲浓度较高时对菜豆凝集素的血凝活性有部分影响,但无法使菜豆凝集素完全失活。如图2B所示,随着盐酸胍溶液浓度的升高,菜豆凝集素的血凝活性并没有显著变化,凝集活力一直保持在2.56 HU,可见盐酸胍对于菜豆凝集素的血凝活性并没有显著的影响,一直到6 mol/L都无法抑制菜豆凝集素的血凝活性。如图2C所示,随着SDS溶液浓度的升高,菜豆凝集素的凝集活力呈下降趋势,由2.56 HU下降到0.64 HU,活性降低了75%,高浓度的SDS对菜豆凝集素活力有较为明显的抑制作用,但是还是无法使菜豆凝集素完全失活。由此可见,菜豆凝集素活力的稳定性非常好,对于变性剂的抗性较强。

图2 变性剂对菜豆凝集素的影响Fig.2 Effect of denaturant to PHA
2.3 9种豆科植物凝集素含量比较分析
植物凝集素在豆科植物中普遍存在,并广泛参与了豆科植物的有丝分裂、抵御病虫害、生物固氮等生理反应。虽然豆科植物凝集素的结构大体相似,多为四聚体或二聚体,但是不同的豆科植物,其所含的植物凝集素性质依然存在部分差异,如菜豆凝集素可以导致食用中毒,而其他豆科植物凝集素尚未有相关报道。如图3A图3B所示,不同豆科植物凝集素的凝集活力高低为菜豆>扁豆>猫豆=决明子>刀豆=荷包豆>饭豆>豇豆=四棱豆。且菜豆凝集素的凝集活力极显著大于其他豆科植物凝集素(P<0.01),为17.01 HU,是凝集活力第二高的扁豆(凝集活力为1.28 HU)的13.3倍。菜豆凝集素这种远高于其他豆科植物凝集素的血凝活性,可能是其有别于其他豆科植物凝集素并导致食用中毒的主要原因之一。
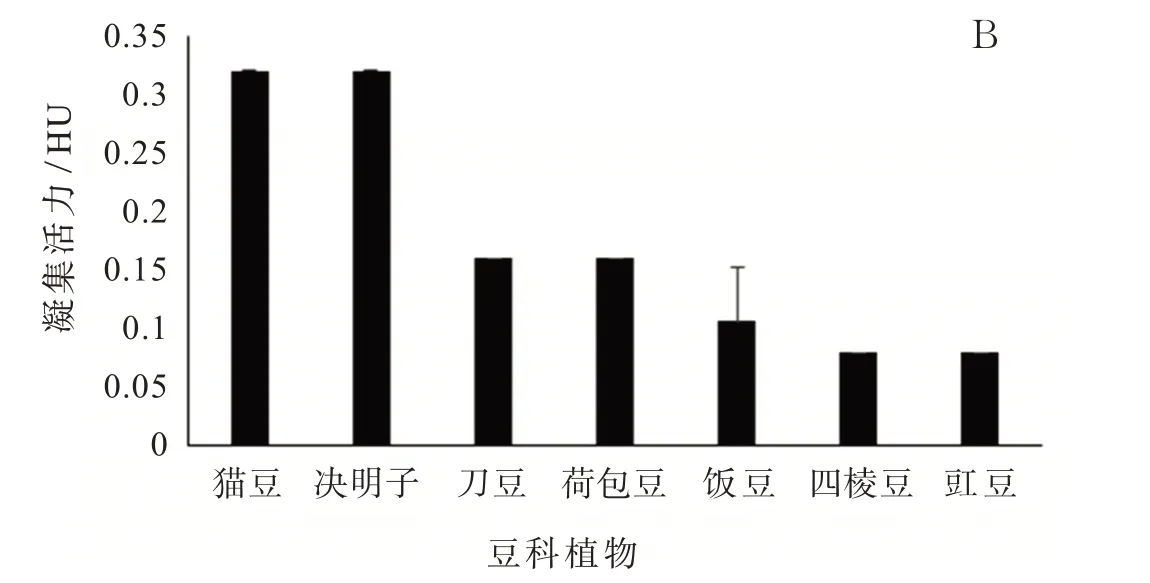
图3 不同豆科植物凝集素含量比较Fig.3 PHA content comparation of different leguminous plant

3 讨论与结论
不同的凝集素其热稳定性各有不同,但大部分凝集素都有较高的热稳定性,如徐小超[13]报道蜘蛛抱蛋凝集素血凝活性在30~70℃无显著变化,在80℃时才损失20%,到90℃时才完全失活,与本研究相似;李建[14]报道大黑花芸豆凝集素活性也是在80℃时才完全失活,凝集素的这种热稳定性可能与凝集素分子含有丰富的胱氨酸有关。同时在本研究中菜豆凝集素亦有较强的酸碱稳定性,在pH 2~14之间均有较强血凝活性,与大多数凝集素相似。如黑皮扁豆凝集素在pH 3.0~10.5之间保持活力不变[15];大黑花芸豆凝集素对于酸碱均比较稳定,在pH较低和较高时保持有较高的凝集活性[14]。
糖基的专一结合特性是凝集素的主要特性之一,不同的凝集素对糖的结合特异性不同。如鳞柄小奥德蘑凝集素的特异性糖为N-乙酰-D-半乳糖胺[16];D-阿拉伯糖、L-岩藻糖对黑木耳凝集素的凝血活性具有抑制作用[17];α-D-半乳糖、D-氨基半乳糖、异丙基-β-D-硫代半乳糖昔和α-乳糖均对大豆凝集素活性有抑制作用[18];而本研究中菜豆凝集素可以特异性结合D-果糖和L-鼠李糖。凝集素的血凝活性依赖于特定的某些金属离子,不同的凝集素对于金属离子的需求也不同,如Ca2+、Zn2+、Mn2+和Mg2+均可使黑皮扁豆凝集素恢复血凝活性[11],Zn2+可以有效加强阿魏菇凝集素的血凝活性[19]。而本研究中菜豆凝集素依赖于Fe2+和Cu2+,其中对于Fe2+的依赖性更强。
综上所述,菜豆凝集素具有较强的热稳定性与酸碱稳定性,并且对多种变性剂具有较强的抵抗能力,这种稳定性在一定程度上揭示了食用未完全煮熟透的菜豆容易中毒的原因,同时也表明了菜豆凝集素可作为一种优秀的生物源农药的潜力。另外,菜豆凝集素对于糖基的特异性结合能力也可运用于血型鉴定、靶向药物载体等多方面。而其对于金属离子的依赖性也提供了一种降低菜豆凝集素毒性的思路。菜豆远高于其他豆科植物的凝集活性一方面揭示了菜豆比其他豆科植物容易中毒的原因,另一方面也表明了菜豆是研究提取凝集素的优良素材来源。明晰菜豆凝集素的理化性质与生物活性为进一步揭示菜豆食用中毒原理,也为研究利用菜豆凝集素提供了多种思路和想法。
