吐纳麝香与Cd污染对土壤微生物数量及酶活性的影响
2022-09-02李兴国律泽张驰王刚
李兴国,律泽*,张驰,王刚
(1.沈阳建筑大学市政与环境工程学院,沈阳 110168;2.辽宁省易派环保职业培训学校,沈阳 110033)
吐纳麝香(AHTN)因其气香浓郁且持久,作为定香调香的香料,广泛应用于高档香水、化妆品和洗衣液等日用化工品中。化妆品工厂和居民日常洗涤废水排放至城市污水处理厂处理后,通过污水灌溉和污泥返田,进入土壤环境并不断累积,使其在土壤中的含量越来越高。目前发现污水处理厂所排放的污泥中AHTN 最大含量为169.284 mg·kg;AHTN 在广东省污水处理厂干质量污泥中含量为4 498 μg·kg,BESTER检测德国一家污水处理厂的进水和污泥中AHTN 浓度发现,进水浓度约为580 ng·L,污泥中含量为1 500 ng·L,REINER 等检测美国两家污水处理厂进水和污泥中AHTN 浓度,发现其在废水中的最大浓度高达2 590 ng·L,在污泥中其最大含量为16.8 mg·kg。由于AHTN在环境中难以被快速降解,含量日益升高,且AHTN 具有易生物富集特性,持续暴露于土壤环境中,对生态环境的威胁越来越大。AHTN 不仅能加快人体乳腺癌细胞的扩散,并且具有雌激素作用。此外,AHTN 导致人血清白蛋白功能受损,二者之间相互作用可能影响蛋白质的正常结构和活性。蚯蚓在一定浓度的AHTN 环境中生存,会促进其体内金属硫蛋白和谷胱甘肽的合成,表明AHTN 会对土壤环境造成潜在生态风险。水体中的AHTN 浓度会通过氧化应激作用导致斑马贻贝的氧化和遗传损伤,并且在暴露于高浓度AHTN 时会导致原发性遗传损伤。
土壤重金属污染毒性强、分布广、治理难,具有生物累积性。当其进入到土壤环境中,土壤微生物难以将其快速降解,在土壤中蓄积造成污染,改变土壤条件,使土壤肥力下降,土壤生态环境遭受严重破坏。且因其强生物富集特性,对农作物造成影响,经食物链危害人体健康。2020 年我国生态环境状况公报土壤污染状况详查显示,重金属污染是导致农田土地质量下降的主要原因,其中Cd 排在首位。重金属均具有较强的生物毒性,Cd 更是世界公认的毒性最强的重金属之一。最近的调查显示,我国城市污泥中重金属Cd 的最大含量为10.5 mg·kg,且在华北平原污灌区13 m 深的土壤中检测到Cd 的含量高达3.8 mg·kg。
污水灌溉和污泥回用是AHTN 和Cd 进入到土壤环境的共同途径,长时间累积会造成土壤污染,因此土壤中二者复合污染较为普遍。目前国内外对AHTN 与Cd 复合污染的研究主要集中在陆生生物,对于二者复合污染对土壤微生物的影响研究较少。AHTN 与Cd 通过在小麦片叶和根系中产生活性氧胁迫,对小麦造成氧化性损伤。WANG 等研究了AHTN 与Cd 联合暴露对赤子爱胜蚓的影响。土壤酶和土壤微生物影响植物生长所需养分的吸收,能够敏感地反映土壤环境变化,在土壤生态系统中起重要作用。为探究AHTN 与Cd 复合污染对土壤微生物生态毒理作用机理,本研究采用平板菌落计数和荧光定量qPCR,测定AHTN 与Cd 单一及复合污染下土壤细菌、真菌、放线菌数量变化及土壤脲酶、酸性磷酸酶和蔗糖酶活性变化,并研究了复合污染对微生物数量和酶活性的联合毒性效应,为评价AHTN 的生态健康风险提供科学依据。
1 材料与方法
1.1 供试土壤
供试土壤采集于辽宁省沈阳市石佛寺灌渠渠首(42°8.611′N,123°20.705′E),取农用地上层(0~20 cm)的新鲜土壤,现场处理后带回实验室。具体土壤理化性质如下:土壤类型为棕壤,pH 为5.92,含水量为15.32%,有机质含量2.48%,速效氮含量38 mg·kg,速效钾含量158 mg·kg,有效磷含量17.5 mg·kg,AHTN含量16.45 μg·kg,Cd含量0.68 mg·kg。
1.2 供试药品
吐纳麝香(AHTN)购自上海源叶生物科技公司,纯度为95%。
1.3 试验方法
1.3.1 土壤染毒试验
称取1.18 kg 过2 mm 筛土壤(相当于1 kg 干土)于塑料花盆中,定期浇水,保持土壤水分,使用透气膜将其密封,防止发生蒸腾作用而减少水分,也防止细菌等杂质进入。土壤在恒温培养箱(25 ℃)预培养7 d。试验设置4 个AHTN 含量,分别为0、100、500 mg·kg和1 000 mg·kg,2 个Cd 含量,分别为0、10 mg·kg,共8 个处理组。每个处理组设3 个平行试验,共24个样本。采用土壤暴露法进行染毒。
1.3.2 盆栽试验
将染毒土样充分搅拌混合,待丙酮完全挥发后,将稳定后的土壤均匀置入花盆内,将龙葵种子播种其中,共种植24盆。当龙葵高度约2 cm时定苗,最终每盆保留6 株生长趋势相同的幼苗。花盆在室外随机放置80 d,挪动花盆位置使其发生不规则变化。不定期浇水,土壤水分恒定保持为田间持水量的60%。
1.3.3 样品采集与处理
每隔20 d(1、20、40、60 d和80 d)进行一次土壤样品采样,共采样5次,样品采自表层土壤下深度约为3 cm处根周土壤,并测定其微生物数量以及土壤酶活性。
1.4 测定方法
1.4.1 土壤微生物测定方法
(1)微生物测定
采用固体平板稀释涂布培养计数法,细菌、真菌和放线菌分别采用牛肉膏蛋白胨培养基、马丁培养基和高氏培养基进行培养。
(2)微生物总数测定
微生物总数的测定采用荧光qPCR 法。DNA 提取:使用Fast DNA-SPIN KitForSoil 试剂盒,从0.5 g土壤中提取基因组DNA,并将其溶于50 μL 水中,保存温度为-20 ℃。测定基因的拷贝数:采用荧光定量qPCR 测定细菌16S rRNA、真菌18S rRNA 和放线菌特异基因的拷贝数(以单位质量干土计)。制作标准曲线,样品中的基因拷贝数根据所得标准曲线计算后,换算成每克干土的基因拷贝数。
1.4.2 土壤酶活性测定方法
土壤脲酶、蔗糖酶和酸性磷酸酶活性分别采用苯酚钠法、3,5-二硝基水杨酸法和对硝基酚比色法测定。
1.5 数据分析
菌种/酶活性抑制率计算公式:
抑制率=(对照-处理)/对照×100%
AHTN和Cd复合污染作用模式方程:

式中:()为理论预测抑制率,%;为AHTN 引起的抑制率,%;为Cd 引起的抑制率,%。()为实际检测的抑制率(%),对()和()进行差异显著性分析,若检测值()大于预测值(),则二者联合作用模式显著的为协同作用,反之,显著的为拮抗作用。
试验数据采用DPS 7.5 进行平均值和标准差计算,利用Turkey多重比较进行差异显著性分析。显著性水平和极显著水平分别为<0.05 和<0.01。采用Origin 8.5制图。
2 结果与分析
2.1 AHTN与Cd污染对土壤中微生物数量的影响
分别以时间T(1、20、40、60 d 和80 d)、污染物Cd浓度(0、10 mg·kg)和污染物AHTN 浓度(0、100、500 mg·kg和1 000 mg·kg)为研究因子,通过土壤细菌、真菌和放线菌活性抑制率的三因素方差分析,分析各个因子的主效应,研究一阶交互效应和二阶交互效应对土壤微生物的影响。不同浓度的AHTN 与Cd 单一、复合污染处理对土壤细菌、真菌和放线菌活性抑制率的影响均达到极显著水平,土壤微生物抑制率随处理时间的变化也极显著(<0.01)。
2.1.1 对土壤中细菌的影响
如图1 所示,AHTN 单一污染显著抑制土壤中的细菌数量,抑制率随AHTN 浓度的增加而增加。100 mg·kgAHTN 对细菌抑制率变化范围为24.14%~52.04%;500 mg·kgAHTN 对土壤细菌生长数量抑制率变化范围为43.66%~69.07%;1 000 mg·kgAHTN对土壤细菌数量抑制率变化范围为58.50%~88.69%。

图1 AHTN与Cd污染对土壤中细菌数量抑制率影响Figure 1 The influence of AHTN and Cd contamination on the number inhibition rate of bacteria in soil
AHTN 与Cd 复合污染与AHTN 单一污染对细菌的影响一致,均表现显著抑制作用,即随着AHTN 浓度增加,其对细菌抑制率也增加。100 mg·kgAHTN与Cd 复合污染对细菌抑制率为48.56%~73.76%;500 mg·kgAHTN 与Cd 复合污染对细菌抑制率为22.69%~76.55%;1 000 mg·kgAHTN 与Cd 复合污染对细菌抑制率为61.30%~89.20%。Cd 单一污染显著抑制细菌生长,其抑制率为24.05%~48.43%。AHTN与Cd 单一、复合污染对土壤中细菌均表现为显著抑制作用。
在第40天时,100、500、1 000 mg·kgAHTN 单一污染对细菌抑制率分别为41.59%、65.67%、88.69%,与Cd 复合污染对细菌抑制率分别为73.76%、76.55%、89.20%;在第80 天时,100、500、1 000 mg·kgAHTN单一污染对细菌的抑制率分别为24.14%、56.80%、85.57%,与Cd 复合污染对细菌的抑制率分别为52.72%、65.96%、86.48%,AHTN 与Cd 复合污染对细菌的抑制率大于其对应浓度AHTN单一污染。
2.1.2 对土壤中真菌的影响
如图2 所示,AHTN 单一污染下,100 mg·kg和500 mg·kgAHTN 在前60 d 对土壤中的真菌产生促进作用,其抑制率分别为-12.75%~-35.32%和-6.51%~-64.36%,1 000 mg·kgAHTN对真菌表现出抑制作用,其抑制率为12.75%~72.05%。
如图2 所示,100 mg·kgAHTN 与Cd 复合污染促进土壤中的真菌生长,其抑制率在-6.38%~-71.33%,500 mg·kg和1 000 mg·kgAHTN 与Cd 复合污染对土壤中的真菌产生抑制作用,其抑制率为6.38%~51.39%和28.27%~68.58%。Cd 单一污染对真菌表现为抑制作用,其抑制率为17.82%~47.82%。

图2 AHTN与Cd污染对土壤中真菌数量抑制率影响Figure 2 The influence of AHTN and Cd contamination on the number inhibition rate of fungi in soil
对于土壤真菌,100、500 mg·kgAHTN 单一及与Cd 复合污染对其生长由促进转为抑制,而1 000 mg·kgAHTN 与Cd 单一、复合污染显著抑制其生长。随着AHTN浓度增加,AHTN单一及与Cd复合污染对土壤真菌生长逐渐从促进转变为抑制。
2.1.3 对土壤中放线菌的影响
如图3 所示,AHTN 单一污染下,3 种浓度AHTN均显著抑制土壤中放线菌生长,100、500、1 000 mg·kgAHTN 抑制程度分别为9.98%~24.50%、15.04%~47.28%、29.49%~56.24%,表明AHTN 浓度越高,抑制程度越严重。

图3 AHTN与Cd污染对土壤中放线菌数量抑制率影响Figure 3 The influence of AHTN and Cd contamination on the number inhibition rate of actinomyces in soil
AHTN 与Cd 复合污染显著抑制了土壤放线菌的生长,100、500、1 000 mg·kgAHTN与Cd复合污染对其抑制率分别为12.29%~52.74%、23.53%~65.05%、37.82%~70.14%,抑制效果随着AHTN 浓度的增加而增强。Cd 单一污染对其抑制率为8.19%~63.19%,显著抑制其生长。AHTN 与Cd 单一、复合污染均显著抑制土壤中放线菌生长。
不同浓度AHTN 与Cd 复合污染对放线菌的抑制率大于其对应浓度AHTN单一污染(第1天除外)。
2.1.4 对微生物基因拷贝数的影响
(1)细菌16S rRNA基因拷贝数
方差分析结果表明,与CK 相比,1 000 mg·kgAHTN 单 一 处 理 及100、500、1 000 mg·kg的AHTN 与Cd 复合污染的细菌基因拷贝数表现出显著差异(<0.05),对细菌均表现为促进作用,分别高于CK组65.75%、51.26%、64.14%、82.76%(图4),表明细菌拷贝数随着AHTN浓度的升高而增加。
(2)真菌18S rRNA基因拷贝数
方差分析结果表明,与CK 相比,除500 mg·kgAHTN单一、1 000 mg·kgAHTN单一及与Cd复合污染外,真菌基因拷贝数显著升高(<0.05),表现为促进作用(图4)。真菌基因拷贝数随着AHTN浓度升高而增加。
(3)放线菌基因拷贝数
方差分析结果表明,与CK 相比,AHTN 单一及与Cd 复合污染对放线菌基因拷贝数表现出显著差异(<0.05),对放线菌表现为抑制作用。100、500、1 000 mg·kgAHTN 抑制率分别为38.46%、50.01%、54.81%,Cd 单一污染抑制率为26.92%,100、500、1 000 mg·kgAHTN 与Cd 复合污染抑制率分别为60.38%、75.19%、77.12%(图4),放线菌基因拷贝数随着AHTN浓度升高而减少。
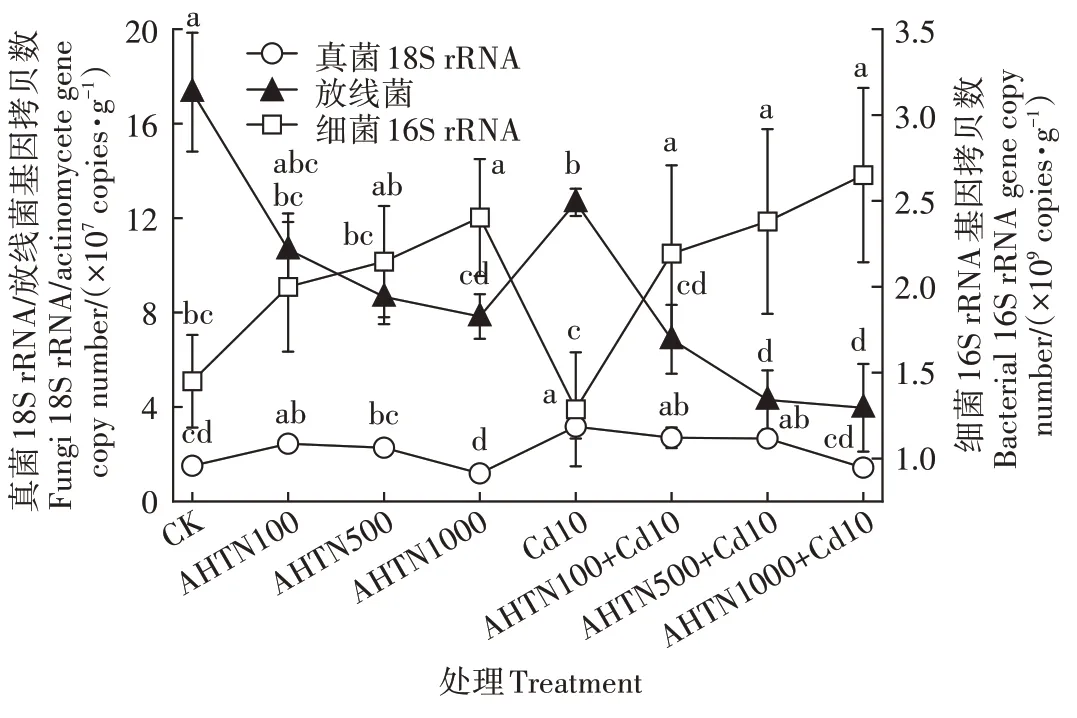
图4 AHTN与Cd污染对土壤微生物基因拷贝数的影响Figure 4 The influence of AHTN and Cd contamination on the copy number of soil microorganisms gene
2.2 AHTN与Cd污染对土壤酶活性的影响
分别以时间T(1、20、40、60、80 d)、污染物Cd 浓度(0、10 mg·kg)和污染物AHTN 浓度(0、100、500、1 000 mg·kg)为研究因子,进行土壤脲酶、酸性磷酸酶和蔗糖酶活性抑制率的三因素方差分析,分析各个因子的主效应,研究一、二阶交互效应对土壤酶活性的影响。不同浓度的AHTN 与Cd 单一、复合污染对土壤脲酶、酸性磷酸酶和蔗糖酶活性抑制率的影响均达到极显著水平,土壤微生物抑制率随处理时间的变化也极显著(<0.01)。
2.2.1 对土壤中脲酶活性的影响
如图5 所示,AHTN 单一污染对土壤脲酶表现为抑制作用,100 mg·kgAHTN 在处理周期(1、20、40、60、80 d)内的抑制率分别为5.36%、25.10%、43.81%、21.58%、11.71%;500 mg·kgAHTN 的抑制率分别为15.55%、27.86%、50.69%、33.88%、38.07%;1 000 mg·kgAHTN 的抑制率分别为26.46%、33.03%、61.34%、62.52%、73.31%。
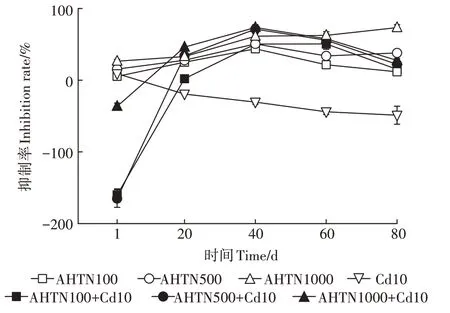
图5 AHTN与Cd污染对土壤中脲酶活性抑制率的影响Figure 5 The influence of AHTN and Cd contamination on the inhibition rate of urease activities in soil
100、500、1 000 mg·kgAHTN 与Cd 复合污染在第1天促进土壤脲酶活性,其抑制率分别为-162.02%、-165.07%和-36.49%,而在其余时间均表现为抑制作用,100 mg·kgAHTN与Cd复合污染在其余时间(20、40、60、80 d)的 抑 制 率 分 别 为2.10%、50.43%、50.58%、15.18%;500 mg·kgAHTN 与Cd 复合污染的抑制率分别为33.96%、71.21%、55.86%、22.09%;1 000 mg·kgAHTN 与Cd 复合污染的抑制率分别为46.16%、73.53%、57.82%、27.56%。可以看出,在第40天时,复合污染抑制率达到最大值,这表明复合污染此时毒性达到最大。Cd 单一污染对土壤脲酶活性作用为先抑制后促进,1、20、40、60、80 d 抑制率分别为9.05%、-19.36%、-30.54%、-44.03%、-48.83%。
在第40天时,100、500、1 000 mg·kgAHTN单一污染对土壤脲酶的抑制率分别为43.81%、50.69%、61.34%,与Cd 复合污染的抑制率分别为50.43%、71.72%、73.53%,抑制作用随AHTN 浓度升高而增强,且二者复合污染对土壤脲酶的抑制率大于其对应浓度AHTN单一污染的。
AHTN 单一及与Cd 复合污染均显著抑制土壤脲酶活性(第1天除外)。
2.2.2 对土壤中酸性磷酸酶活性的影响
如图6 所示,100 mg·kg和500 mg·kgAHTN单一污染对土壤酸性磷酸酶表现为促进作用,其在1、20、40、60、80 d 抑制率分别为-69.99%、-5.24%、-90.85%、-21.05%、-15.79% 和-22.69%、-23.87%、-47.60%、-29.22%、-1.31%,1 000 mg·kgAHTN 单一污染对土壤酸性磷酸酶在第1 天和第20 天时表现为促进作用,其抑制率为-2.93%和-23.00%,40、60、80 d 时转为抑制作用,抑制率分别为12.35%、44.21%和60.36%。
如图6 所示,对于土壤酸性磷酸酶,100 mg·kgAHTN 与Cd 复合污染显著促进其活性,在1、20、40、60、80 d抑制率分别为-29.20%、-25.63%、-9.80%、-4.68%、-5.23%,500 mg·kgAHTN 与Cd 复合污染在1、20、40 d 促进其活性,其抑制率分别为-38.32%、-3.11%、-18.20%,第60 天和第80 天转变为抑制作用,抑制率分别为41.64%和11.44%;土壤酸性磷酸酶活性在1 000 mg·kgAHTN 与Cd 复合污染下受到显著抑制,在1、20、40、60、80 d 抑制率分别为5.21%、7.42%、12.35%、43.93%、43.05%。Cd 单一污染仅在80 d表现为抑制作用,其余时间为促进作用。
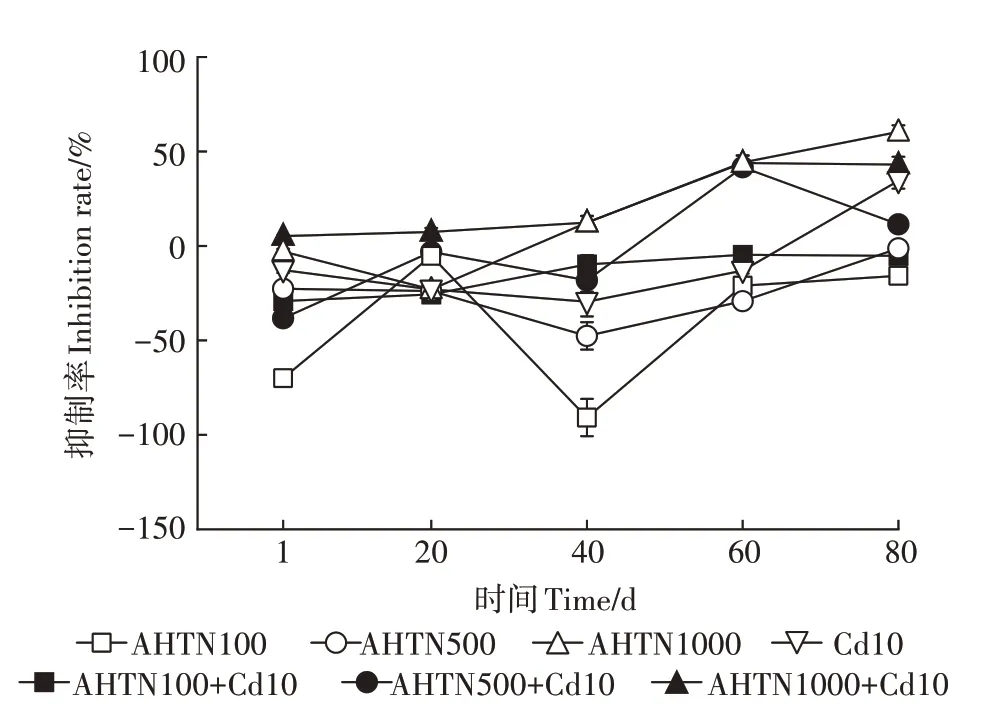
图6 AHTN与Cd污染对土壤中酸性磷酸酶活性抑制率的影响Figure 6 The influence of AHTN and Cd contamination on the inhibition rate of acid phosphatase in soil
100、500 mg·kgAHTN 单一污染和100 mg·kgAHTN 与Cd 复合污染能够促进土壤酸性磷酸酶活性,500 mg·kgAHTN 与Cd 复合污染与1 000 mg·kgAHTN 单一污染表现为先促进后抑制,1 000 mg·kgAHTN 与Cd 复合污染始终表现为抑制作用。随着AHTN浓度增加,AHTN单一及与Cd复合污染对土壤酸性磷酸酶活性均为先促进后抑制。
2.2.3 对土壤中蔗糖酶活性的影响
如图7 所示,与对照组CK 相比,AHTN 单一污染在第1 天对蔗糖酶表现为促进作用,100、500、1 000 mg·kgAHTN 抑制率分别为-201.72%、-72.31%、-56.78%;在其他时间表现为抑制土壤蔗糖酶活性,20、40、60 d 和80 d,100 mg·kgAHTN 对其抑制率分别为39.09%、10.60%、34.99%和36.63%,500 mg·kgAHTN 对其抑制率分别为34.66%、21.19%、51.35%和53.10%,1 000 mg·kgAHTN 对其 抑制率 分别 为27.85%、40.22%、64.31%和63.03%。

图7 AHTN与Cd污染对土壤中蔗糖酶活性抑制率的影响Figure 7 The influence of AHTN and Cd contamination on the inhibition rate of invertase in soil
如图7 所示,在第1 天,AHTN 与Cd 复合污染促进土壤蔗糖酶活性,之后均显著抑制,100、500、1 000 mg·kgAHTN 与Cd 复合污染在第1 天的抑制率分别为-87.98%、-89.80%、-38.43%;在20、40、60、80 d,100 mg·kgAHTN 与Cd 复合污染对其抑制率分别为65.41%、23.36%、44.06%、42.81%,500 mg·kgAHTN对其抑制率分别为71.83%、30.82%、51.51%、53.35%,1 000 mg·kgAHTN 对其抑制率分别为77.13%、40.58%、65.40%、66.84%。Cd单一污染显著抑制了其活性(第1 天除外)。3 种浓度AHTN 与Cd 复合污染均在20 d 时达到抑制率的最大值,表明复合污染在20 d时对蔗糖酶毒性最大。
对于土壤蔗糖酶,AHTN 与Cd 复合污染与AHTN单一污染作用效果相似,即在第1 天促进蔗糖酶活性,在其他时间抑制蔗糖酶活性。AHTN 与Cd 复合污染对土壤蔗糖酶抑制率大于AHTN 单一污染(第1天除外)。
2.3 AHTN与Cd复合污染对土壤微生物的联合效应
如表1所示,AHTN 与Cd复合污染对土壤中细菌抑制率的实测值()显著低于预测值()(<0.05),说明AHTN 与Cd 复合污染对土壤细菌联合毒性效应表现为拮抗作用。
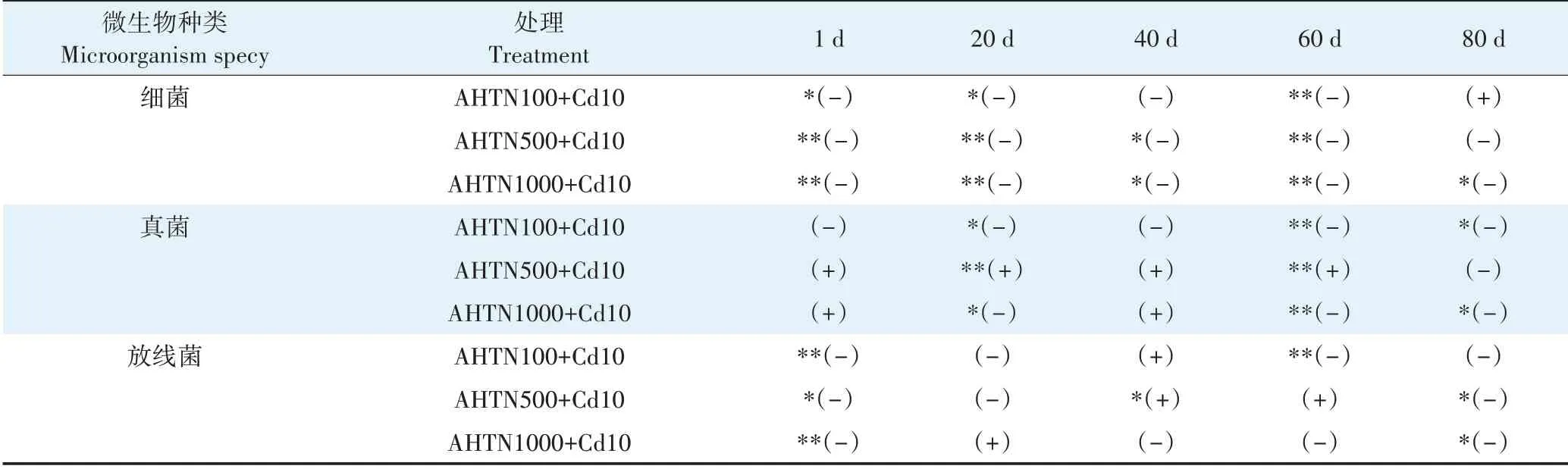
表1 不同时间下AHTN与Cd复合污染对土壤微生物数量抑制率预测值和检测值的比较Table 1 Comparison of predicted and detected values of inhibition rate of soil microbial population by AHTN and Cd combined pollution under different time
100 mg·kg和1 000 mg·kgAHTN 与Cd 复合污染对土壤中真菌抑制率的实测值()显著低于预测值()(<0.05),说明AHTN 与Cd 复合污染对土壤真菌联合毒性效应表现为拮抗作用。500 mg·kgAHTN 与Cd 复合污染对土壤中真菌抑制率的实测值()显著高于预测值()(<0.05),说明AHTN 与Cd 复合污染对土壤真菌联合毒性效应表现为协同作用。AHTN 与Cd 复合污染对土壤中放线菌抑制率的实测值()显著低于预测值()(<0.05),说明AHTN 与Cd 复合污染对土壤放线菌联合毒性效应表现为拮抗作用(40 d时500 mg·kg除外)。
2.4 AHTN与Cd复合污染对土壤酶活性的联合效应
如表2 所示,AHTN 与Cd 复合污染在第1 天时对土壤脲酶活性抑制率的实测值()显著低于预测值()(<0.05),20 d以后土壤脲酶活性抑制率的实测值()均显著高于预测值()(<0.05)。通过比较预测值()与实测值(),表明AHTN 与Cd复合污染对土壤脲酶活性联合毒性效应在第1 天表现为拮抗作用,20 d以后均为协同作用。
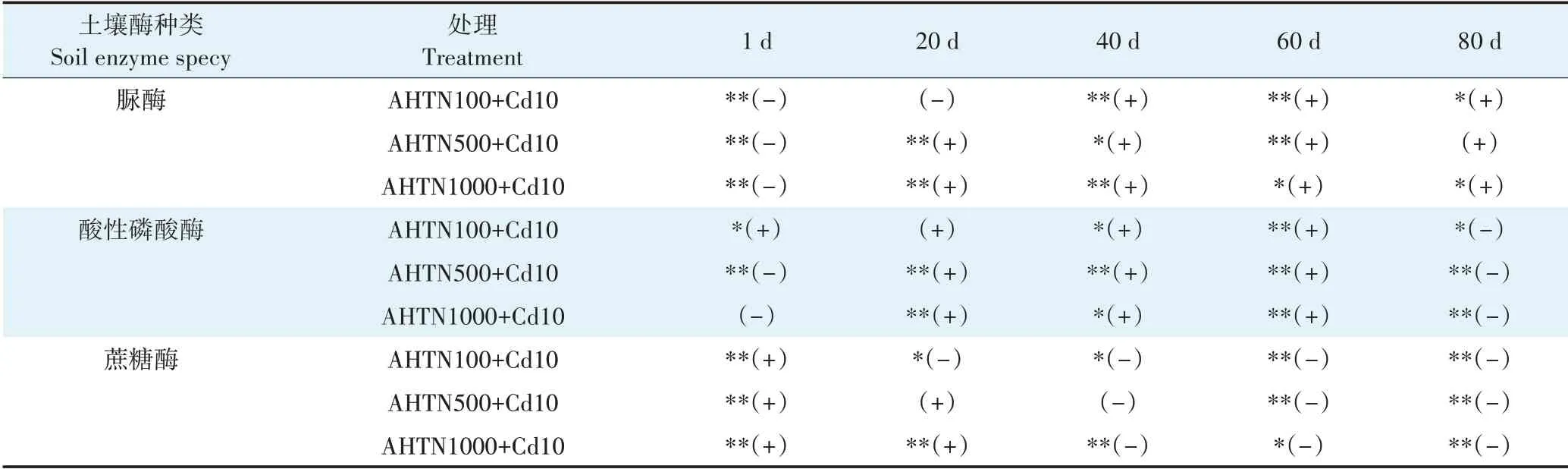
表2 不同时间下AHTN与Cd复合污染对土壤酶活性抑制率预测值和检测值的比较Table 2 Comparison of predicted and detected values of soil enzyme activity inhibition rate by AHTN and Cd combined pollution under different time
对土壤酸性磷酸酶,在前60 d,AHTN 与Cd 复合污染对其抑制率的实测值()显著高于预测值()(<0.05)(第1 天除外);80 d 时,实测值()均显著低于预测值()(<0.05)。根据预测值()与实测值()比较,可知AHTN 与Cd 复合污染对土壤酸性磷酸酶活性联合毒性效应60 d 前表现为协同作用(第1天除外),在80 d表现为拮抗作用。
在1 d 时,100、500、1 000 mg·kgAHTN 与Cd 复合污染对土壤蔗糖酶活性抑制率的实测值()显著高于预测值()(<0.05),表明AHTN 与Cd 复合污染对土壤蔗糖酶活性联合毒性效应表现为协同作用,在40、60 d 和80 d 时,对土壤蔗糖酶活性抑制率的实测值()显著低于预测值()(<0.05),表明AHTN 与Cd 复合污染对土壤蔗糖酶活性联合毒性效应表现为拮抗作用。比较预测值()与实测值(),可知AHTN 与Cd 复合污染对土壤蔗糖酶活性联合毒性效应在第1 天表现为协同作用,40 d 后转变为拮抗作用。
3 讨论
本研究中,100 mg·kg和500 mg·kgAHTN 单一污染及其与Cd复合污染促进土壤中的细菌和真菌生长。其原因是微生物在AHTN 与Cd 暴露下,逐渐适应了外来污染物,在此条件下,微生物具有降解有机物的能力,通过与氧结合一系列催化反应,形成环氧化合物,再水解转化为微生物自身个体生长所需的碳源和能量。在此“刺激”后,酶活性增加,促进微生物生长发育。当环境中AHTN 浓度过高时,即使微生物能够通过自身调节来适应和抵抗AHTN 的胁迫,但其各方面生长代谢过程均受到影响,生理生命活动受到抑制,导致其数量下降。本研究中AHTN 单一及其与Cd 复合污染显著抑制了土壤放线菌生长,与佳乐麝香和Cd单一、复合处理对土壤放线菌作用一致,AHTN 与佳乐麝香结构相似,其存在可能降低放线菌体内某种转运体的活性,使有害物质贮存在放线菌体内,抑制放线菌生长。
沈国清等研究发现,菲和Cd 复合污染抑制了蔗糖酶的活性,闫雷等研究发现土霉素与Cd 复合污染也抑制了蔗糖酶活性,与本试验结果相似。本研究中,AHTN 单一及与Cd复合污染在第1天均促进了土壤蔗糖酶活性,长期暴露后抑制了其活性。Cd 能刺激土壤蔗糖酶,加速底物的配位结合,进而加快了酶催化反应,促进蔗糖酶活性,随暴露时间延长,Cd可能占据酶分子活性中心或结合酶分子的活性部位,导致酶活性降低。此外AHTN 是一种典型疏水有机物,与多环芳烃具有一定的相似性,能够以被动扩散的方式通过植物细胞膜,且有助于重金属Cd 进入细胞,提高了Cd的生物有效性。此外,蔗糖酶能提高易溶性营养物质在土壤中的含量,AHTN 因其疏水性导致溶解较少,土壤对AHTN 的吸附固定增加,蔗糖酶活性受到抑制。律泽研究发现佳乐麝香与Cd复合污染在前2 周促进土壤脲酶活性,之后转为显著抑制作用,与本试验结果相似。本研究中AHTN 单一及与Cd 复合污染显著抑制土壤脲酶活性。刘慧君等研究发现酰胺类除草剂使脲酶活性部位构象发生变化,二者发生结合作用,形成一个结合位点,抑制了脲酶的活性,AHTN 与脲酶分子之间可能也存在此种作用机制。WANG 等研究了丁草胺与镉复合污染对土壤磷酸酶的影响,发现两种污染物对土壤酸性磷酸酶的活性影响取决于土壤中两种污染物浓度配比,与本试验结果相似,不同浓度的AHTN 与Cd 复合污染对土壤酸性磷酸酶表现出不同的作用,100、500 mg·kgAHTN 单一污染和100 mg·kgAHTN 与Cd 复合污染促进土壤酸性磷酸酶活性,500 mg·kgAHTN与Cd 复合污染与1 000 mg·kgAHTN 单一污染对其活性由促进转为抑制,1 000 mg·kgAHTN与Cd复合污染抑制其酶活性。该结果符合周启星等提出的复合污染作用机理与污染物的种类及浓度组合、污染物的结构与性质、污染时间以及生物种类等多种因素直接相关的理论。
AHTN 与Cd 复合污染对土壤脲酶、酸性磷酸酶和蔗糖酶联合毒性效应结果不一致的原因可能是受试生物的细胞结构存在差异,对各类化合物的敏感性不同,脲酶、酸性磷酸酶和蔗糖酶分别对土壤中氮、有机磷、有机质的迁移转化敏感,应对长期暴露的污染物所产生的生理活动也不同,且耐受性存在差别,因此复合污染后对其联合毒性作用也不尽相同。本研究中,AHTN 与Cd 复合污染对土壤脲酶活性联合毒性效应在第1 天表现为拮抗作用,20 d 以后均为协同作用,该结果与陈芳等的研究结果一致,其原因可能是在暴露初期,有机物和重金属相结合,降低了重金属在环境中毒性,表现为拮抗作用,随着暴露时间延长,二者复合污染破坏了生物的细胞结构,AHTN 与佳乐麝香具有相似结构,均为脂溶性化合物,能扰乱细胞膜功能,使其逐渐丧失抵御外来物质的能力,使污染物更容易进入微生物细胞,抑制微生物的生长,并且AHTN 还会扰乱生物体的防御系统,进而增强重金属镉的毒性。此外,AHTN 能够抑制外向转运蛋白,降低细胞对外源化学物质的抵御能力,继而加剧外源物质的毒性,使联合毒性效应转变为协同作用。胡著邦等对Cd 与苄嘧磺隆复合污染的研究结果表明,随着暴露时间的延长,微生物生物量氮先上升后下降,联合效应由协同作用转变为拮抗作用,MOREAU 等认为,菲对Zn 的拮抗作用可能是因为菲改变了溶酶体膜的稳定性及功能,从而影响了溶酶体解除Zn毒害的作用。本研究酸性磷酸酶和蔗糖酶联合毒性也由协同作用转变为拮抗作用,可能是AHTN 也产生了相似作用,激活某种物质影响了Cd的毒害作用。因此对于本研究中AHTN和Cd复合污染联合毒性效应机理有待进一步的研究。
4 结论
(1)平板菌落计数结果表明,AHTN 与Cd 单一、复合污染对土壤中细菌表现为显著抑制作用;随着AHTN 浓度增加,对真菌由促进作用转变抑制作用;对土壤中放线菌均表现为显著抑制作用。AHTN 与Cd 复合污染对放线菌的抑制率大于其对应浓度AHTN 单一污染(第1天除外)。荧光qPCR 法结果表明,细菌和真菌拷贝数随AHTN 浓度升高而增加,放线菌拷贝数随AHTN 浓度升高而减少,对放线菌表现出显著抑制作用。放线菌的平板菌落计数与荧光qPCR 法得出的结论一致,即放线菌对AHTN 敏感,AHTN 对放线菌具有毒害作用,可将放线菌作为AHTN污染的早期预警指标。
(2)AHTN 单一及与Cd 复合污染对土壤脲酶活性均表现为显著抑制作用(第1 天除外);随着AHTN浓度增加,对酸性磷酸酶活性从促进作用转变为抑制作用;在第1 天对蔗糖酶表现为促进作用,之后均转为抑制作用。AHTN 与Cd 复合污染对土壤蔗糖酶抑制率大于AHTN单一污染(第1天除外)。
(3)通过比较预测值与实测值,发现AHTN 与Cd复合污染联合毒性效应对土壤细菌和放线菌数量表现为拮抗作用,对真菌数量随着AHTN浓度升高表现为拮抗-协同-拮抗现象,对土壤脲酶活性在第1天时表现为拮抗作用,20 d以后均为协同作用;对土壤酸性磷酸酶活性在60 d前表现为协同作用(第1天除外),在终点80 d表现为拮抗作用;对土壤蔗糖酶活性第1天表现为协同作用,40 d之后均为拮抗作用。