微流控装置制备植物乳杆菌微胶囊的研究
2022-09-01程海生周新丽
程海生, 彭 湉, 周新丽
上海理工大学 健康科学与工程学院,上海 200093
植物乳杆菌是一种广泛分布于发酵食品和健康人体肠道黏膜等生态位的杆状益生菌[1],是肠道微生物群中主要菌群之一,具备良好的肠胃粘附性能,能够对病原菌的生长进行抑制,从而调节消化道菌群平衡[2]。传统的生产加工中,植物乳杆菌主要以水溶液和粉末状形式存在,其活力很难得到维持或受到一定的损失。其次,在运输、存储过程中,随着时间的推移,植物乳杆菌活菌数大量减少,达不到预计的益生作用。
益生菌微胶囊技术是一种保护益生菌免受不利环境因素影响、提高其在产品中存活率的有效方法,已广泛地应用于食品行业中[3]。益生菌微胶囊的大小和单分散性对益生菌的存活率至关重要,用于益生菌微囊化的传统方法如挤压法、喷雾干燥法和乳化法等大多存在微胶囊尺寸不均一、形状不可控、生产效率低等缺点[4-6]。
液滴微流控技术是通过控制两种互不相溶的液体(连续相和分散相)的流速来实现液滴的破碎,在两相界面处的表面张力和剪切力共同作用下,将分散相以纳升、甚至皮升的体积形式分散在连续相中,从而形成尺寸分布均匀的液滴[7-9]。该技术具有液滴生成速度快、大小均匀、单分散性良好、体系封闭等特点,已广泛应用于功能性微胶囊的制备[10,11]。VINNER等人[12-14]的研究证明了液滴微流控制备益生菌微胶囊可行性。
在利用液滴微流控芯片制备微液滴的过程中,芯片通道的各种几何尺寸和两相流速都是决定微液滴生成情况的关键因素,选取合适的实验设计及统计方法,用于优化微流控芯片的几何参数和流动参数以达到最佳性能要求很有意义。本文以流聚焦液滴微流控芯片制备植物乳杆菌微胶囊,采用田口实验设计分析微流控芯片的几何参数(芯片孔口宽度、通道高度、进油口宽度、进水口宽度、通道出口宽度)及流动参数(流速比),对液滴直径大小及变异系数的影响,确定植物乳杆菌微胶囊制备芯片的最佳工艺参数。根据最优方案制作了流聚焦液滴微流控装置,以海藻酸钠、低酯果胶(多糖)和卵磷脂(脂质)为壁材原料制备植物乳杆菌微胶囊,验证其单分散性和良好的包埋率,并通过模拟胃肠道实验对所制备的微胶囊进行体外评价,验证其耐酸性和肠溶性。
1 材料与方法
1.1 材料与试验设备
菌株:植物乳杆菌CGMCC 1258(杜邦中国集团有限公司上海分公司)。植物乳杆菌接种于MRS固体液体培养基中,37 ℃培养24 h,连续传代培养2~3次完全活化待用。
材料:海藻酸钠、低酯果胶、卵磷脂、无水氯化钙、柠檬酸钠(分析纯,国药集团化学试剂有限公司);胃蛋白酶(酶活1∶10 000)、胰蛋白酶(酶活1∶250)(生工生物工程(上海)股份有限公司)。
设备:二氧化碳培养箱(MCO18AC,松下医疗器械有限公司,日本)、高压灭菌锅(HRLM-80,青岛海尔特种电器有限公司)、低温离心机(ST16r,北京赛默飞)、光学显微镜(CFI60,尼康,日本)、CO2激光雕刻机(UNIVERSAL,VLS2.30,美国)、真空贴合机(TBK-508,深圳市旺达科技有限公司)。
1.2 液滴微流控装置
液滴微流控微囊化装置如图1所示,包括两相流输送装置、微液滴生成装置、可视化装置以及收集装置等部分。两相流输送装置由两台微量注射泵和微注射器组成,通过设置注射器的注射速度调节两相流速。微液滴生成装置即微流控芯片,芯片的两入口通过聚四氟乙烯管连接至输送装置的注射器,芯片的出口端连接合适规格的聚四氟乙烯管,输送微液滴至收集装置中。收集装置采用的是50 mL的无菌离心管,且收集装置中盛交联剂CaCl2。可视化装置由一台光学显微镜、工业相机以及一台计算机组成,用于实时观测微液滴的生成情况,便于调控两相流速从而调控液滴的生成。
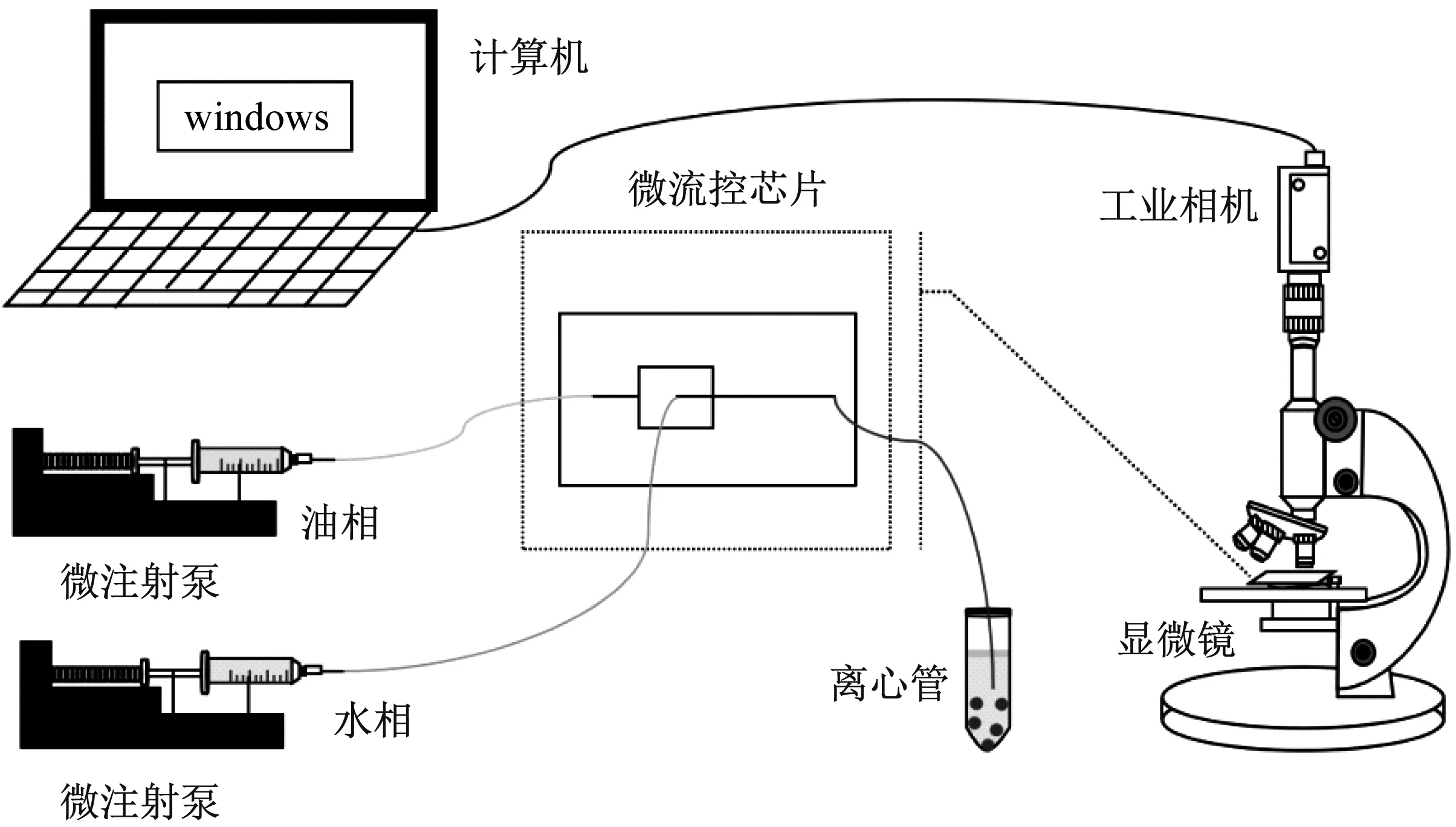
图1 液滴微流控微囊化装置
利用Auto CAD 2020分层绘制芯片的几何图形,如图2所示,芯片整理结构分为盖板层、液滴生成层以及底板层三部分,其中通道层包括两相入口,流聚焦通道以及液滴出口,为方便芯片对准贴合,在每一层基片四角都设有直径为2 mm的对准口。图2(b)所示为通道的流聚焦结构,其中包括孔口宽度Wor、通道高度H、进油口(连续相)宽度Wc、进水口(分散相)宽度Wd以及出口宽度Wo等几何参数。
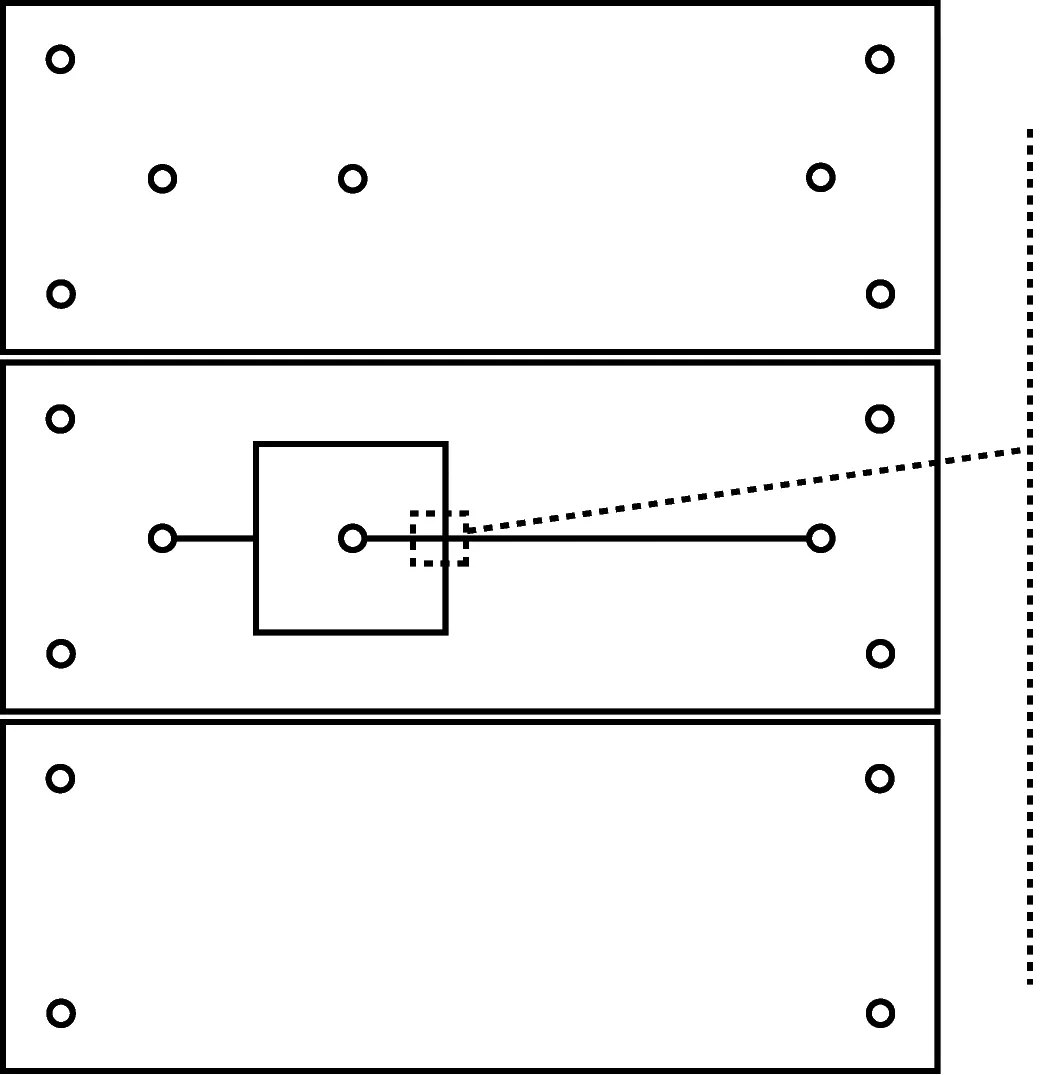
(a) 芯片各层结构矢量图

(b) 流聚焦细节图

(c) 芯片结构图图2 芯片结构图
芯片采用聚甲基丙烯酸甲酯(Polymethyl methacrylate,PMMA)材料加工,整体尺寸为80 mm×30 mm(长×宽),盖板层和底板层厚0.2 mm,将绘制好的各层芯片结构图案传输至激光雕刻机进行切割,得到各层结构基片。超声波清洗20 min后,利用真空贴合机对芯片进行键合。最后选取合适规格的针头、聚四氟乙烯管对芯片出口、入口进行插针、接管等操作,用UV紫外固化胶进行粘连密封。为了更好地形成W/O液滴,使用聚二甲基硅氧烷(Polydimethylsiloxane, PDMS)注射涂覆的方法对亲水性PMMA通道进行疏水性改性。每个参数分配了五个不同水平,最小的孔口宽度设置为75 μm,其后每个水平以25 μm的步长增加,最大增加至175 μm。按不同型号的板材将通道高度的五个水平分别设置为200 μm、300 μm、400 μm、500 μm和600 μm。为更直观的描述进油口、进水口以及出口宽度等参数与孔口宽度的变化关系,将进油口宽度、进水口宽度以及出口宽度按公式(1)—(3)归一化到孔口宽度。归一化的进油口和归一化的进水口均以0.5的步长2增加到4,归一化的出口以1的步长从2增加到6。对于给定的5个几何参数,每个参数采用5个不同的水平值,按照田口正交方法设计实验阵列,L25田口正交设计表如表1所示。

表1 芯片结构田口正交设计表及不同流速下各芯片制备微胶囊的粒径大小、变异系数
(1)
(2)
(3)

流速比是指连续相流速与分散相流速之比,如式(4)所示。将25个正交芯片分别在流速比为12、15、18、21、24的条件下制备液滴,总共进行125次实验,并统计分析液滴直径和多分散度,其中分散相流速固定为20 μL/min,对应的连续相流速为240 μL/min、300 μL/min、360 μL/min、420 μL/min、480 μL/min。
(4)
式中:Φ为流速比,Qc为连续相流速,μL/min;Qd为分散相流速,μL/min。
随机抽取微滴喷射制备等植物乳杆菌微胶囊若干,置于显微镜下拍照获取放大40倍的微胶囊照片,每组样本选取三个视野,设置三次平行实验。拍摄的照片用 Image-Pro Plus 处理软件对微胶囊粒径大小进行测量统计。
1.4 微流控制备植物乳杆菌微胶囊
根据张宇琪等的方法[15],配制海藻酸钠-卵磷脂-低酯果胶复合壁材溶液,具体组成为海藻酸钠1%(w/v),卵磷脂1%(w/v),低酯果胶0.75%(w/v)。将完全活化的菌体和复合壁材溶液按1∶4的比例混合均匀。以硅油(黏度1×10-4m2/s)为连续相,复合壁材溶液为分散相,分别用一支1 mL无菌注射器吸取菌-壁材混合液(水相),10 mL无菌注射器吸取硅油(油相),固定在泵送装置上,并通过聚四氟乙烯管连接注射器针头和芯片。之后按一定流速比例分别设置好水相速度和油相速度,通过两相剪切形成W/O液滴,出口处收集液滴至装有浓度为0.4 mol/L氯化钙溶液的无菌离心管中进行凝胶反应,静置30 min,4 000 r/min离心5 min后去油和氯化钙后收集微胶囊,用无菌生理盐水洗涤两次,再次离心收集即可得到植物乳杆菌微胶囊。
1.5 连续模拟胃肠道处理
模拟胃液(Simulated gastric juice, SGJ):配制0.2%(w/v)的NaCl溶液,用浓盐酸调整pH 1.5,加入一定量的胃蛋白酶 (1 g/100 mL,酶活力1∶10 000),过0.22 μm无菌滤膜备用。
模拟肠液(Simulated intestinal juice, SIJ):配制0.1 mol/L KH2PO4溶液,0.1 mol/L的 NaOH 溶液调整pH至7.4,加入10 g胰蛋白酶(酶活力 1∶250),完全溶解后将溶液定容至1 000 mL,过0.22 μm无菌滤膜备用。
解囊液:配制0.06 mol/L柠檬酸钠溶液,121 ℃灭菌20 min备用。
将洗净后离心收集得到的微胶囊置于预热的模拟胃液(37 ℃, pH 1.5)中,混合均匀后放置在37 ℃、200 r/min的恒温摇床温育,2 h后离心收集再转入模拟肠液(37 ℃, pH 7.4)中,同样放置在37 ℃、200 r/min的恒温摇床温育2 h,分别在0 h、0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h、4 h时取样,无菌生理盐水洗净后用解囊液溶解胶囊。采用梯度稀释平板计数法,将解囊后的菌液10倍递增梯度稀释,取3个适宜稀释梯度均匀接种在MRS固体培养基中,37 ℃倒置培养24 h,统计菌落在30~300范围内的计数平板,计算菌落总数。另外,取1 mL植物乳杆菌裸菌置于相同条件作对照组进行活菌计数。每组样品重复三次平行实验。
1.6 数据分析方法
使用方差分析(ANOVA)方法确定每个性能指标对几何参数和流动参数的敏感性,通过计算比较组间方差和组内方法,较高F值(F>1)的参数反映了更重要的主导参数。为比较25个芯片在相同流速比条件下的性能,采用ANOVA方法得到每个参数在给定流速比条件下的F值,并在5中不同流速比条件下重复这一分析。以液滴直径D和变异系数CV为评价指标,每个指标进行5次方法分析。
田口设计中信噪比(Singal-Noise,S/N)是重要的分析指标,S/N表示信号功率与噪声功率的比值,S/N越大,说明产品的品质特性越高。本研究的液滴直径变异系数越小表示液滴的单分散性越好,据此选择田中设计中期望小的特性指标的S/N分析实验结果,如式(5)所示:
(5)
式中:yi为实验中的因变量,对应液滴的变异系数CV;n代表实验的重复次数,本实验取1;S/N的变化趋势代表着变异系数CV的变化趋势,小的S/N比对应小的变异系数CV,反之亦然。
通过Minitab软件计算分析得到变异系数CV信噪比响应表。信噪比响应表中的Delta是每个因子(几何参数)的最大平均响应值和最小平均响应值之差。Minitab软件按Delta数值分大小分配秩,将秩1分配给最大的Delta值,将秩2分配给第二大的Delta值,以此类推,用于表示每个因子(几何参数)对响应(变异系数CV)的相对效应。
2 结果与讨论
2.1 流聚焦微流控芯片的参数优化
使用25组芯片在5种不同流速比条件下制备微胶囊,微胶囊的粒径大小、变异系数如表1所示。对实验数据进行方差分析,不同流速比下微囊直径和变异系数对几何参数的敏感性如图3所示。孔口宽度和通道高度是决定液滴大小的关键参数。当流速比小于18时,随着流速比的增大,液滴直径对孔口宽度的敏感性更加明显,孔口宽度的F值由25.32增加至30.05;当流速比继续增大时,其敏感性逐渐减弱,F值最低为19.98。液滴直径对通道高度的敏感性变化趋势与孔口宽度类似,不过在流速比为15时,F值取到峰值18.55。其余三个参数统计分析得到的F值非常小,表明对液滴直径的影响不显著。图3(b)所示为不同流速比对液滴变异系数的几何参数敏感性。可知孔口宽度和通道高度对液滴的变异系数的影响具有显著性,而其他三个几何参数液滴变异系数的影响不显著。

(a) 直径D
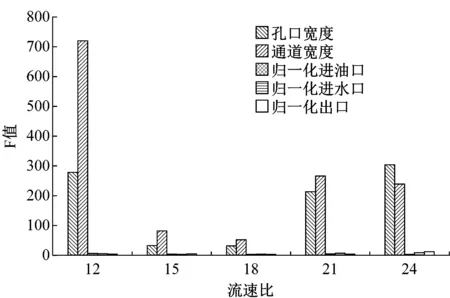
(b) 变异系数CV图3 不同流速比下微囊直径和变异系数对几何参数的敏感性
2.2 信噪比分析
田口试验设计通过对几何参数和流动参数进行优化,调整液滴微流体装置的性能。为实现这一点,通过Minitab 软件计算分析得到变异系数CV信噪比主效应图。从图4中可以看出,孔口宽度和通道高度对变异系数CV有显著的影响。五个参数对液滴直径变异系数CV影响程度的排列顺序为B(通道高度)>A(孔口宽度)>C(归一化进油口)>D(归一化进水口)>E(归一化出口)。
主效应分析研究特定参数对系统响应依赖性,主效应图清晰直观地表明实验中分类参数每个水平的平均反应。试验设计最稳健的性能参数在信噪比S/N最高点获得,如图4中所示,最佳因子水准为A2B2C4D1E5,即孔口宽度为100 μm,通道高度为300 μm,归一化进油口为3.5,归一化进水口为2,归一化出口为6时,获得最小变异系数。根据以上参数组合进行预测分析,结果显示信噪比为-10.06,标准差为 0.44 处于较为稳定的状态,CV均值表现为3.17%,小于5%满足设计要求。

(a) 孔口宽度
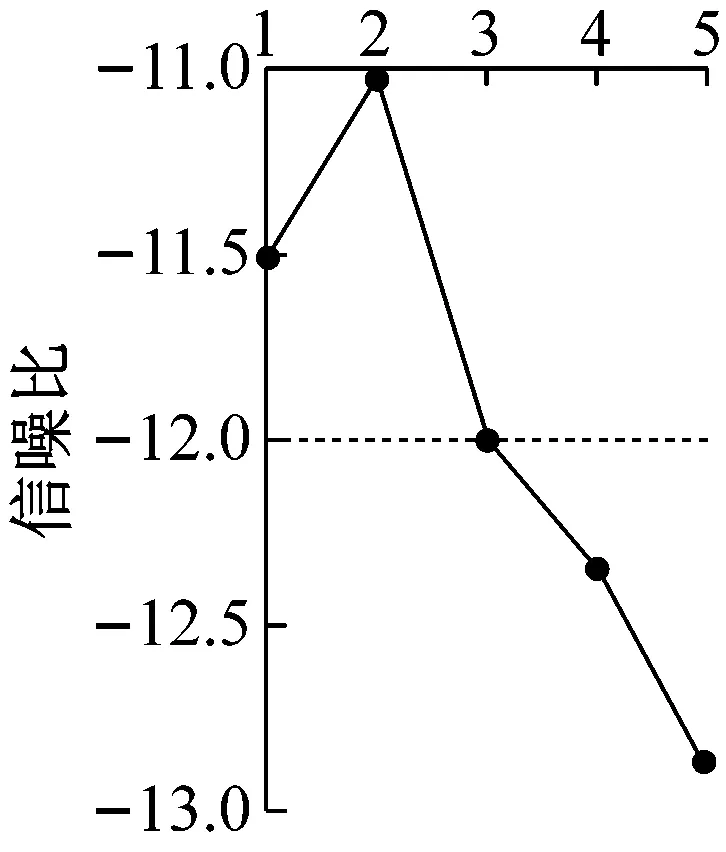
(b) 通道高度

(c) 归一化进油口

(d) 归一化进水口
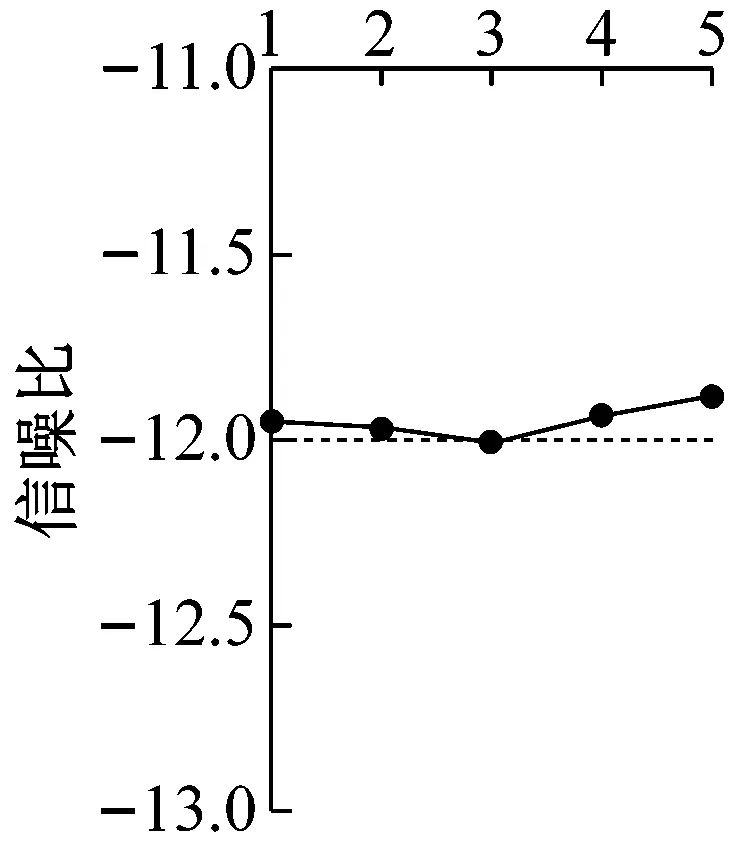
(e) 归一化出口图4 变异系数CV信噪比主效应图
2.3 植物乳杆菌微胶囊的性能
按最佳参数制备芯片并用于微胶囊的制备,其中分散相流速为20 μL/min,连续相流速为300μL/min。图5为制备所得的益生菌微胶囊及其粒径大小和分布图,从图5中可以看出微胶囊的粒径分布较为集中,统计分析得出微胶囊的平均粒径为285.42 μm,变异系数为3.61%(<5%),满足了微胶囊粒径可控、单分散性的设计要求。李龙等[16]采用内源乳化法制备植物乳杆菌微胶囊的粒径分布较广,其粒径范围为1.43 mm~3.00 mm。刘欢[17]使用喷雾干燥法对乳酸菌进行包封,制备所得的微胶囊粒径为15 μm~20 μm,但其形状普遍呈不规则状。由此可见,液滴微流控技术实现了对微胶囊形态、粒径大小及分布的精确控制,从而完成对益生菌的高效封装。

(a) 微胶囊实物图

(b) 微胶囊粒径及其分布图图5 植物乳杆菌微胶囊及其粒径大小和分布
2.4 模拟胃肠道
将制备得到的植物乳杆菌微胶囊和裸菌分别加入到模拟胃肠液中培养,得到实验结果如图6所示。在模拟胃肠液处理4 h后,裸菌及植物乳杆菌微胶囊的活菌数均不同程度地减少,而微囊化的植物乳杆菌存活率仍维持在较高水平(74.4%),活菌数可达5.46×109CFU/mL,表明微流控装置制备的尺寸均匀的微胶囊能够提供给植物乳杆菌良好的胃液保护。THANGRONGTHONG等[18]提出可以通过控制微胶囊的大小来保护益生菌免受恶劣环境的侵害,由此可见微胶囊粒径分布的均匀性也是影响益生菌抵抗胃肠道的因素之一。

图6 植物乳杆菌微胶囊及裸菌在连续模拟胃肠液中的活菌数
3 结论
传统的喷雾干燥法和乳化法等植物乳杆菌微胶囊制备方法无法很好地控制微胶囊的粒径大小及分布,不利于菌体的包埋和生长。本文以流聚焦液滴微流控芯片制备植物乳杆菌微胶囊,采用田口实验设计,分析微流控芯片的几何参数及流动参数对液滴直径大小及变异系数的影响。通过方差分析和信噪比分析确定了孔口宽度和通道高度是决定液滴大小的关键参数,能明显地影响液滴的分散性。孔口宽度为100 μm,通道高度为300 μm,归一化进油口为3.5,归一化进水口为2,归一化出口为6时,微胶囊的平均粒径为285.42 μm,变异系数为3.61%(<5%),符合单分散性的设计要求。连续模拟胃肠道实验结果证明微囊化的植物乳杆菌有较高的存活率。由此可见,通过液滴微流控装置制备的植物乳杆菌微胶囊包埋效果良好,对菌种的保护作用显著。植物乳杆菌微胶囊提高了植物乳杆菌对环境的耐受力,最大程度地发挥其益生作用。液滴微流控技术可以调节微胶囊粒径、形态结构等,提高植物乳杆菌的包埋率。下一步可以通过设计二维、三维并行化的液滴生成器,实现高通量制备植物乳杆菌微胶囊,为实现植物乳杆菌微胶囊工业化制备做准备。
