长链非编码RNA ABHD11-AS1对结直肠癌细胞生长和转移的影响及调控机制▲
2022-09-01张双龙闫一飞李庚鹏张国伟
张双龙 闫一飞 李庚鹏 张国伟
(厦门医学院附属第二医院胃肠外科,福建省厦门市 361000)
结直肠癌是临床上常见的消化道恶性肿瘤,常发生在直肠和乙状结肠交界处,具有发病特征不明显、易发生肿瘤转移、患者预后差及死亡率高等特点[1-2]。目前结直肠癌的治疗方法主要有手术、化疗、放疗等,随着肿瘤治疗技术的发展,结直肠癌的致死率降低至35%左右,但是仍然有近50%的患者死于肿瘤的远处转移[3-5]。因此,探讨结直肠癌的发生和发展机制,寻找结直肠癌治疗的新靶点至关重要。
长链非编码RNA(long noncoding RNA,lncRNA)是一类长度大于200nt的非编码RNA,种类众多,调控机制复杂[6]。越来越多的lncRNA被报告可调控肿瘤的发生和发展,其中lncRNA α/β水解酶域11反义RNA1(alpha/beta hydrolase domain-containing protein 11 antisense RNA 1,ABHD11-AS1)已经被证实可调控多种肿瘤的生长或转移,包括非小细胞肺癌、宫颈癌、卵巢癌、胰腺癌等肿瘤[7-8]。已有研究表明,ABHD11-AS1可调控miR-133a/SOX4轴来影响结直肠癌的发展[9]。还有学者发现,miR-133a可靶向调控真核起始因子4A1(eukaryotic initiation factor 4A1,EIF4A1)从而影响结直肠癌的发展[10]。目前关于ABHD11-AS1能否通过调控miR-133a/EIF4A1轴来影响结直肠癌的生长和转移的研究较少。因此,本研究探讨ABHD11-AS1对结直肠癌细胞生长、转移的影响,以及其是否通过调控miR-133a/EIF4A1轴发挥作用,旨在为结直肠癌的靶向诊治提供参考。
1 材料与方法
1.1 主要材料和试剂 人结直肠癌细胞HT-29、SW480、DLD-1、HCT116、LOVO、SW620,以及正常结直肠黏膜细胞FHC、人胚肾细胞293T均购自中科院上海细胞库。PrimeScriptTM试剂盒购自Takara公司(批号:2690A),PowerUpTMSYBRTMGreen Master Mix试剂盒、Lipofectamine 2000试剂盒、TRIzol试剂盒均购自美国Invitrogen公司(批号:C11730017、11668019、10296010),EvaGreen miRNA qPCR Master Mix试剂盒购自Abcam公司(批号:B11050),Effectene Transfection Reagent试剂盒购自QIAGEN公司(批号:301425),双荧光素酶报告基因检测试剂盒购自汉恒生物技术有限公司(批号:hsa-cand-142),EIF4A1抗体、山羊抗兔二抗、内参GAPDH抗体均购自武汉三鹰生物技术有限公司(批号:PR30012、PR30036、6004-l-Ig),孔径8 μm的Transwell小室购自康宁生命科学有限公司(批号:3422),CCK-8试剂盒、RIPA蛋白裂解液和ECL发光液购自沈阳万类生物技术有限公司(批号:WLA074、WLA016、WLA003)。lncRNA ABHD11-AS1 siRNA、EIF4A1 siRNA、Negative Control、miR-133a inhibitor、miR-133a mimic、miR-NC由苏州吉玛基因股份有限公司合成。
1.2 细胞培养 取出经液氮保存的结直肠癌细胞HT-29、SW480、DLD-1、HCT116、LOVO、SW620,以及正常结直肠黏膜细胞FHC、人胚肾细胞293T细胞,迅速解冻后转移至细胞培养皿中,使用含10%胎牛血清的RPMI-1640培养基,置于含5% CO2的37 ℃培养箱中进行培养,隔天更换细胞培养基,细胞生长至汇合率达80%~90%时进行传代。
1.3 细胞转染 将HT-29细胞分为NC组(转染Negative Control)、siABHD11-AS1组(转染lncRNA ABHD11-AS1 siRNA)、miR-133a inhibitor组(转染miR-133a inhibitor)、siABHD11-AS1+miR-133a inhibitor组(转染lncRNA ABHD11-AS1 siRNA 24 h后,再转染miR-133a inhibitor)和siABHD11-AS1+miR-133a inhibitor+siEIF4a1组(转染lncRNA ABHD11-AS1 siRNA 24 h后再转染miR-133a inhibitor 24 h后,再转染EIF4A1 siRNA),使用Lipofectamine 2000试剂盒转染lncRNA ABHD11-AS1 siRNA、EIF4A1 siRNA、Negative Control,使用Effectene Transfection Reagent试剂盒转染miR-133a inhibitor,转染24 h后收集细胞进行后续实验。Negative Control序列为(正向)5′-CAGAACGGGUCUAUACUUG-3′、(反向)5′-CAAGGUACCUACGGCAGU-3′;lncRNA ABHD11-AS1 siRNA序列为(正向)5′-CGUAAGCGUUCAUUAAGGC-3′、(反向)5′-CAAGGUGCGAUCUUAAUGC-3′;EIF4a1 siRNA序列为5′-CUGGCCGUGUGUUUGAUAU-3′;miR-133a inhibitor序列为5′-CAGCUGGUUGAAGGGGACCAAA-3′。
1.4 实时荧光定量PCR实验 分别将HT-29、SW480、DLD-1、HCT116、LOVO、SW620、FHC细胞,以及NC组和siABHD11-AS1组HT-29细胞接种至6孔板中,设置5个复孔,其中将转染24 h后的HT-29细胞培养至汇合率达80%~90%。按照TRIzol 试剂说明书的步骤提取细胞的总RNA,使用核酸定量仪(Thermo Scientific公司,型号:NanoDrop One)检测总RNA含量。参照PrimeScriptTM试剂盒说明书进行反转录,全程冰浴操作,设置反应条件为 37 ℃ 15 min、85 ℃ 5 s,4 ℃保存反应产物用于后续实验操作。lncRNA的实时荧光定量PCR实验操作参照PowerUpTMSYBRTMGreen Master Mix试剂盒说明书,以GAPDH作为内参,反应体系为包括PowerUpTMSYBRTMGreen Master Mix 10 μL、上游和下游各1 μL、DNA模板1 μL、灭菌水7 μL。反应条件为:50 ℃ 2 min; 95 ℃ 2 min、95 ℃ 15 s,40个循环;55 ℃ 15 s;72 ℃ 1 min。miR-133a的实时荧光定量PCR实验操作参照EvaGreen miRNA qPCR Master Mix试剂盒说明书,以U6作为内参,反应体系为EvaGreen miRNA Master Mix 10 μL、上游和下游引物各0.6 μL、DNA模板0.5 μL、灭菌水8.3 μL。反应条件为:96 ℃ 6 min; 94 ℃ 15 s、65 ℃ 45 s,60个循环。实验重复3次,引物序列如表1。

表1 ABHD11-AS1、GAPDH、miR-133a、U6的引物序列
1.5 双荧光素酶报告基因实验 根据miRcode数据库(http://www.mircode.org/)并参考相关文献[9],预测ABHD11-AS1与miR-133a的结合位点,设计野生型和突变型的ABHD11-AS1的3′非翻译区-荧光素酶基因表达质粒(即WT-ABHD11-AS1和MUT-ABHD11-AS1),使用Lipofectamine 2000试剂盒将上述质粒转染至293T细胞,培养24 h后,使用Effectene Transfection Reagent试剂盒分别将miR-133a mimic、miR-NC转染至293T细胞,转染24 h后,根据双荧光素酶报告基因检测试剂盒说明书检测各组细胞荧光强度,实验重复3次。
根据TargetScan数据库(https://www.targetscan.org/vert_80/)和参考相关文献[10],预测miR-133a和EIF4A1的结合位点,设计野生型和突变型的EIF4A1的3′非翻译区-荧光素酶基因表达质粒(即WT-EIF4A1和MUT-EIF4A1),使用Lipofectamine 2000试剂盒将上述质粒转染至293T细胞,培养24 h后,使用Effectene Transfection Reagent试剂盒分别将miR-133a mimic、miR-NC转染至293T细胞,转染24 h后,根据双荧光素酶报告基因检测试剂盒说明书检测各组细胞荧光强度。实验重复3次。
1.6 Western blot实验 取转染24 h后的NC组、siABHD11-AS1组、miR-133a inhibitor组、siABHD11-AS1+miR-133a inhibitor组HT-29细胞,加入200 μL RIPA蛋白裂解液,4 ℃条件下裂解30 min,然后在4 ℃下12 000 r/min离心10 min,收集上清为总蛋白,使用二喹啉甲酸蛋白定量法测定总蛋白浓度。取10 μg蛋白溶液进行SDS-PAGE,蛋白分离后转膜,使用PVDF膜封闭2 h后,然后与EIF4A1一抗(1 ∶1 000)、GAPDH(1 ∶5 000)4 ℃孵育过夜,使用TBST洗膜后加入二抗(1 ∶1 000)室温孵育1.5 h,使用TBST清洗PVDF膜后,使用ECL试剂盒配置发光液,并将PVDF膜浸入发光液中反应30 s,曝光并拍照,以GAPDH为内参,用ImageJ软件对条带灰度值进行半定量分析。实验重复3次。
1.7 细胞增殖实验 使用CCK-8法检测细胞增殖能力。取转染24 h后的NC组、siABHD11-AS1组、siABHD11-AS1+miR-133a inhibitor组、siABHD11-AS1+miR-133a inhibitor+siEIF4A1组TH-29细胞,使用含10%胎牛血清的RPMI-1640培养基将细胞稀释至5×104个/mL,将HT-29细胞接种至96孔板,100 μL/孔,每组3个复孔,37 ℃、5% CO2条件下培养,设置0 h、24 h、48 h、72 h时间点对应的96孔板,在各时间点取出对应的96孔板,每孔加入10 μL CCK-8溶液,继续培养4 h,使用酶标仪(Molecular Devices公司,型号:SpectraMax M5)检测各孔450 nm处的吸光度值。实验重复3次。
1.8 细胞迁移和侵袭实验 使用RPMI-1640培养基稀释NC组、siABHD11-AS1组、siABHD11-AS1+miR-133a inhibitor组、siABHD11-AS1+miR-133a inhibitor+siEIF4A1组的HT-29细胞至1×105个/mL,取100 μL细胞悬液接种于Transwel小室中用于检测细胞迁移,接种于铺含有50 μL Matrigel的Transwell小室中用于检测细胞侵袭,每孔1×104个细胞,每孔再加入100 μL RPMI-1640培养基,每组3个复孔,将小室放置于24孔板中,24孔板每孔加入600 μL含10%胎牛血清的完全培养基,并将上述24孔板转移至细胞培养箱中培养24 h,小室底部用PBS清洗后用无水乙醇固定30 min,然后将小室倒扣,于底部滴加结晶紫染色10 min,清洗后晾干,于显微镜下观察拍照并计数。实验重复3次。
1.9 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,两组间比较采用独立样本t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 正常结直肠黏膜细胞与人结直肠癌细胞中ABHD11-AS1表达量的比较 与正常结直肠黏膜细胞FHC相比,人结直肠癌细胞HT-29、SW480、DLD-1、HCT116、LOVO、SW620的ABHD11-AS1表达量均升高,且HT-29细胞的ABHD11-AS1表达量最高(均P<0.05),因此取HT-29细胞进行后续研究。siABHD11-AS1组HT-29细胞的ABHD11-AS1表达量低于NC组(P<0.05),提示转染siABHD11-AS1可抑制TH-29细胞中ABHD11-AS1的表达,可进行后续研究。见表1、表2。

表1 正常结直肠黏膜细胞与人结直肠癌细胞中ABHD11-AS1 mRNA相对表达量的比较(x±s)

表2 NC组和siABHD11-AS1组HT29细胞中ABHD11-AS1相对表达量的比较(x±s)
2.2 ABHD11-AS1与miR-133a的靶向关系 ABHD11-AS1与miR-133a的结合位点结果如图1所示。双荧光素酶报告基因检测结果显示,转染MUT-ABHD11-AS1+miR-NC的细胞和转染MUT-ABHD11-AS1+miR-133a mimic的细胞的相对荧光强度差异无统计学意义(P>0.05),而转染WT- ABHD11-AS1+miR-133a mimic的细胞相对荧光强度低于转染WT-ABHD11-AS1+miR-NC的细胞(P<0.05),表明ABHD11-AS1可与miR-133a结合,见表3。siABHD11-AS1组HT-29细胞中miR-133a表达量高于NC组(P<0.05),见表4。

图1 ABHD11-AS1和miR-133a的结合位点

表3 ABHD11-AS1与miR-133a靶向关系的双荧光素酶报告基因实验结果(x±s)

表4 NC组和siABHD11-AS1组HT29细胞miR-133a相对表达量的比较(x±s)
2.3 EIF4A1与miR-133a的靶向关系 miR-133a和EIF4A1的结合位点如图2所示。双荧光素酶报告基因检测结果显示,转染MUT- EIF4A1+miR-NC的细胞和转染MUT- EIF4A1+miR-133a mimic的细胞的相对荧光强度差异无统计学意义(P>0.05),但转染WT- EIF4A1+miR-133a mimic的细胞相对荧光强度低于转染WT-EIF4A1+miR-NC的细胞(P<0.05),说明EIF4A1为miR-133a的靶基因,见表5。

图2 miR-133a和EIF4A1的结合位点

表5 EIF4A1与miR-133a靶向关系的双荧光素酶报告基因实验结果(x±s)
2.4 各组HT-29细胞EIF4A1蛋白表达量的比较 Western blot检测结果显示,miR-133a inhibitor组HT-29细胞EIF4A1蛋白表达量高于NC组(P<0.05)。siABHD11-AS1组HT-29细胞EIF4A1蛋白表达量低于NC组,而siABHD11-AS1+miR-133a inhibitor组HT-29细胞的EIF4A1蛋白表达量高于siABHD11-AS1组(均P<0.05)。见图3、表6、表7。
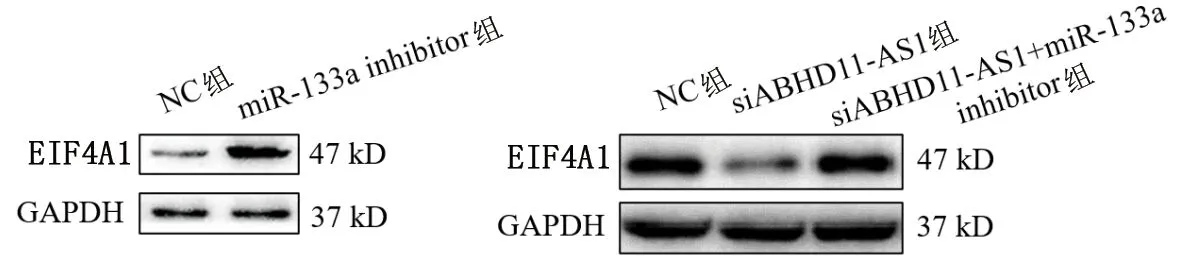
图3 各组HT-29细胞EIF4A1蛋白的表达情况

表6 NC组和miR-133a inhibitor组HT-29细胞中EIF4A1蛋白相对表达量的比较(x±s)

表7 NC组、siABHD11-AS1组和siABHD11-AS1+miR-133a inhibitor组HT-29细胞EIF4A1蛋白相对表达量的比较(x±s)
2.5 各组HT-29细胞增殖能力的比较 CCK-8检测结果显示,干预24 h、48 h、72 h后,siABHD11-AS1组HT-29细胞吸光度值低于NC组,siABHD11-AS1+miR-133a inhibitor组HT-29细胞吸光度值均高于siABHD11-AS1组,而siABHD11-AS1+miR-133a inhibitor+siEIF4A1组HT-29细胞吸光度值均低于siABHD11-AS1+miR-133a inhibitor组(均P<0.05)。见表8。
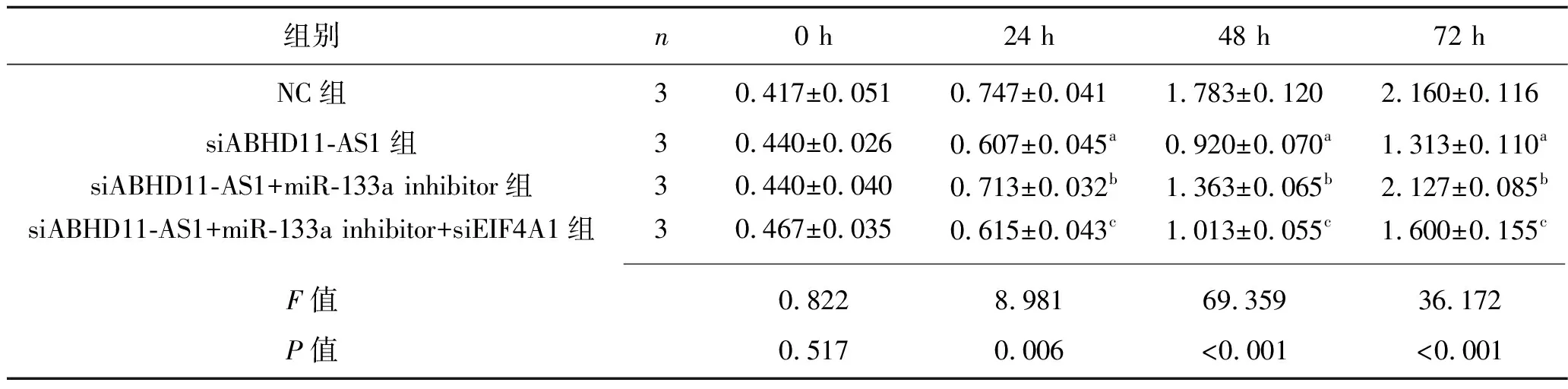
表8 各组HT29细胞吸光度值的比较(x±s)
2.6 各组HT-29细胞迁移和侵袭能力的比较 相较于NC组,siABHD11-AS1组HT-29细胞的迁移数和侵袭数均减少,siABHD11-AS1+miR-133a inhibitor组HT-29细胞的迁移数和侵袭数均多于siABHD11-AS1组,而siABHD11-AS1+miR-133a inhibitor+siEIF4A1组HT-29细胞的迁移数和侵袭数均少于siABHD11-AS1+miR-133a inhibitor组(均P<0.05)。见图4、表9。

图4 各组HT29细胞迁移数和侵袭数的比较(×20)

表9 各组HT29细胞迁移数和侵袭数的比较(x±s)
3 讨 论
目前,结直肠癌主要的治疗方法有手术治疗、化疗和放疗。虽然近几年来结直肠癌患者的预后不断得到改善,治疗后患者的生存率可提高至60%左右,但是由于结直肠癌的早期病理特征不明显,患者在确诊时即已处于中晚期,错过了手术治疗的最佳时期;同时,约20%的患者在确诊时即出现肿瘤转移,无法进行手术治疗;此外,手术治疗后患者5年内肿瘤复发率高达30%,化疗和放疗虽然可用于转移和复发的患者,但是耐药等问题严重影响治疗效果[11-12]。因此,深入研究结直肠癌生长和转移的机制,发现更多可用于结直肠癌诊断和治疗的生物标志物,对于改善结直肠癌患者的预后具有重要意义。
随着基因芯片和基因测序技术的发展,越来越多的非编码RNA被发现具有调控肿瘤生长、转移、耐药、免疫逃逸等病理进程的生物学功能。其中,lncRNA是一类长度大于200nt的非编码RNA,并且lncRNA能够参与调控机体的多种生物学功能,但调控机制复杂,其主要是作为支架或向导调控蛋白与基因之间相互作用,通过“海绵”的方式与miRNA相结合,作为增强子调控其下游靶基因的转录等。已有研究报告,在肿瘤的发生和发展过程中,lncRNA可调控多种肿瘤的增殖、侵袭、迁移等[13-14]。在结直肠癌中,lncRNA TINCR可通过调控miR-107/CD36信号轴而影响结直肠癌的增殖和凋亡[15-16],lncRNA cCSC1可通过调控miR-124-3p/CD44轴而促进结肠癌的增殖[17]。因此,lncRNA有望成为结直肠癌的新型诊断标志物及治疗靶点。lncRNA ABHD11-AS1已经被发现在多种肿瘤的发生和发展中发挥重要的调控作用。例如,ABHD11-AS1通过调控细胞周期蛋白D1的表达以促进子宫内膜癌细胞增殖与迁移[18];ABHD11-AS1可作为早期诊断胰腺癌的指标[19];ABHD11-AS1通过调控miR-1301-3p/信号转导子和转录激活子3轴和磷酸肌醇-3-激酶/蛋白激酶B信号通路,从而促进甲状腺乳头状癌的进展[20];ABHD11-AS1通过调控miR-199a-5p/溶质转运蛋白家族1成员5轴而影响甲状腺乳头状癌的进程[21]。但是,有关ABHD11-AS1在结直肠癌中的表达情况,以及其对结直肠癌发生、发展的影响的研究较少,因此,本研究探究ABHD11-AS1对结直肠癌生长和转移的影响及可能调控机制。
本研究结果显示,ABHD11-AS1高表达于结直肠癌细胞系HT-29、SW480、DLD-1、HCT116、LOVO、SW620(均P<0.05),这提示ABHD11-AS1可能对结直肠癌的发生具有调控作用。此外,通过转染siRNA抑制HT-29细胞中ABHD11-AS1的表达后,结直肠癌细胞的增殖、迁移和侵袭能力均下降(均P<0.05),说明ABHD11-AS1具有调控肿瘤生长和转移的功能。lncRNA的主要调控机制为,与miRNA相结合后作为增强子调控其下游靶基因的转录。本研究通过数据库预测及双荧光素酶报告基因实验验证了ABHD11-AS1可与miR-133a结合。Wang等[22]的研究表明,miR-133a的表达抑制与结直肠癌患者的不良预后密切相关;Dong等[23]亦发现miR-133a可作为结直肠癌的抑制因子。本研究中,siABHD11-AS1组HT-29细胞中miR-133a表达高于NC组(P<0.05),即抑制ABHD11-AS1的表达可上调HT-29细胞中miR-133a的表达。因此,我们推测ABHD11-AS1或可通过抑制miR-133a的表达来促进结直肠癌的病理进程。在本研究中,我们通过转染siRNA抑制HT-29细胞中ABHD11-AS1的表达后再抑制miR-133a的表达,发现HT-29细胞的增殖、迁移和侵袭能力增强,这进一步表明ABHD11-AS1可通过调控miR-133a的表达而影响结直肠癌细胞的增殖、迁移和侵袭能力。
miRNA是一类长度为19~24 nt的非编码单链RNA,其通过碱基互补配对的方式与靶基因的3′-非翻译区部分或完全互补,剪切靶基因的转录产物或抑制转录产物的翻译,从而起到在转录后调控靶基因表达的作用[24]。本研究通过数据库预测了miR-133a和EIF4A1的结合位点,然后通过双荧光素酶报告基因实验验证了EIF4A1为miR-133a的靶基因。EIF4A1亦与肿瘤发生和进展密切相关,例如EIF4A1的表达与乳腺癌中的恶性程度和不良预后呈正相关[25]。本研究结果显示,抑制miR-133a后HT-29细胞中的EIF4A1蛋白表达上调(P<0.05);抑制ABHD11-AS1表达后HT-29细胞中的EIF4A1蛋白表达下调,但先抑制ABHD11-AS1表达再抑制miR-133a的表达,HT-29细胞中的EIF4A1表达反而上调(P<0.05)。这表明ABHD11-AS1可调控miR-133a/EIF4A1信号轴,进而调控结直肠癌细胞的增殖、迁移和侵袭能力。
综上所述,ABHD11-AS1在结直肠癌细胞中呈高表达,并且抑制ABHD11-AS1后,结直肠癌细胞的增殖、迁移和侵袭能力均显著下降, 其可能通过调控miR-133a/EIF4A1信号轴发挥作用。但是ABHD11-AS1在结直肠癌患者肿瘤组织中的表达,以及ABHD11-AS1是否可作为结直肠癌诊断和治疗的新靶点,还需要进一步探究。
(致谢:感谢厦门医学院基础医学部李良华老师在实验上给予的帮助)
