苯并噻唑离子液体的合成及其在间氯苯甲醛乙二醇缩醛反应中的应用
2022-09-01梁秋月戎有明马全红周建成李乃旭
梁秋月 王 楠 戎有明 马全红 周建成, 李乃旭,*
(1. 东南大学 化学化工学院,江苏 南京 211189; 2. 中微纳米功能材料研究院有限公司,江苏 南京 210044)
缩醛是一类重要的有机化合物,除了用作有机溶剂,还因其特殊的化学稳定性常常被用作羰基保护剂,用于如糖类、脂类、甾类化合物以及复杂的天然产物全合成等过程[1]。此外,缩醛类化合物还是一类非常重要的有机化工原料,广泛用于香料、医药、食品加工、烟草、涂料和化妆品等化工生产领域[2]。
以间氯苯甲醛和乙二醇为原料通过缩醛反应得到的乙二醇缩间氯苯甲醛是一类重要的化工中间体,可以与金属盐化合物反应生成多种重要化工原料。例如,与甲醇钠反应生成的乙二醇缩间甲氧基苯甲醛是合成新型抗心血管类药物盐酸可乐定关键性中间体甲氧基苯甲醇的原料[3];与苯酚钠反应得到的间苯氧基苯甲醛是合成新型环保农药拟除虫菊酯的重要中间体[4]。因此,提高乙二醇缩间氯苯甲醛的收率对下游众多化工中间体的合成具有极大意义。
缩醛反应是典型的酸催化反应,在Brønsted酸和Lewis酸的酸位点上均能够进行。目前工业上常见的催化剂多为均相催化剂,包括硫酸、盐酸、对甲苯磺酸等[5-8]。虽然传统均相催化剂价格低廉,使用方便。但是该类催化剂腐蚀性很强,且很难回收再利用,在后处理过程中都会产生废水,对环境造成污染。目前,间氯苯甲醛乙二醇缩醛较为成熟的生产工艺采用的多为硫酸、对甲苯磺酸等均相催化剂。虽然催化剂成本低廉、催化效果好,但不可避免地需要在反应结束后中和催化剂,增加了生产工序和三废[9]。因此,成本低、条件温和、适用范围广泛的简单催化体系成为缩醛反应的研究重点。目前已经报道的催化剂有固体超强酸[10]、分子筛[11]、蒙脱土[12]、离子交换树脂[13]等,均取得了一定效果。
离子液体是一种新型环境友好的液体酸催化剂,同时拥有液体酸的高活性和固体酸不挥发的优点。此外,离子液体具有高度的结构可调性、热稳定性高以及可在反应后和产物自动分离等优势,因此在电化学、催化剂、有机合成、材料等领域得到重点的关注和研究[14-17]。传统的咪唑基[18]、吡啶基类离子液体虽然催化效果好,但存在着催化剂用量大、价格昂贵、有毒等缺点,这些缺点制约了离子液体催化剂在工业生产中的应用[19]。苯并噻唑与咪唑、吡啶结构相似,但其成本低廉,具有开发意义。
本文以苯并噻唑与硫酸为原料制备离子液体催化剂,并将其应用于缩醛反应。通过一系列单因素实验考查其在间氯苯甲醛与过量的乙二醇反应合成乙二醇缩间氯苯甲醛的催化效果,确定反应的最佳操作条件,并验证离子液体的重复使用性。
1 实验部分
1.1 主要试剂与仪器
试剂:甲苯、硫酸,南京试剂公司;乙二醇,上海凌峰化学试剂公司;苯并噻唑、间氯苯甲醛,化学纯,中国国药集团。
仪器:FTIR360,美国Nicolet公司;AVANE400NMR(600 MHz)核磁共振仪,瑞士Brucker公司;AGILENT6820GC型气相色谱仪,美国Agilent公司;DTG-60AH型热重分析仪,日本Shimadzu公司。
1.2 苯并噻唑离子液体的制备
苯并噻唑离子液体[HBth]-HSO4的制备反应如图1所示。
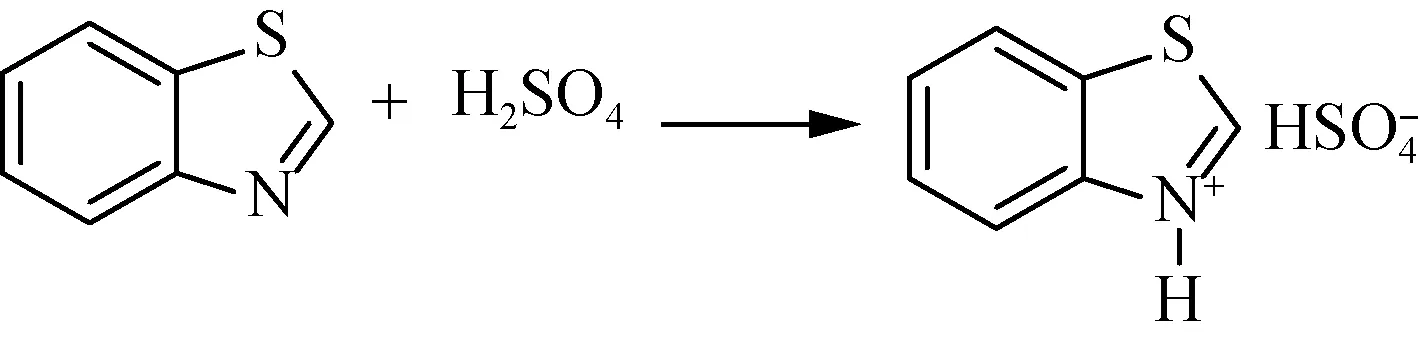
图1 苯并噻唑离子液体的合成
具体操作步骤为:在带有机械搅拌的250 mL三口烧瓶中加入13.5 g(0.10 mol)苯并噻唑和50 mL无水乙醇,将三口烧瓶置于冰水浴中,冷却至0~5 ℃,在剧烈搅拌下于30 min内缓慢滴加11.0 g(0.11 mol)浓硫酸,滴毕,室温下搅拌3 h。减压蒸馏除去溶剂,残余物用乙酸乙酯洗涤三次,并用无水乙醇重结晶,冷却到0 ℃,用布氏漏斗过滤,滤饼真空干燥一定时间后即得离子液体苯并噻唑硫酸氢盐([HBth]-HSO4),产品为白色针状晶体,产率91%。1H NMR (600 MHz, DMSO-d6)δ:9.43 (s, 1H), 8.24~8.14 (m, 1H), 8.09 (ddd,J=8.1, 1.3, 0.6 Hz, 1H), 7.55(ddd,J=8.3, 7.2, 1.3 Hz, 1H), 7.49 (ddd,J=7.8, 7.2, 1.2 Hz, 1H)。
1.3 间氯苯甲醛乙二醇缩醛的合成
以间氯苯甲醛和乙二醇为原料得到乙二醇缩间氯苯甲醛,方程式如图2所示。

图2 缩醛反应方程式
反应具体流程如下:在装有分水器、温度计和回流冷凝器的100 mL三口烧瓶中按比例加入间氯苯甲醛、乙二醇、酸性离子液体催化剂及带水剂甲苯,加热搅拌,使反应体系保持回流,不再有水生成时结束反应。此时离子液体与反应体系分层,待温度降至50 ℃ 以下,分出上层液体,用氢氧化钠溶液、半饱和食盐水依次水洗、常压蒸馏、得到具有果香味的无色透明液体,即为产品。
2 结果与讨论
2.1 离子液体催化剂的表征
2.1.1 离子液体的FT-IR图谱表征
[HBth]-HSO4离子液体催化剂的FT-IR谱图如图3(a)所示。1 055 cm-1处为C-N伸缩振动吸收峰,592 cm-1的吸收峰代表C-S的伸缩振动。而1 430 和1 222 cm-1分别为O=S=O的非对称伸缩振动峰和对称伸缩振动峰,3 500 cm-1附近的宽峰则是O-H的伸缩振动峰。这些特征峰说明了[HBth]-HSO4离子液体催化剂的成功制备。
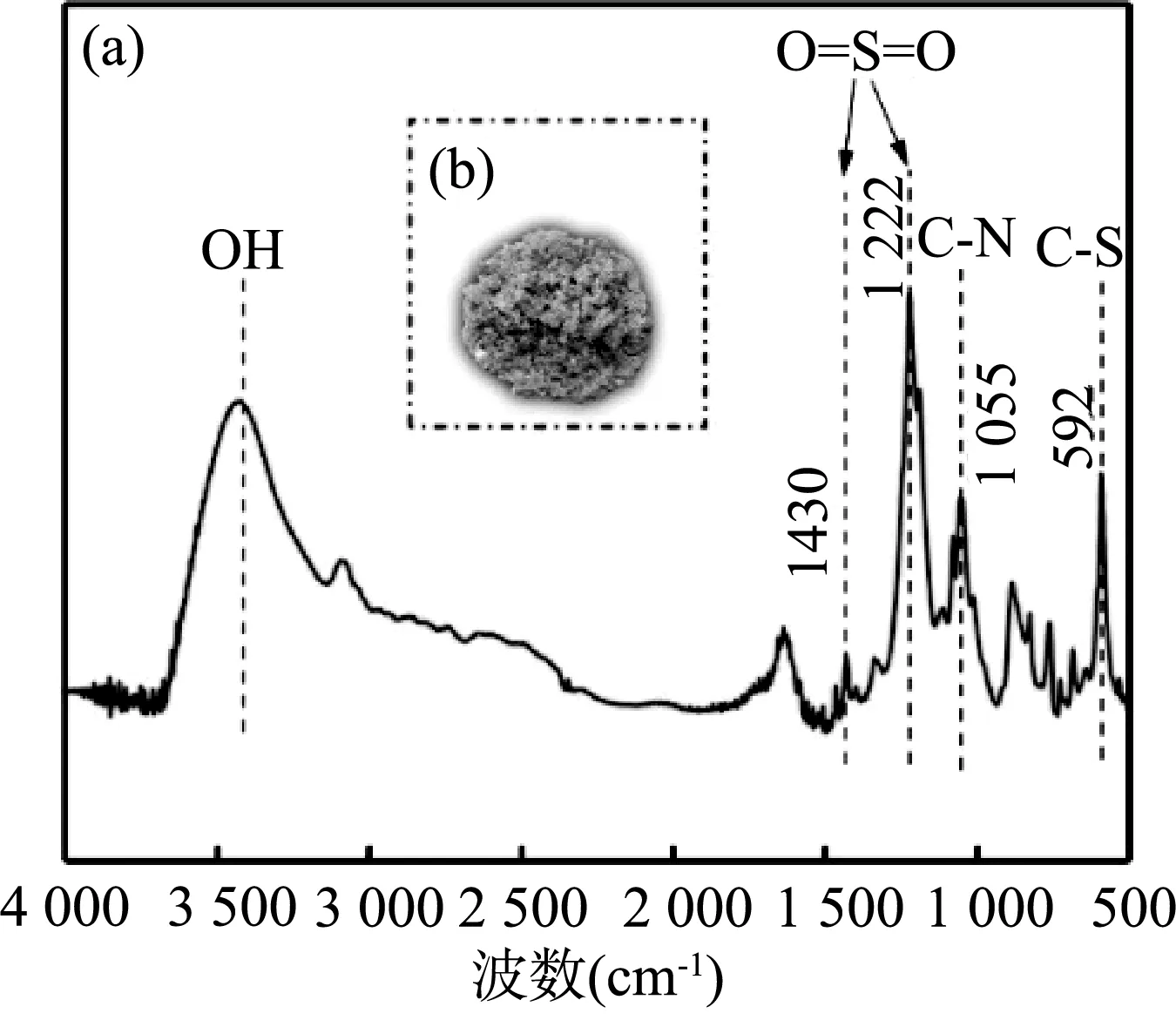
图3 (a)[HBth]-HSO4的FT-IR谱图,(b)[HBth]-HSO4的实物图
2.1.2 催化剂酸性
缩醛反应作为酸催化的可逆反应,其反应进行的程度与催化剂酸性的强弱有直接关系。将离子液体与硫酸两种催化剂配制成不同浓度的水溶液,通过pH计进行测量,其结果如表1所示。
从表1可知,随着浓度的增加,体系的pH值随之减小。与浓硫酸相比,[HBth]-HSO4的pH值略高,但整体上较为接近。
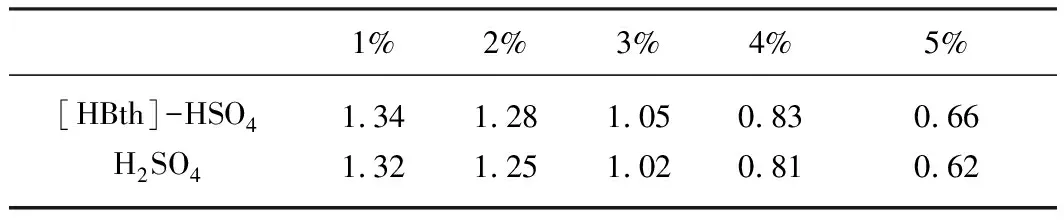
表1 离子液体的pH值
2.1.3 离子液体的溶解性分析
分别以甲醇、乙醇、乙醚、甲苯、氯仿、正己烷、丙酮及水为溶剂,考察离子液体的溶解性。溶解度标准参照《中国药典》,并以易溶、溶解、略溶、微溶、几乎不溶或不溶来描述其溶解性[20]。离子液体的溶解性分析结果见表2。
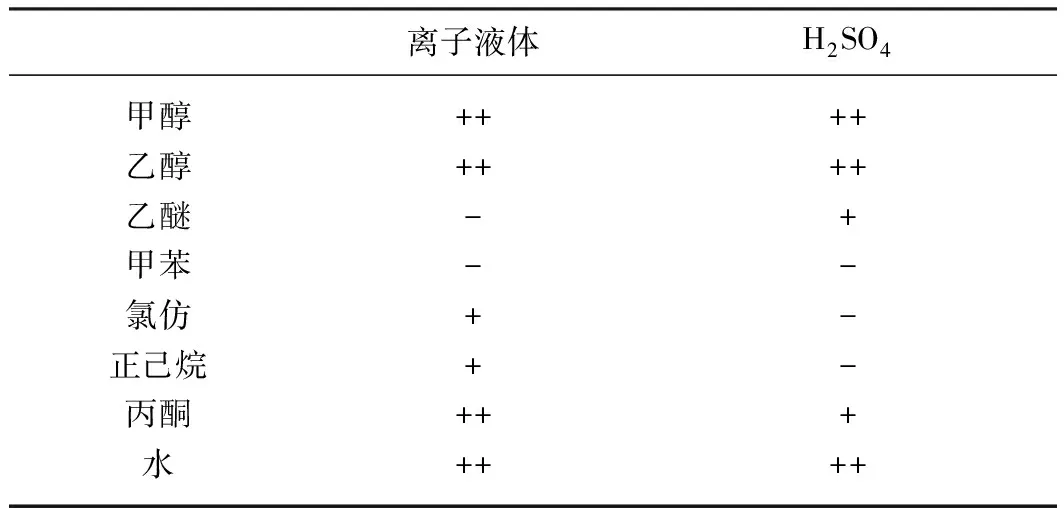
表2 离子液体的溶解性
由表2可知,离子液体催化剂在非极性溶剂中溶解性较差,而在极性较大的溶剂中溶解性较好。与浓硫酸相比,[HBth]-HSO4与缩醛不相溶,因此在反应结束后,能够与产物自动分离,通过简单的过滤就能够回收催化剂。在生产中能够简化产物后处理这个步骤,提高生产效率。
2.1.4 热重分析
通过DTG-60AH型热重分析仪测试[HBth]-HSO4离子液体的热稳定性,在氮气氛围以10 ℃/min的升温速率从30 ℃升温至600 ℃进行测试,TG及DTG结果如图4所示。
离子液体的分解温度主要取决于其阴、阳离子之间的作用力及其本身含水量,作用力越大含水量越小,离子液体越稳定。如在失重过程中没有原料及其它杂质峰出现,则说明制备的离子液体几乎不挥发,同时纯度较高。
由图4可知,[HBth]-HSO4离子液体在180 ℃之前基本没有损失,说明在该温度下催化剂非常稳定。在250~400 ℃出现明显质量损失(质量损失率为62%),说明样品开始分解,且在320 ℃左右达到最大分解速率,这可能是由于苯并噻唑环和阴离子的结构遭到破坏。
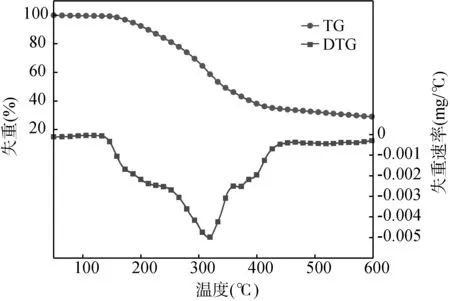
图4 离子液体催化剂的TGA曲线
缩醛反应在110 ℃左右条件下进行,故合成的催化剂能够在反应体系中稳定存在,并发挥催化作用,同时为反应提供一个较大的可操作温度范围。
2.2 离子液体催化剂在缩醛反应中的应用
2.2.1 催化剂用量的影响
在间氯苯甲醛用量0.1 mol、乙二醇用量 0.15 mol、带水剂甲苯用量0.2 mol和回流反应时间3 h的条件下,考察[HBth]-HSO4催化剂用量对缩醛反应的影响,结果如图5所示。
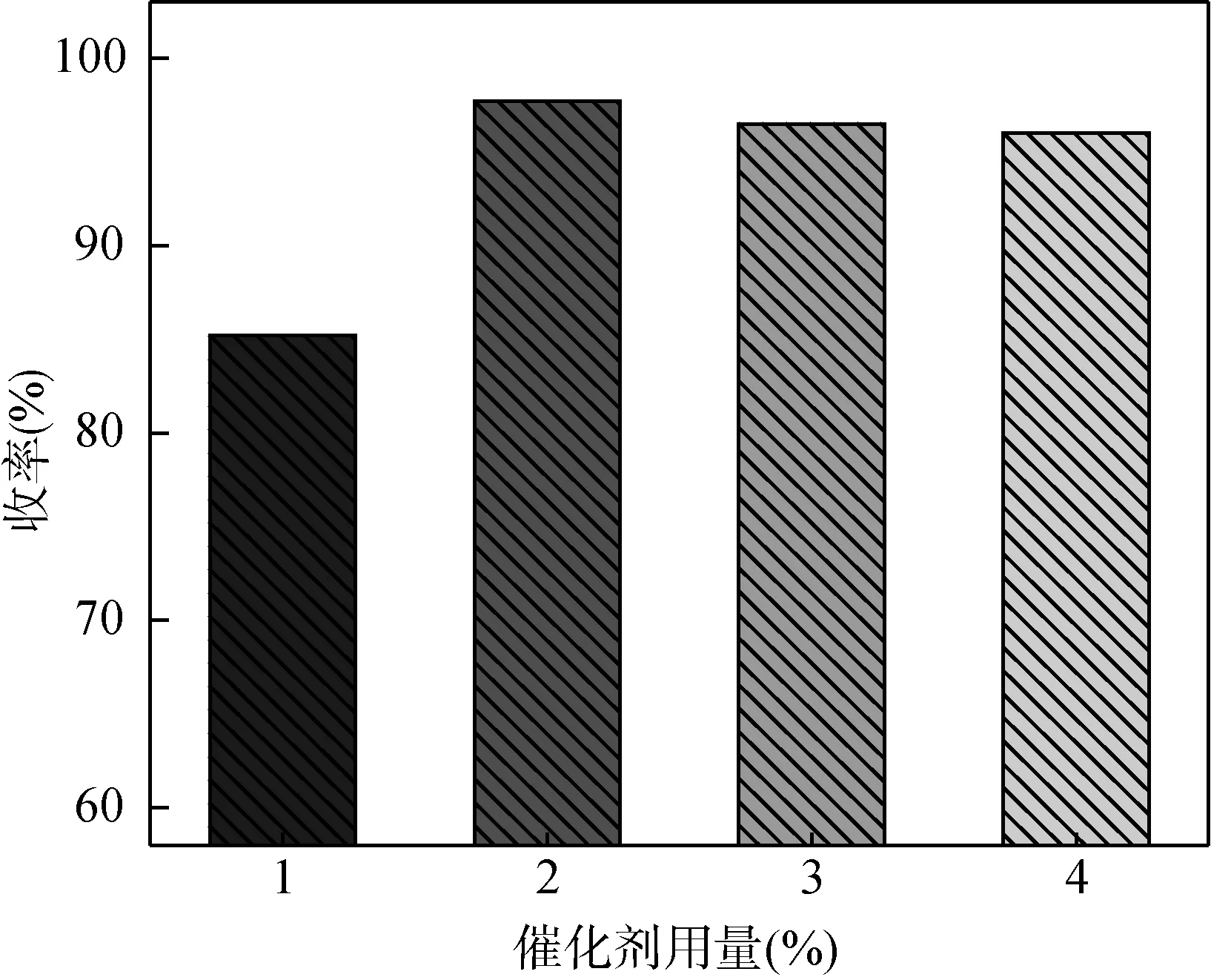
图5 催化剂用量对收率的影响
从图5可以看出,催化剂用量对产物收率影响较大。在催化剂用量较低时,收率随着催化剂用量的增加而提高,这主要是由于催化剂用量增加能提供更多活性中心。当催化剂用量为间氯苯甲醛物质的量的2%时,收率达到最高(97.7%)。但随着催化剂用量的进一步增加,产物的收率却呈现出下降的趋势,这可能是由于缩醛反应为可逆反应,催化剂用量增加,促进主反应发生的同时也促进了逆反应的发生[21]。因此该反应较适宜的[HBth]-HSO4催化剂用量为间氯苯甲醛的2%。
2.2.2 原料配比的影响
在间氯苯甲醛用量0.1 mol,[HBth]-HSO4离子液体催化剂用量为间氯苯甲醛的物质的量的2%,带水剂甲苯用量0.2 mol和回流反应时间3 h的条件下,考察原料配比对缩醛反应的影响,结果如图6所示。
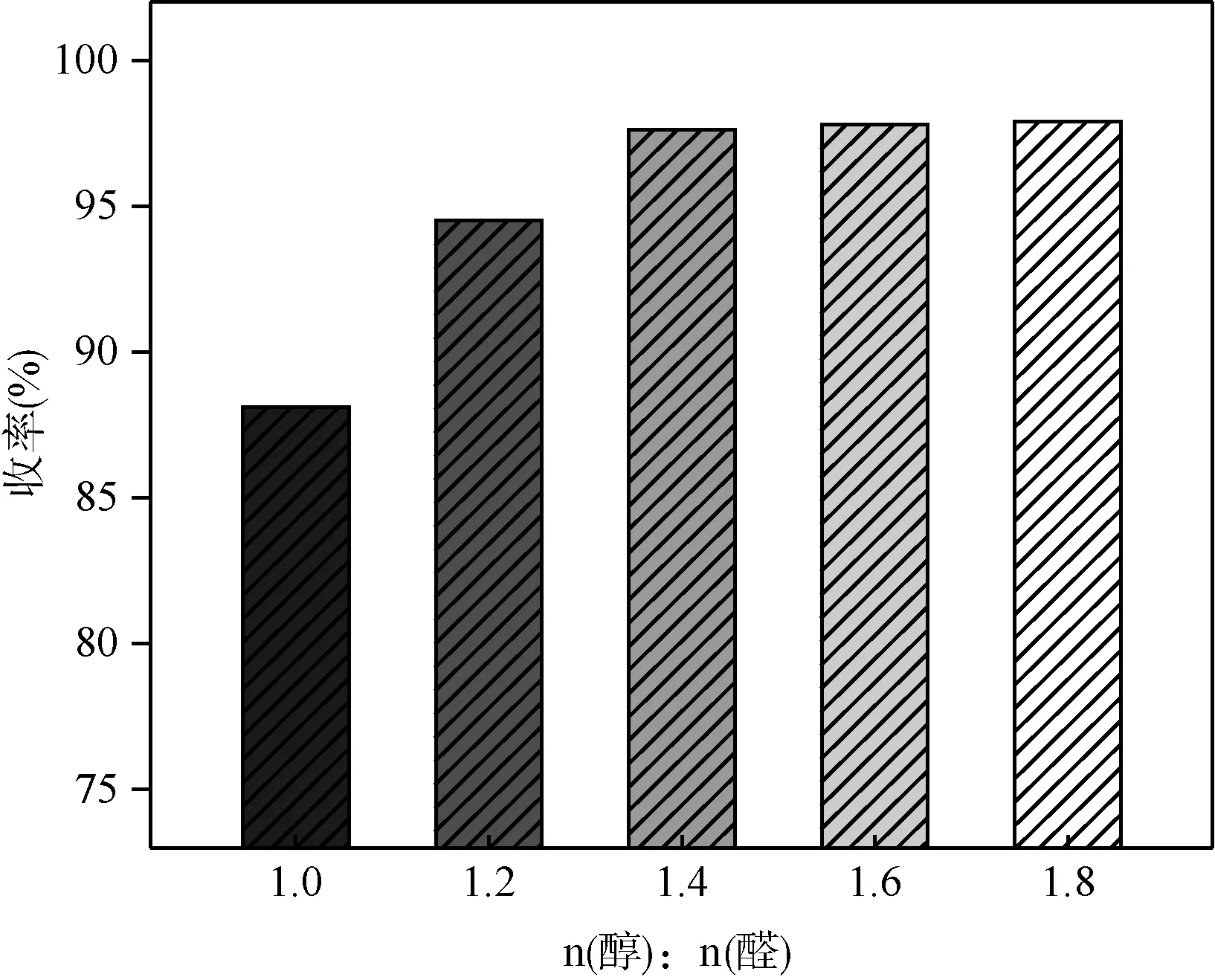
图6 原料配比对收率的影响
当乙二醇用量较小时,收率随着乙二醇用量增大而提高。这是因为缩醛反应是可逆反应,增加乙二醇用量有利于反应向正方向进行。当乙二醇用量为间氯苯甲醛用量的1.4倍时,收率达到最高(97.6%),继续增大乙二醇用量,收率增加不明显,还可能加剧乙二醇分子间脱水的副反应,同时乙二醇的过量投入,势必造成资源浪费和成本的增加,因此,乙二醇和间氯苯甲醛较适宜的摩尔比为1.4∶1。
2.2.3 带水剂用量的影响
甲苯作为带水剂具有沸点较高、在水中溶解度较小等优势。在间氯苯甲醛用量0.1 mol、乙二醇用量0.14 mol、[HBth]-HSO4离子液体催化剂用量为间氯苯甲醛物质的量的2%和回流反应时间3 h的条件下,考察带水剂甲苯用量对间氯苯甲醛与乙二醇缩醛化反应的影响,结果如图7所示。
由图7可知,随着甲苯用量的增加,收率也相应提高。当带水剂用量为间氯苯甲醛用量的2倍时,收率达到96.5%,但随着带水剂用量的继续增加,收率略降。这可能是由于带水剂增加导致催化剂及反应原料在体系中的含量降低,原料分子之间的碰撞减少,发生反应的几率减小,收率降低,因此带水剂甲苯适宜的用量为0.2 mol。
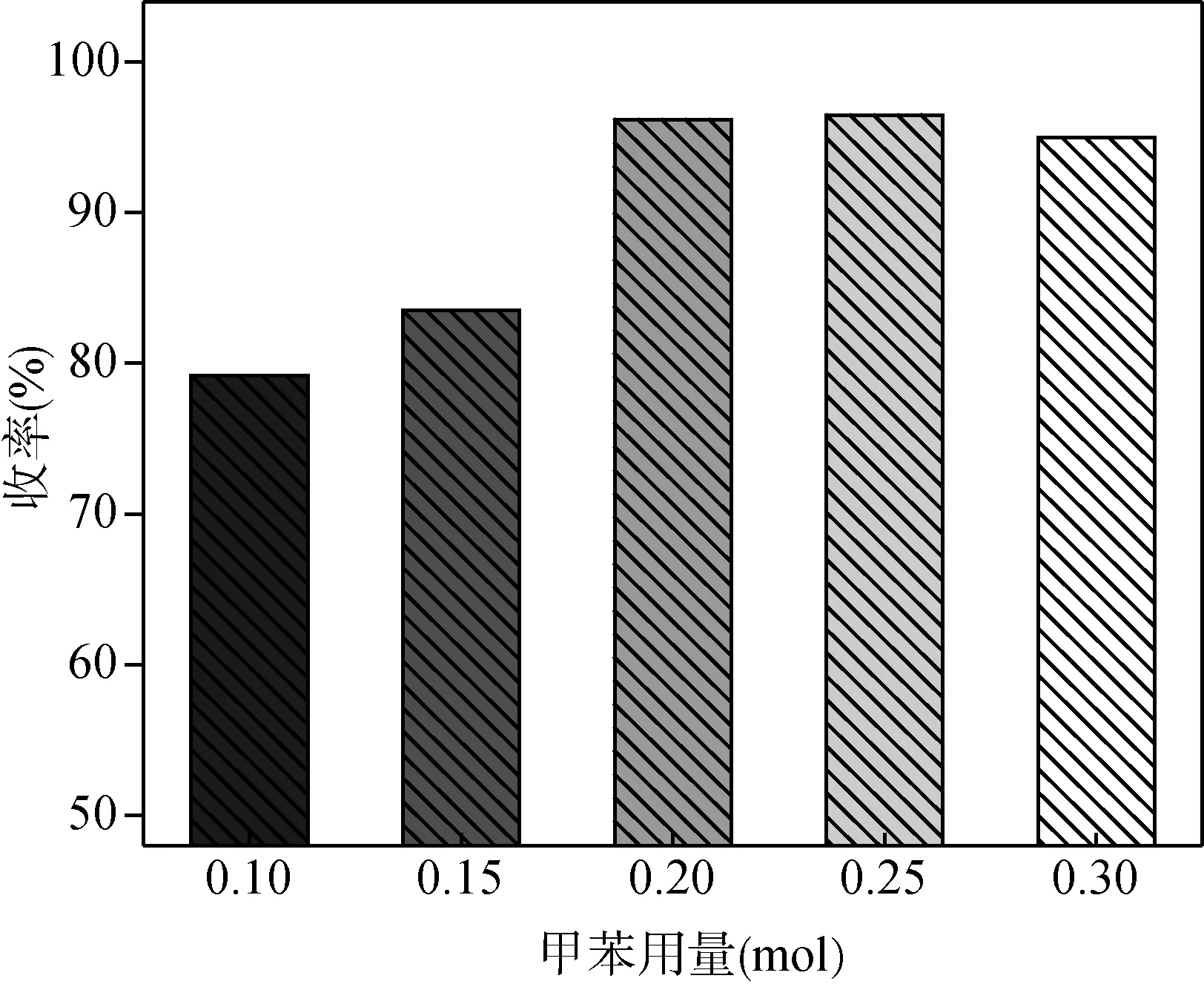
图7 甲苯用量对收率的影响
2.2.4 反应时间
缩醛反应在反应过程中不断生成水,通过带水剂将水从体系中分离,因此分水速度决定了反应时间。在间氯苯甲醛用量0.1 mol、乙二醇用量 0.14 mol、催化剂用量为间氯苯甲醛物质的量的2%和带水剂甲苯用量0.2 mol的条件下,考察回流反应时间对缩醛反应的影响,结果如图8所示。
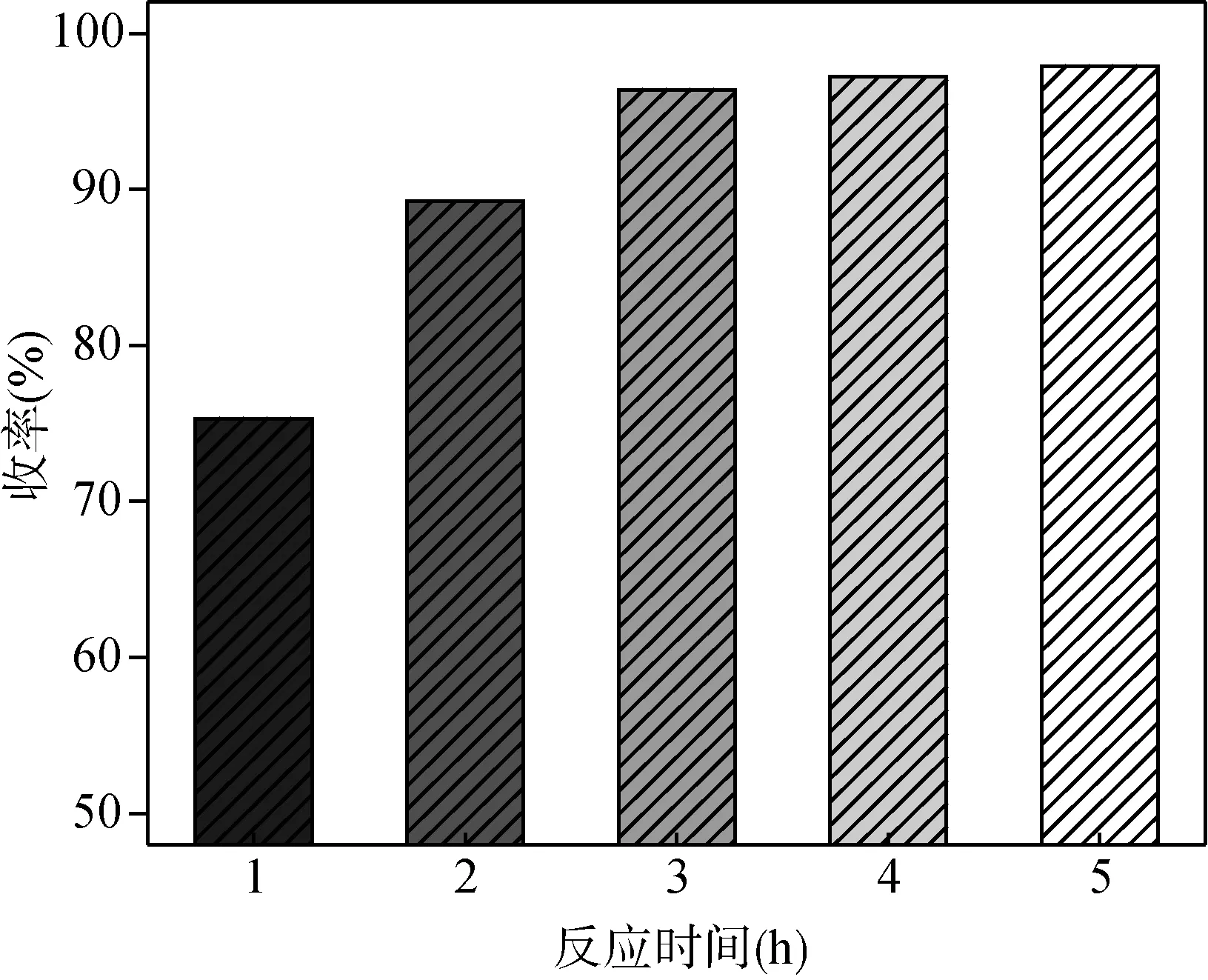
图8 反应时间对收率的影响
从图8可以看出,随着回流反应时间的增加,产物收率明显提高。当反应时间达到2 h,收率就已经超过90%。当反应时间超过3 h,收率达到97%。继续延长反应时间,收率变化不大,因此适宜的反应时间为3 h。
2.2.5 催化剂重复使用性能
离子液体较传统催化剂的显著优点是可以循环使用。由于溶解性的原因,在反应结束后离子液体与产物自动分层,通过简单的操作即可实现催化剂的回收再利用。在间氯苯甲醛用量0.1 mol、乙二醇用量 0.14 mol、催化剂用量为间氯苯甲醛物质的量的2%、带水剂甲苯用量0.2 mol、反应时间3 h的条件下,考察离子液体的重复使用性能,结果如图9所示。
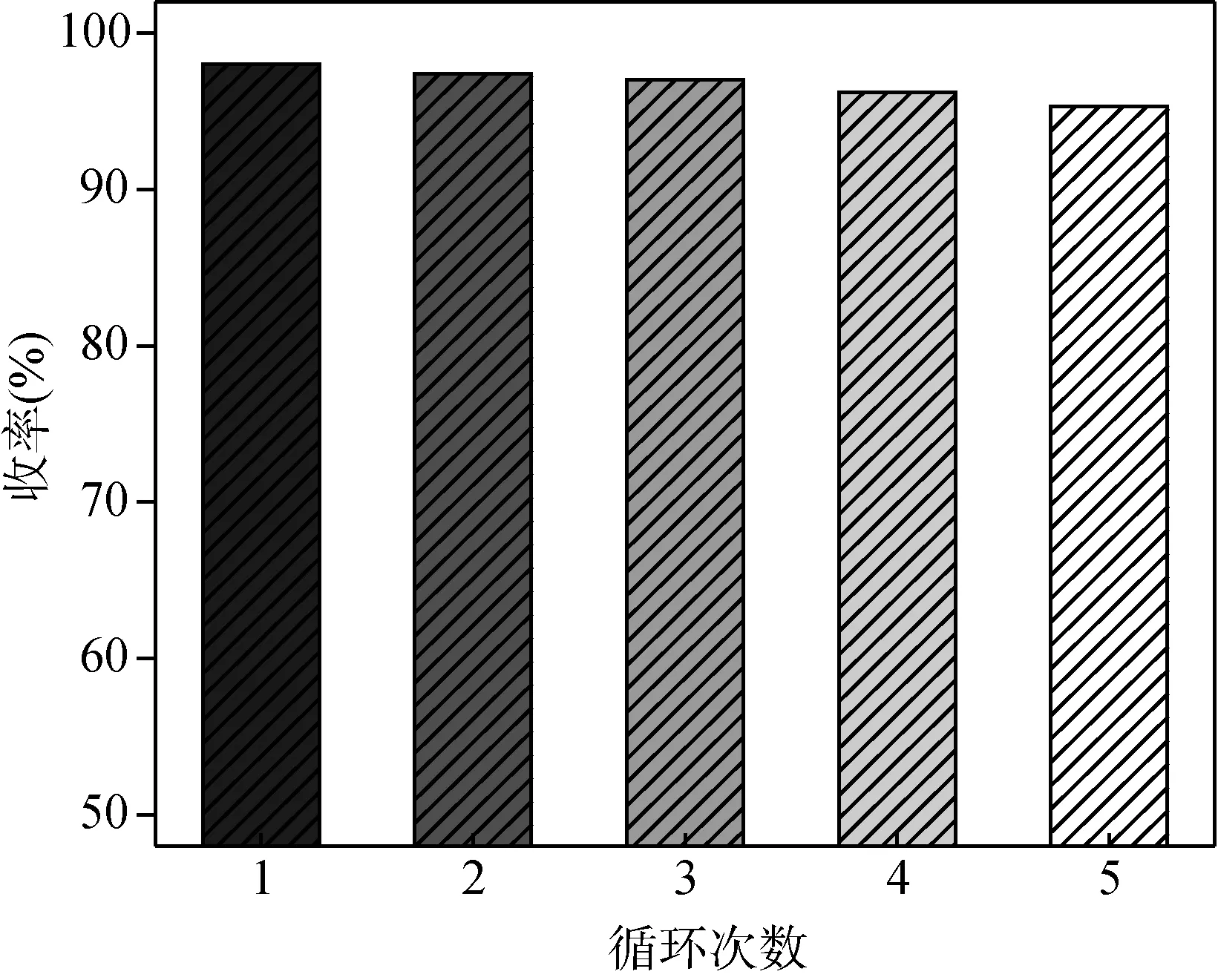
图9 催化剂的重复使用性能
从图9可以看出,通过简单的过滤回收的催化剂仍具备较好的反应活性。随着重复使用次数的增加,间氯苯甲醛与乙二醇反应的转化率只是略有下降。但整体上看,在循环五次后仍然能够保持较高的催化性能(收率大于95%),说明该催化剂能够在一定程度上进行循环使用,具有良好的工业化潜力。
2.3 反应机理分析
乙二醇和间氯苯甲醛的反应机理可能为:[HBth]-HSO4的酸性位点活化间氯苯甲醛上的羰基,随后乙二醇上的羟基进攻间氯苯甲醛上的羰基碳得到中间体,紧接着乙二醇上另一个羟基继续进攻该羰基碳并脱水生成间氯苯甲醛乙二醇缩醛,具体过程如图10所示[22]。
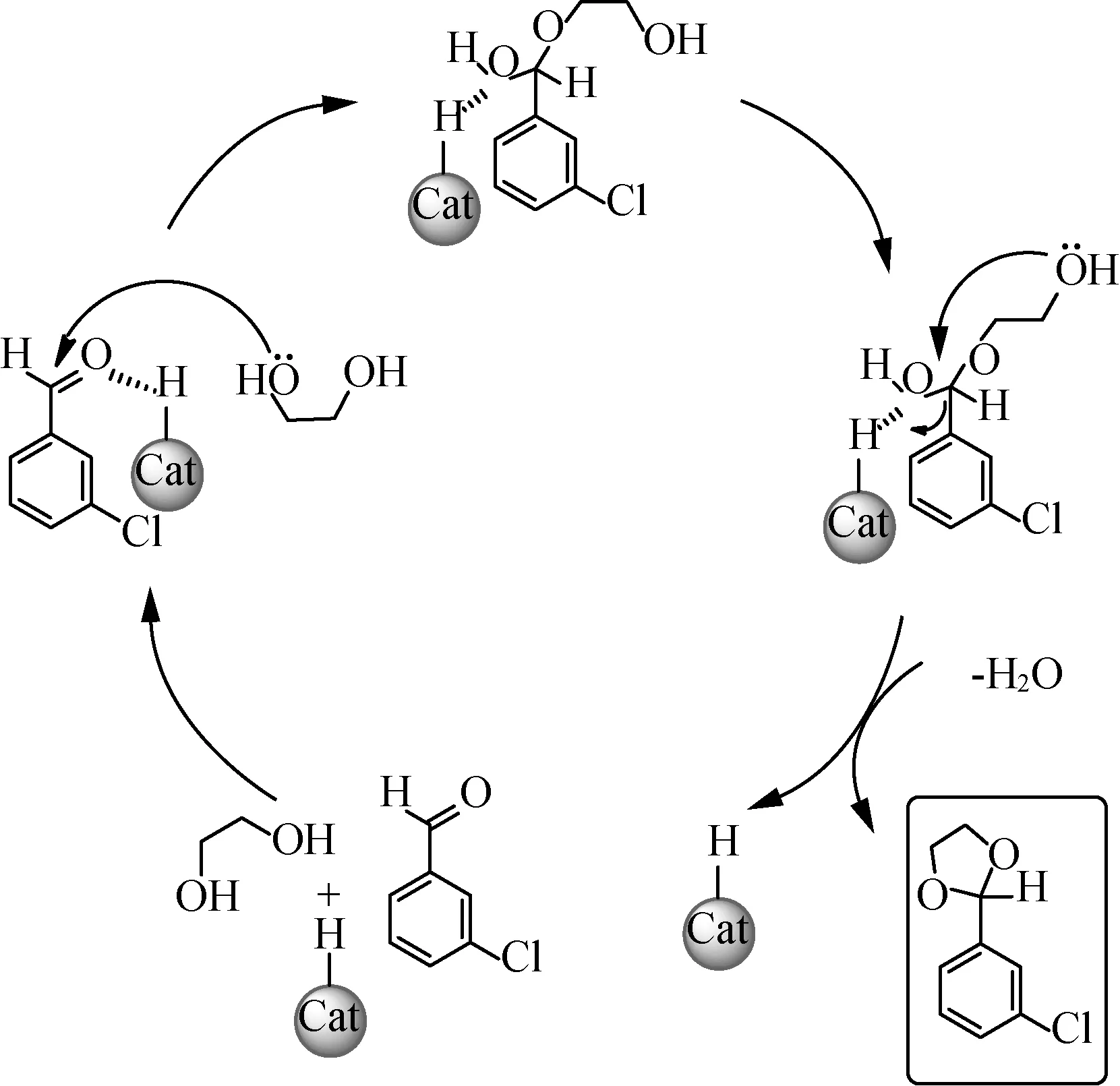
图10 缩醛化反应机理
3 结论
苯并噻唑与硫酸通过简单反应制备了酸性离子液体催化剂[HBth]-HSO4。TGA结果表明,[HBth]-HSO4催化剂具有优异的热稳定性,在200 ℃ 下能够稳定存在。该催化剂在乙二醇缩间氯苯甲醛的合成中表现出良好的催化活性。优化后的最佳反应条件为:[HBth]-HSO4用量为间氯苯甲醛的物质的量的2%,醇醛比1.4∶1,带水剂甲苯的物质的量为醛的2倍,反应时间3 h,该条件下产物收率达97.7%。
此外,该催化剂在反应后通过简单过滤即可实现分离,无需进一步处理,并且回收得到的催化剂可重复使用多次。[HBth]-HSO4催化剂具有原料成本低、制备过程简单、催化活性高、后处理简便、可循环使用等优点,符合绿色化学的发展目标,具有良好的工业化应用前景。
