磷酸三丁酯与NO2反应研究
2022-09-01孙孝群李宛桐吴瑞才唐双凌
孙孝群,李宛桐,陈 涛,吴瑞才,唐双凌
南京理工大学 环境与生物工程学院和化学与化工学院,江苏 南京 210000
随着核电的发展,核反应堆每年产生的乏燃料可达10 500吨[1]。磷酸三丁酯(TBP)由于其优异的选择性和效率被广泛应用于工业萃取乏燃料中的铀和钚[2],然而国际上乏燃料后处理厂曾发生过多起“红油”爆炸事故,造成不同程度的后果以及影响[3-6]。红油爆炸事故原因的研究已有50余年。关于TBP在红油爆炸中的作用,研究大多集中在TBP与硝酸以及重金属盐体系在辐射及加热条件下的反应路径与热危害上。大量研究通过薄层色谱、红外、气相色谱与质谱联用等分析仪器对TBP的降解产物进行分析,发现其主要液相降解产物为磷酸二丁酯(HDBP)、丁醇及少量磷酸一丁酯(H2MBP)。这些产物存在于有机相和水相当中,而气相产物主要是丁烯、N2、CO、NO、CO2和N2O[7-11]。有研究认为降解气体中的主要可燃成分为丁烯[12-13],并且其占TBP降解气体产物的99%以上[13],这些气体产物会形成可燃性的混合物,当温度达到突跃值后,就会引发气体自燃甚至是爆炸事故[14]。但是也有研究报道称TBP与硝酸在加热条件下的气体产物中几乎不含有丁烯[15]。由于红油体系的复杂性,可能不同的研究条件造成了相悖的结论,但是有研究对纯TBP在自加热到450 ℃条件下的降解产物进行分析,发现其主要分解产物是丁烯[16]。以上研究对TBP在各种条件下的降解产物与反应路径进行了十分详尽的分析,然而红油爆炸过程必然伴随着较大的释能过程,上述产物的形成均不足以解释爆炸的能量来源。红油爆炸的能量来源需要重新寻找一条稳定的可重复的释能路径。
当前对于TBP的量热也有了较为详尽的分析,Smitha等[17]使用绝热加速量热仪(ARC)对纯TBP进行了分析,研究表明TBP只有在高于250 ℃下时才开始自加速分解,是一个需要逐步进行1 650 min的缓慢热老化过程。该团队还对稀释剂以及硝酸的加入对体系热分解的影响做了研究,研究发现稀释剂的加入对TBP的放热有负面影响。而硝酸对TBP的放热分解具有促进作用,其中4 mol/L硝酸可以将TBP起始分解温度降低至160 ℃,而16 mol/L硝酸可将TBP起始分解温度降至130 ℃。然而这些研究中起始放热温度也均在120 ℃左右,但托木斯克-7事件其事故发生初始温度仅为78 ℃[6],一种新的更加剧烈和低起始温度的自加热反应路径应当被提出。本工作拟使用气相色谱仪和气相色谱-质谱联用仪对TBP与NO2反应产物进行分析,通过ARC模拟工厂绝热环境对TBP与NO2的热行为进行研究,最终通过计算模拟反应变化过程推测TBP与NO2反应路径。
1 实验部分
1.1 试剂和仪器
TBP,分析纯,南京晶格化学科技有限公司;NO2,纯度>99.9%,南京特种气体有限公司;二氯甲烷,色谱纯,南京姜华化玻有限公司。
YZ-FYF-0.1型实验室反应器,上海岩征实验仪器有限公司;ES-ARC型绝热加速量热仪(ARC),英国THT公司;GC-7890A型气相色谱仪(GC),美国安捷伦公司;GC-2030型气相色谱-质谱联用仪(GC-MS),日本岛津公司。
1.2 实验方法
1.2.1高压反应釜实验条件 预实验表明TBP-NO2体系开始出现热失控现象的摩尔比为1∶2,本次高压反应釜测试样品摩尔比确定为1∶2。在低温下按照摩尔比1∶2称取TBP和NO2共计5 g于聚四氟乙烯容器中,成为液态混合均相。将容器放入釜套,设定温度为120 ℃,记录容器内温度和压力。
1.2.2GC分析条件 出样对应氢火焰检测器(FID)的色谱柱型号为:Agilent 19095P-S25:1 687.453 75(50 m×530 μm×15 μm(长度×内径×膜厚度,下同));出样对应热导池检测器(TCD)的色谱柱型号为Agilent 1:1 686.516 34(60 m×530 μm×25 μm);测试方法:进样口温度250 ℃,柱箱温度于60 ℃保持10 min,然后以20 ℃/min的速率升温至130 ℃,保持7 min,再以20 ℃/min的速率升温至180 ℃,保持5 min,总时长28 min;进样口分流,分流比为30∶1,总流量为158 mL/min,柱流量为8 mL/min。
1.2.3GC-MS分析条件 溶剂:二氯甲烷;SH-Rxi-5Sil MS30 meter色谱柱,内径0.25 mm,膜厚0.25 μm;测试方法:进样口温度为250 ℃,柱箱温度在50 ℃下保持3 min,随后以15 ℃/min升温至280 ℃,进样口分流,总流量为14.0 mL/min,柱流量为1.00 mL/min。质谱条件(EI):离子源温度为200 ℃,接口温度为200 ℃;电子能量为70 eV;扫描速率为2 000 amu/s,扫描范围m/z=33~600。
1.2.4ARC实验条件 在低温环境下按照一定的摩尔比称量TBP和NO2,将其混合均匀。取约0.8 g样品在ARC小球中进行测试。样品信息列于表1,测试条件列于表2。

表1 TBP-NO2体系ARC测试样品信息Table 1 ARC test sample information of TBP-NO2 system
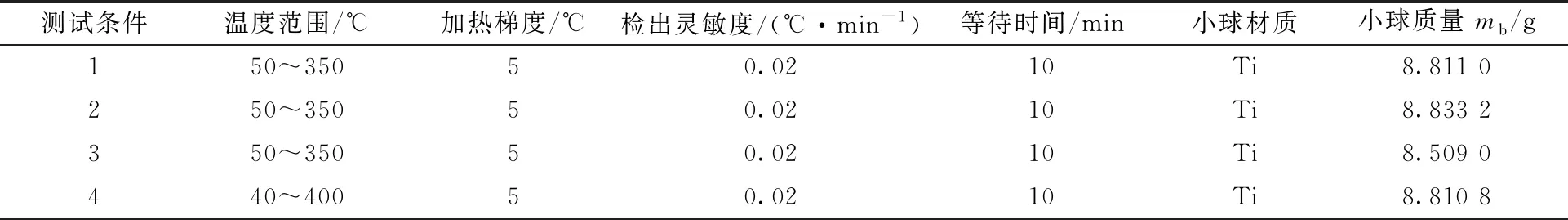
表2 TBP-NO2体系ARC测试条件信息Table 2 ARC test condition information of TBP-NO2 system
1.2.5计算方法 所有动力学计算均基于CP2K软件包的QS模块,自洽电荷密度泛函紧束缚方法结合D3色散矫正方法(SCC-DFTB-D3即DFTB方法)被使用来描述电子-离子相互作用和相关能。模拟TBP-NO2(1∶2摩尔比)混合体系在3 000 K下的热解过程,混合体系初始模型借助PKCKMOL程序建立。初始模型共计16个TBP分子、32个NO2分子,采用27 Å×27 Å×27 Å(1 Å=0.1 nm )周期性盒子,初始模型预先在300 K、0.1 MPa下采用等温等压系综(constant-pressure, constant-temperature,简称NPT系综)进行驰豫得到优化后的初始模型。优化后的初始模型密度为1 g/cm3,与现实密度相近。对于TBP-NO2在3 000 K下的分解反应模拟,采用正则系综(canonical ensemble,简称NVT系综)来保持体系能量和体积守恒,时间步长为0.25 fs,共模拟80 000步,即20 ps。采用NOSE恒温器控制体系温度在3 000 K左右波动,模拟初始速率完全随机,分布服从Maxwell速率分布规律。
2 结果和讨论
2.1 TBP-NO2体系热失控反应及产物探究
2.1.1TBP-NO2体系热失控反应 图1为反应釜热失控时温度、压力-时间图及热失控产物。如图1所示,当TBP与NO2摩尔比为1∶2时,样品温度在100 ℃左右开始剧烈上升,反应开始12.5 min后瞬间产生大量气体导致泄爆片破裂,后续压力数据缺失,体系温度在13 min后达到最高,最高温度为217 ℃。由于传感器记录频率为1 min,导致记录下的温度和压力数据较低,上述数据仅供参考,后续进行ARC测试进行详细分析。热失控产物具有刺鼻酸性气味,其中大部分为黑色石油状碳黑,少部分液相过滤后为深红色。
2.1.2TBP-NO2体系热失控产物分析 重复实验收集反应产生气体使用GC对其分析,在排除掉空气中O2和N2的干扰后可以看出产物的主要组成分别为1-丁烯(43.6%,体积分数,下同)、CO(29.0%)、N2(11.7%)以及反式2-丁烯(10%)。猜想TBP-NO2体系在100 ℃左右温度骤升(热失控)的主要原因是NO2促进了TBP中C-O键的断裂,加速了TBP自身的放热分解,而后C4链上H原子发生重排形成不同种类的丁烯(图2)。重复实验收集反应产生液相组分使用GC-MS对其进行分析,液相组分示于图3。图3显示出了少量硝酸丁酯(tR=4.495 min)和磷酸三丁酯(tR=14.185 min)的存在,观察到的许多其他峰可能是由于系统在高温下发生的其他副反应。由于体系中并不存在水,因此硝酸丁酯可能是在高温下NO2直接促进了P-O键的断裂并形成了硝酸丁酯。

图1 反应釜热失控时温度、压力-时间图(a)及热失控产物(b)Fig.1 Temperature, pressure-time diagram(a) and thermal runaway products(b) of reactor

图2 TBP-NO2摩尔比为1∶2体系的TCD(a)和FID(b)检测结果Fig.2 Results of TCD(a) and FID(b) of TBP-NO2 mole ratio of 1∶2 system
2.2 TBP-NO2体系热危险性探究
2.2.1动力学参数计算 在研究温度对化学反应速率常数的影响时,人们普遍认为反应速率常数随温度呈指数增长。这在经典Arrhenius方程中得到了证明:
(1)
式中:k为温度为T时的反应速率常数,s-1;A为指前因子,也称阿伦尼乌斯常数,s-1;E为反应活化能,可视为与温度无关的常数,J/mol;R为摩尔气体常数,J/(mol·K)。根据实验过程中得到的温升速率、绝热温升和放热段最高温度等数据,可以得到待测样品热反应过程中的反应动力学参数。根据ARC的温升速率方程:
(2)
则可得到不同温度下的反应速率常数k:
(3)
式中:vT,s为反应体系的温升速率,K/min;Tf,s为反应体系的放热段最高温度,K;T0为反应体系的初始温度,K;ΔTad,s为反应体系的温差,K;t为反应时间,min;k为反应速率常数,s-1。由Arrhenius方程(式(1))得到的对数形式有:
(4)

(a)——硝酸丁酯(tR=4.495 min)和磷酸三丁酯(tR=14.185 min)的气相色谱,(b)——tR=4.495 min对应的质谱图,(c)——tR=14.185 min对应的质谱图图3 ARC热失控液体产物的气相色谱-质谱分析Fig.3 Gas chromatography-mass spectrometry of ARC thermal runaway liquid products
在Origin中,通过自定义函数的建立,依次对反应级数n取0、0.5、1、2、3等数值进行拟合,当lnk-1/T接近为一条直线时,由该直线的斜率和截距可得到指前因子A和表观活化能E。拟合后得到样品1的活化能为3.580 kJ/mol,指前因子0.089 3 s-1,拟合曲线示于图4(a);样品2的活化能为10.79 kJ/mol,指前因子305.4 s-1,拟合曲线示于图4(b);样品3的活化能为12.46 kJ/mol,指前因子4 953 s-1,拟合曲线示于图4(c);样品4的活化能为77.28 kJ/mol,指前因子3.354×1012s-1,拟合曲线示于图4(d)。

■——计算值,实线——拟合值(a)——样品1,(b) ——样品2,(c) ——样品3,(d) ——样品4图4 不同NO2含量的TBP-NO2体系ln k-T-1拟合曲线Fig.4 ln k-T-1 fitting curves of TBP-NO2 system with different NO2 contents
2.2.2热稳定性研究 在发现了TBP-NO2体系出现的热失控现象后,探究了不同添加量的NO2对TBP热行为的影响。图5给出了TBP-NO2体系TBP∶NO2摩尔比分别为1∶1(样品1)、1∶2(样品2)、1∶3(样品3)的时间-温度图(放热段),同时为方便分析加入了纯TBP(样品4)的ARC数据。三个添加了NO2的体系起始放热温度(88.7、81.8、89.5 ℃)与纯TBP的起始放热温度(285.6 ℃)有较大的差距。随着NO2比例的增加,总放热量与放热终止温度变大,放热活性提升。约在265 ℃有比较明显的断层,造成这一现象的原因是TBP在此温度下汽化然后冷凝回流导致绝热体系温度降低。而TBP∶NO2摩尔比为1∶3的体系在265 ℃之后数据缺失是由于体系出现了较为严重的热失控,因此导致了ARC的保护机制中止反应,但所表现出的放热活性趋势与上述结论一致。图6、图7分别为自加热速率、压力(放热段)与温度之间的关系曲线。从图6可以看出,随着NO2浓度的增加,自加热速率随之变大,当TBP∶NO2摩尔比为1∶3时,其瞬间放热速率可达4 173 ℃/min。与预期相反的是纯TBP自加热速率高于样品1的,这可能是ARC中纯TBP加入的量较多导致的,这一点从起始放热温度中可以容易地看出,并不能认为纯TBP的放热活性比样品1的更高。由图7可以看出,随着NO2比例的增加,压力随温度升高的速率也随之变大。其中样品2 在TBP沸腾后体系的压力增加速率明显大于沸腾前,而样品3体系在沸腾后由于温升速率过快导致反应中止;纯TBP在沸腾后开始出现自放热,然而体系压力反而有出现下降的情况。由此可以推断,TBP本身在281 ℃时开始出现热分解,但分解速率不够快,导致体系压力反而由于冷凝回流会出现下降的情况,而NO2的加入不仅大大降低了TBP的起始分解温度,同时也增加了TBP分解的速率。
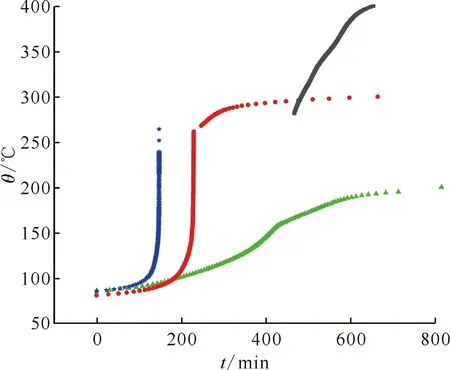
黑色■——纯TBP(样品4),绿色▲——TBP∶NO2摩尔比1∶1(样品1),红色●——TBP∶NO2摩尔比1∶2(样品2),蓝色★——TBP∶NO2摩尔比1∶3(样品3)图5 不同NO2含量的TBP-NO2体系时间-温度图Fig.5 Time-temperature diagrams of TBP-NO2system with different NO2 contents
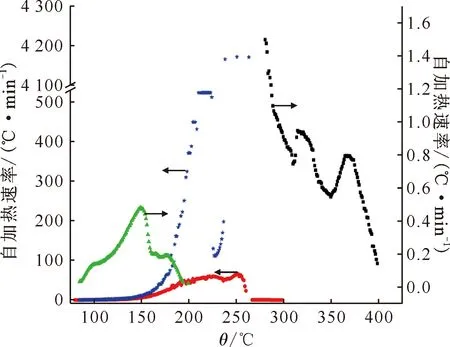
黑色■——纯TBP(样品4),绿色▲——TBP∶NO2摩尔比1∶1(样品1),红色●——TBP∶NO2摩尔比1∶2(样品2),蓝色★——TBP∶NO2摩尔比1∶3(样品3)图6 不同NO2含量的TBP-NO2体系自加热速率-温度图Fig.6 Autothermal rate-temperature diagram of TBP-NO2 system with different NO2 contents

黑色■——纯TBP(样品4),绿色▲——TBP∶NO2摩尔比1∶1(样品1),红色●——TBP∶NO2摩尔比1∶2(样品2),蓝色★——TBP∶NO2摩尔比1∶3(样品3)图7 不同NO2含量的TBP-NO2体系压力(放热段)-温度图Fig.7 Pressure(exothermic stage)-temperature diagramsof TBP-NO2 system with different NO2 contents
将TBP-NO2体系反应的绝热特性参数及热力学参数列于表3。表3中部分数据在上文结合图片已有说明,其中活化能、反应热和TD24(反应达到最大温升速率时间为24 h时对应的引发温度)值得注意。样品的反应热随着NO2含量增加而逐渐增大,纯TBP的反应热最低,这说明随着NO2含量的增多TBP的分解更加完全。从样品1和2的TD24数据来看,当TBP与NO2以1∶1的摩尔比在约64 ℃绝热环境下放置24 h可达到最大分解速率;当TBP与NO2以摩尔比1∶2在约55 ℃绝热环境下放置24 h可达到最大分解速率。样品3测试数据存在反应热过低、TD24过高的问题,原因是反应在热失控过程中遭到急停导致放热不完全。样品4的TD24无法得到。

表3 TBP-NO2体系反应的绝热特性参数及热力学参数Table 3 Adiabatic characteristic and thermodynamic parameters of TBP-NO2 system reaction
2.3 TBP-NO2体系热分解机理的第一性原理分子动力学(AIMD)研究
TBP与NO2按照1∶2的摩尔比混合后在一定温度条件下会发生热失控,为进一步探究其热失控机理,得到TBP-NO2混合体系分解模型,为实际中TBP热失控体系提供理论指导,拟采用第一性原理分子动力学(AIMD)方法对TBP-NO2体系进行动力学分析,得到TBP-NO2体系的可能分解路径。
TBP-NO2混合体系初始模型借助PKCKMOL程序建立,示于图8。
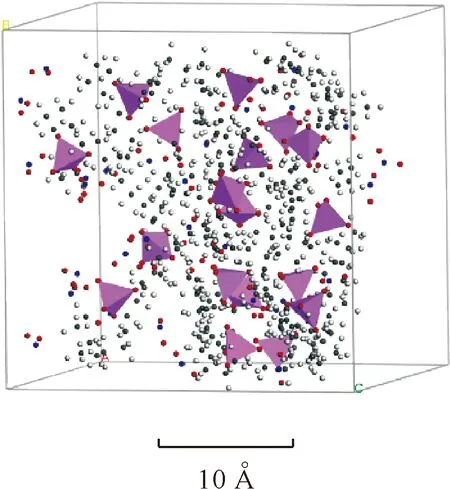
图8 TBP-NO2体系初始模型Fig.8 Initial model of TBP-NO2 system
依据原子-原子间距即键长来判断TBP-NO2在3 000 K下的分解过程中产生的各种中间产物等分子片段,判断依据为当原子-原子间距小于此间距时,即认为原子之间成键。相关截断间距列于表4。
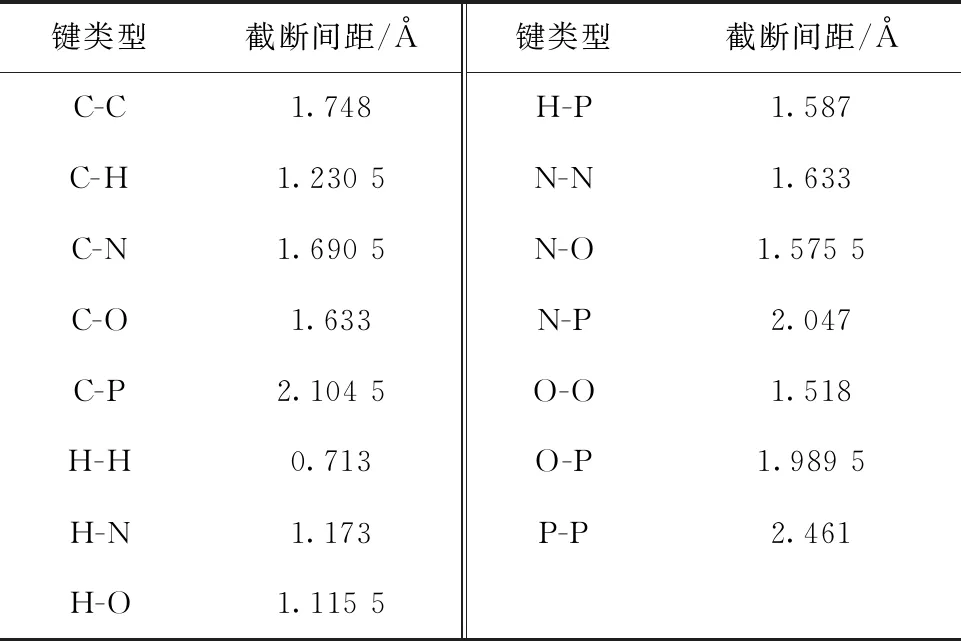
表4 分子片段判断依据Table 4 Molecular fragment judgment basis
对整个体系的能量,包括动能、势能的计算结果示于图9。如图9所示,体系的势能不断减小,整个体系正向进行,逐渐趋于稳定。对于本体系来说,说明TBP在不断地分解。
体系在20 000 fs时的模型截图示于图10。如图10所示,从模型中可以看出体系中没有TBP大分子的存在,P-O键大多断掉形成各类小分子,C链也多以C2、C3的形式存在。大部分的O原子连接在C、N、P原子上,少部分形成H2O和O2。N原子多连接在C上以中间体形式存在,少部分形成氮氧化物和N2。基于对模型的初始判断,进行分子片段检索。
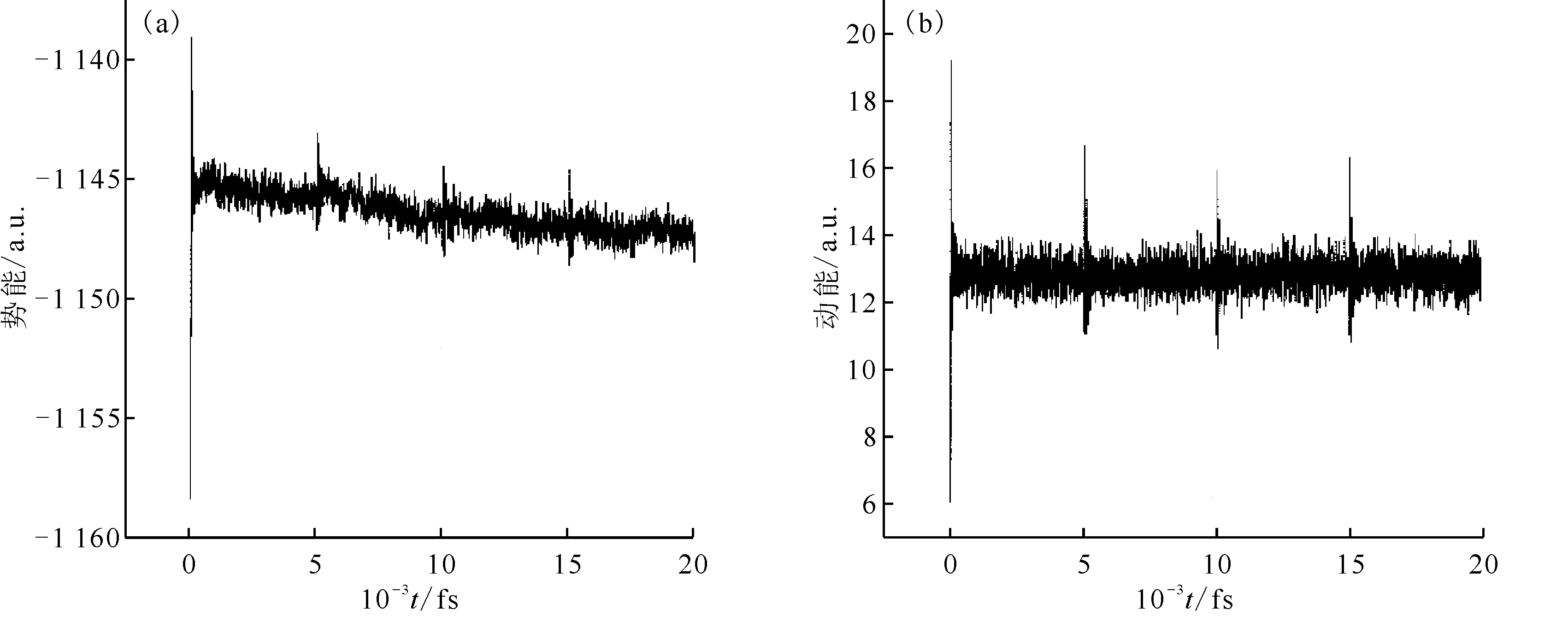
(a)——势能,(b)——动能图9 TBP-NO2体系能量变化Fig.9 Change of energy in TBP-NO2 system

t=20 000 fs图10 TBP-NO2体系反应模型终态Fig.10 Final state of TBP-NO2 system reaction model
采用上述计算方法对TBP-NO2体系进行了SCC-DFTB计算,对分子片段数量进行检索,以对分子的变化过程有直观认识。图11显示了体系中各分子片段的变化情况。
从图11(a、b)可以看出:NO2、PO4片段数量在反应开始就有较为剧烈的变化,NO2分子在500 fs内被快速消耗,在4 500 fs后基本趋于0;PO4片段数量在1 000 fs内快速下降到0,其中PO4包括所有含有PO4结构的分子或片段,如TBP、HDBP、H2MBP以及H3PO4等。在图11(c、d)中显示OH片段和NO分子的数量,OH的数量从0开始逐渐增加,后又逐渐趋于稳定,体系中开始并无OH片段或易生成OH片段的官能团,然而其从一开始就增加说明生成了某种中间体,猜测是NO2中的O夺走了TBP上C链中的H原子导致的;NO分子的数量从反应一开始快速增加到逐渐减少,可能是反应一开始的HONO快速分解为OH和NO,NO又转化为其他分子,随着反应进行,HONO数量逐渐减少,NO不断消耗却无补充来源导致数量又减少。图11(e)中显示C-O键变化图,可以看出C-O键在反应初期被大量消耗,随后趋于稳定。图11(f、g)中CO和H2O作为产物在体系中生成,生成速率先快后慢,H2O在反应后期呈现下降趋势,可能是与TBP发生水解。图11(h、i)中H质子在反应刚开始爆炸式增长后又被逐渐捕获趋于稳定,C-C键(不限单键、双键、三键)呈稳定下降趋势。在体系中还进行了N2和N2O片段的检索,但N2在反应结束时也只有1个分子生成,而N2O只在体系中偶然产生又快速被反应掉,对H3PO4和CO2进行了检索,但在反应过程中未产生这两个分子或片段。

T=3 000 K图11 TBP-NO2体系分子片段数量变化Fig.11 Change of number of molecular fragments in TBP-NO2 system
通过对以上分子片段的分析发现,最为关键的分子变化主要有以下两点:一个是C-O键和P-O键的断裂,一个是NO2分子的消耗和OH、NO片段的生成。这一结果结合实际反应体系检测到的主要产物是1-丁烯和反式2-丁烯,得到NO2的存在导致C-O键断开是发生热失控的根本原因的结论。
TBP分子上季碳相较其他三个C原子更加稳定,因此推测NO2有可能夺取了其他三个C上的H原子生成HONO中间体,被夺走H原子后的碳链失稳导致C-O键断裂,随后C链上的H和电子发生重排生成丁烯,而HONO则分解为OH和NO片段。生成丁烯的种类根据被夺走H原子的C的位置而有所不同。图12—14 为TBP 热分解路径。如图12—14所示,伯C和仲C上的H被夺走后原子重排生成产物主要是1-丁烯,而当叔C上的H被夺去后电子运动应当更趋向于C链中部,在中间两个C上形成双键,生成反式2-丁烯。这一结论和实验结论相符,也从侧面解释了1-丁烯产率比反式2-丁烯高的原因。

图12 TBP热分解路径1Fig.12 TBP thermal decomposition path 1
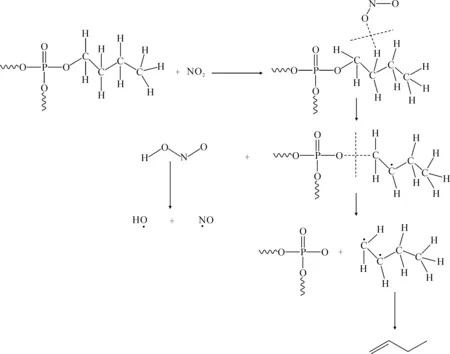
图13 TBP热分解路径2Fig.13 TBP thermal decomposition path 2

图14 TBP热分解路径3Fig.14 TBP thermal decomposition path 3
在之前所有有关TBP分解路径的研究中有水相的存在,因此主要降解路径是TBP水解形成丁醇,丁醇再氧化为丁酸、硝酸丁酯、丁烯等,这些产物再进一步氧化分解为更小的分子片段,最终生成甲烷、乙烷、CO、CO2等气体产物,这一过程主要是P-O键断裂,较为温和;但在TBP与NO2的反应路径中由于体系没有水的存在,不存在较为温和的水解过程,而是C-O键直接断裂随后生成一系列其他分子,此外体系在这个过程中产生了大量自由基,促进了热失控的发生。
除此之外,计算结果显示在这个过程中有大量的水生成,猜测是NO2或P原子上连接的O被大量H质子夺取,而C-C键的逐渐减少说明体系中的长C链逐渐断开变成CO,这一结果与实验得到的数据基本一致。整个体系在最开始时就发生了剧烈反应,势能快速上升,体系前段能量和分子变化速率与含能材料类似,但到了后期无法形成最终产物,比如N元素大多以C-N键形式存在而不是形成N2,说明整个体系后半段的反应是较为缓慢的,不如含能材料剧烈。
3 结 论
(1) 通过高压反应釜对摩尔比为1∶2的TBP-NO2体系在正常环境中的反应进行探究,收集反应产物并通过GC-MS、GC等手段进行表征。高压反应釜设定温度为120 ℃,样品温度达到100 ℃左右时出现了热失控,最高温度达到217 ℃。通过对热失控产物的组分分析发现,产物主要由炭黑、液相组分、气相组分三大类组成,其中热失控体系液相组分的主要成分为磷酸三丁酯,还有微量的硝酸丁酯,气相组分的主要产物是1-丁烯、CO、N2以及反式2-丁烯。通过气体产物推测,TBP热失控分解的主要途径是TBP上C-O键在NO2的促进下加快了断裂,加速了TBP的自身的放热分解,而后C4链上H原子发生重排形成不同种类的丁烯。体系中也含有大量的CO说明在热失控过程中也有长C链进一步分解,N2是NO2氧化TBP后的还原产物。
(2) 使用ARC对不同摩尔比的TBP-NO2体系进行绝热条件下的量热研究。纯TBP在285.6 ℃时开始分解,在体系中较为稳定,但分解时也会出现放热,是几个体系中放热能量的主要来源。加入不同比例NO2后样品起始放热温度降低到80~90 ℃,但加入不同比例NO2的样品的起始放热温度并无差别和规律性,说明NO2对TBP的起始放热条件具有促进作用,但该促进作用与NO2的含量无关。随着NO2比例的增加,样品的最大温升速率有较大提升,TBP∶NO2摩尔比为1∶1(样品1)时最大温升速率为0.483 0 ℃/min,TBP∶NO2摩尔比为1∶2(样品2)时最大温升速率为65.95 ℃/min,TBP∶NO2摩尔比为1∶3(样品3)时最大温升速率达到4 173 ℃/min,整个体系的热危险性急剧增加。三组样品的TD24分别约为64、55、56 ℃,均具有较高热危险性。NO2对TBP的热分解活性有较大提升。通过对ARC数据的动力学分析发现,除去个别由于冷凝回流导致活化能未被准确测量的样品,其余样品活化能约为10~12 kJ/mol,从反应动力学角度考虑,活化能相差不大,反应的发生条件无太大差别。随着NO2比例增加,样品热分解自加热速率和释放总能量变大,但起始分解温度、活化能、TD24等无太大变化,即加入NO2量的多少不影响热失控发生的难易程度,但影响热失控发生的剧烈程度。
(3) 通过分子动力学模拟计算发现:TBP被NO2促进发生热分解,方式为C-O键断裂,结合体系中有NO和OH片段生成的现象,可能是NO2夺取TBP伯、仲、叔C上的H原子生成HONO,这一过程导致TBP分子失稳快速分解,分别生成1-丁烯和反式2-丁烯。NO2的引入大大加速了TBP自身的热分解过程,可能是“红油”爆炸的引发因素。该结论与实验结果一致。
