沙地葡萄茎痘伴随病毒双重巢式RT-PCR 检测方法的建立与应用*
2022-09-01胡国君张尊平范旭东翟秀丽时晓燕董雅凤
胡国君,张尊平,范旭东,任 芳,翟秀丽,时晓燕,董雅凤
(1 中国农业科学院果树研究所,国家落叶果树脱毒中心,辽宁兴城125100)(2 赤峰市森林草原保护发展中心)
我国是世界上最大的鲜食葡萄生产国和消费国,葡萄因其色丰、味美而深受消费者的喜爱。病毒病害在葡萄上时有发生,随着葡萄产业标准化、精细化管理的推进,病毒病越来越受到种植者的关注。葡萄主要通过枝条嫁接等无性方式进行繁殖,导致葡萄植株携带的病毒广泛传播,严重制约了葡萄产业的健康可持续发展[1-2]。皱木复合病是一种重要的葡萄病毒病害,在世界各葡萄产区均有发生,一般可产生4 种症状类型:在Kober 上产生茎沟和栓皮化,在LN33 上产生茎沟,以及在沙地葡萄上产生茎痘。感病后,葡萄产量减少14%~70%,嫁接成活率降低40%,生长量减少30%,危害重大[3-4]。已有研究表明,沙地葡萄茎痘伴随病毒(grapevine rupestris stem pitting-associated virus,GRSPaV)与沙地葡萄上的茎痘产生有关[5-7]。
GRSPaV 是分布最广的葡萄病毒,除了可以引起沙地葡萄茎痘外,还可引起霞多丽、品丽珠、Baco Blanc 和杂交LN33 等葡萄品种或砧木的叶脉坏死,此外,还与西拉葡萄衰退病有关,主要表现为嫁接口结合处膨胀,开裂和沟槽,有时在秋天还与葡萄叶片变红有关[8],给葡萄生产造成了严重影响,亟待加强对该病毒的防控。GRSPaV 隶属于β线性病毒科(Betaflexiviridae)凹陷病毒属(Foveavirus),基因组全长约8.7 bp,3′末端含聚合A 尾,含有5 个开放阅读框(open reading frames,ORFs)。其中,ORF1 推测编码复制酶蛋白,ORF2~4 编码三基因框,具有运动蛋白活性,ORF5 编码病毒的外壳蛋白[9]。该病毒为韧皮部限制性病毒,主要通过嫁接传播[10-11]。研究发现,GRSPaV 的基因组具有广泛的遗传多样性,存在大量的分子变种[9]。不仅在不同的葡萄品种中,甚至在同一株葡萄的不同部位也可能存在不同的分子变种。据报道,1 株葡萄中可能含有4 个GRSPaV 分子变种,其中接穗中含有2~4个,砧木上有1 个[12]。高效灵敏的检测技术不仅可以及时、有效地对病毒病的发生进行监测,同时作为精准鉴定苗木是否携带病毒的重要手段对于葡萄病毒病的防控具有重要意义。然而,大量分子变种的存在给GRSPaV 的检测效率造成严重影响,尤其对脱毒种苗的鉴定。为了提高检测的准确性,在葡萄病毒检测和脱毒种苗鉴定中经常针对一种病毒选用2 对以上的检测引物或检测反应[13-14]。这样检测效率得到了保障,但同时检测成本等也相应提高。因此,建立准确、高效、低成本的GRSPaV 检测技术体系需求迫切。本研究在GRSPaV 的2 个基因上同时进行巢式扩增,通过体系优化,建立双重巢式RT-PCR 检测方法,以期在保证GRSPaV 检测效率的基础上,降低检测成本,为该病毒病的防控提供技术支撑。
1 材料与方法
1.1 供试材料
感染GRSPaV 的葡萄样品京秀、达米娜、里扎马特和87-1 以及阴性对照无病毒贝达砧木均采自中国农业科学院果树研究所国家落叶果树脱毒中心的保存圃。供检样品为实验室保存的84 份葡萄样品的试管苗和25 份田间葡萄样品。
1.2 试剂
Taq DNA 聚合酶、dNTPs 和大肠杆菌感受态细胞DH5α等,购自宝生物工程(大连)有限公司;莫洛尼鼠白血病病毒(maloney-Murine leukemia virus,M-MLV),购自普洛麦格(北京)生物技术有限公司;胶回收纯化试剂盒,购自爱思进公司(Axygen);pTOPO-TA Vector 载体,购自北京艾德莱生物科技有限公司;gel red 核酸染料,购自Biotium 公司;其他试剂均为国产分析纯;引物由生工生物工程(上海)股份有限公司合成。
1.3 引物设计
参照NCBI 上的GRSPaV 全基因组序列(105条),设计了2 组巢式扩增引物:repF1/R1→repF2/R2和cpF1/R1→cpF2/R2(表1)。

表1 GRSPaV 的PCR 扩增用引物
1.4 扩增片段的克隆转化和测序分析
将引物组合repF1/R1→repF2/R2 和cpF1/R1→cpF2/R2 的扩增产物分别进行回收纯化,连接到载体pTOPO-TA Vector 上,然后转化到大肠杆菌感受态细胞DH5α中。挑选单一的菌落进行摇菌,并进行菌液PCR 验证,最后挑选阳性克隆送北京诺赛基因组研究中心有限公司进行测序。
1.5 总RNA 提取
1.6 cDNA 合成
取上述总RNA 3 μL、6 碱基随机引物1 μL、DEPC 处理去离子水6 μL 于一离心管中,混匀后在沸水中变性6 min,然后放冰上3 min。向上述溶液中依次加入:5×RT buffer 2 μL、dNTPs(10 mmol/L)1 μL、M-MLV(200 U/μL)0.5 μL,用水补足总体系为20 μL。将上述溶液混匀后42 ℃10 min,37 ℃50 min,70 ℃灭活5 min,冰上3 min,置于-20 ℃备用。
1.7 普通PCR 扩增
取上述cDNA 模板2 μL 加到如下PCR 扩增体系中:10×PCR buffer 2.5 μL,dNTPs(2.5 mmol/L each)0.5 μL,RSP 52/53(或RSP 9F/9R)(10 μmol/L)各0.5 μL,Taq DNA 聚合酶(5 U/μL)0.125 μL,最后加水定容至25 μL。
引物RSP 52/53 扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,53 ℃退火40 s,72 ℃延伸50 s,共35 个循环;72 ℃延伸10 min。
引物RSP 9F/9R 扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸40 s,共35 个循环;72 ℃延伸10 min。
扩增结束后,取6 μL PCR 产物和1 μL 6×Loading buffer(含gel red 染料)在1.2%琼脂糖凝胶中进行分离,在BIO-RAD 凝胶成像系统中,观察扩增结果。
1.8 单一巢式PCR 扩增
第1 轮PCR 扩增体系:取合成的cDNA 2 μL,依次加入10×PCR buffer 2.5 μL、dNTPs(2.5 mmol/L each)0.5 μL、引物repF1/R1 或cpF1/R1(10 μmol/L)各0.5 μL、Taq DNA 聚合酶(5 U/μL)0.125 μL,加水定容至25 μL。
引物repF1/R1 扩增程序:95 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,共30 个循环;72 ℃延伸7 min。
引物cpF1/R1 扩增程序:95 ℃预变性3 min;94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸50 s,共30 个循环;72 ℃延伸7 min。
观察组:在对照组的治疗基础上同时给予患者双黄连口服液(生产单位:河南天地药业股份有限公司;批准文号:国药准字Z41021468;规格:每支装10 mL),同样以棉签蘸取双黄连口服液,于溃疡处及其周围进行涂抹,每日3次,盐酸雷尼替丁胶囊用于双黄连口服液之后,用法与对照组相同,均连续服用2周。
第2 轮PCR 扩增体系:以第1 轮PCR 扩增的产物为模板,用量为1 μL,依次加入10×PCR buffer 2.5 μL、dNTPs(2.5 mmol/L each)0.5 μL、引物repF2/R2 或cpF2/R2(10 μmol/L)各0.5 μL、Taq DNA聚合酶(5 U/μL)0.125 μL,加水定容至25 μL。
引物repF2/R2 扩增程序:95 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,共35 个循环;72 ℃延伸7 min。
引物cpF2/R2 扩增程序:95 ℃预变性3 min;94 ℃变性30 s,57 ℃退火40 s,72 ℃延伸50 s,共35 个循环;72 ℃延伸7 min。
第2 轮扩增结束后进行琼脂糖凝胶电泳。
1.9 双重巢式PCR 扩增及反应条件优化
第1轮PCR体系:cDNA、10×PCR buffer 2.5 μL、2.5 mmol/L dNTPs、引物组合repF1/R1-cpF1/R1(10 μmol/L)、Taq DNA 聚合酶(5 U/μL),定容至25 μL。其中,引物组合repF1/R1-cpF1/R1 设置0.2/0.2-0.6/0.6、0.4/0.4-0.4/0.4、0.6/0.6-0.2/0.2 μL 3 个用量,dNTPs 设置1.0、0.7、0.4 μL 3 个用量,Taq DNA 聚合酶设置0.25、0.15、0.05 μL 3 个用量,cDNA 设置4.0、3.0、2.0 μL 3 个用量。
引物组合repF1/R1-cpF1/R1 扩增程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸50 s,共30 个循环;72 ℃延伸10 min。
第2 轮PCR 体系:以第1 轮PCR 扩增产物为模板,用量为1 μL,其余成分为10×PCR buffer 2.5 μL、2.5 mmol/L dNTPs、引物组合repF2/R2-cpF2/R2(10 μmol/L)、Taq DNA 聚合酶(5 U/μL),定容至25 μL。其中引物组合repF2/R2-cpF2/R2 设置0.3/0.3-0.3/0.3、0.2/0.2-0.4/0.4、0.4/0.4-0.2/0.2 μL 3个用量,dNTPs 设置1.0、0.75、0.5 μL 3 个用量,Taq DNA 聚合酶设置0.25、0.15、0.05 μL 3 个用量。
引物组合repF2/R2-cpF2/R2 扩增程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸50 s,共35 个循环;72 ℃延伸10 min。
第2 轮扩增结束后进行琼脂糖凝胶电泳。
1.10 检测效果比较
利用普通RT-PCR、单一巢式RT-PCR 和双重巢式RT-PCR 分别对84 份葡萄试管苗进行检测。
2 结果与分析
2.1 引物的验证
由图1 可知,所设计的2 组巢式引物repF1/R1→repF2/R2和cpF1/R1→cpF2/R2均能在阳性样品中扩增出单一且与预期片段大小一致的条带,而阴性对照中没有扩增条带。将扩增产物进行克隆转化及测序分析,并将获得的病毒序列在NCBI 数据库进行BLAST 比对。结果显示,巢式引物repF1/R1→repF2/R2 和cpF1/R1→cpF2/R2 分别特异性地扩增GRSPaV 复制酶和外壳蛋白基因序列,片段的大小分别为902 bp 和438 bp。

图1 2 组巢式引物的PCR 扩增结果
2.2 双重巢式PCR 扩增中第1 轮PCR 体系的优化
分别对引物、dNTPs、Taq DNA 聚合酶和cDNA的用量进行优化,结果显示,引物组合repF1/R1-cpF1/R1 的用量(10 μmol/L)为0.4/0.4-0.4/0.4 μL、2.5 mmol/L dNTPs 的用量为0.7 μL、5 U/μL Taq DNA聚合酶的用量为0.05 μL、cDNA 的用量为2 μL 时(表2),第2 轮扩增效果最佳。
2.3 双重巢式PCR 扩增中第2 轮PCR 体系的优化
分别对引物、dNTPs 和Taq DNA 聚合酶的用量进行优化,结果显示,引物组合repF2/R2-cpF2/R2的用量(10 μmol/L)为0.3/0.3-0.3/0.3 μL(图2)、2.5 mmol/L dNTPs 的用量为1.0 μL、5 U/μL Taq DNA聚合酶的用量为0.25 μL 时(表2),扩增产物无杂带干扰,琼脂糖凝胶中出现2 条清晰的条带,且2条带的亮度一致。
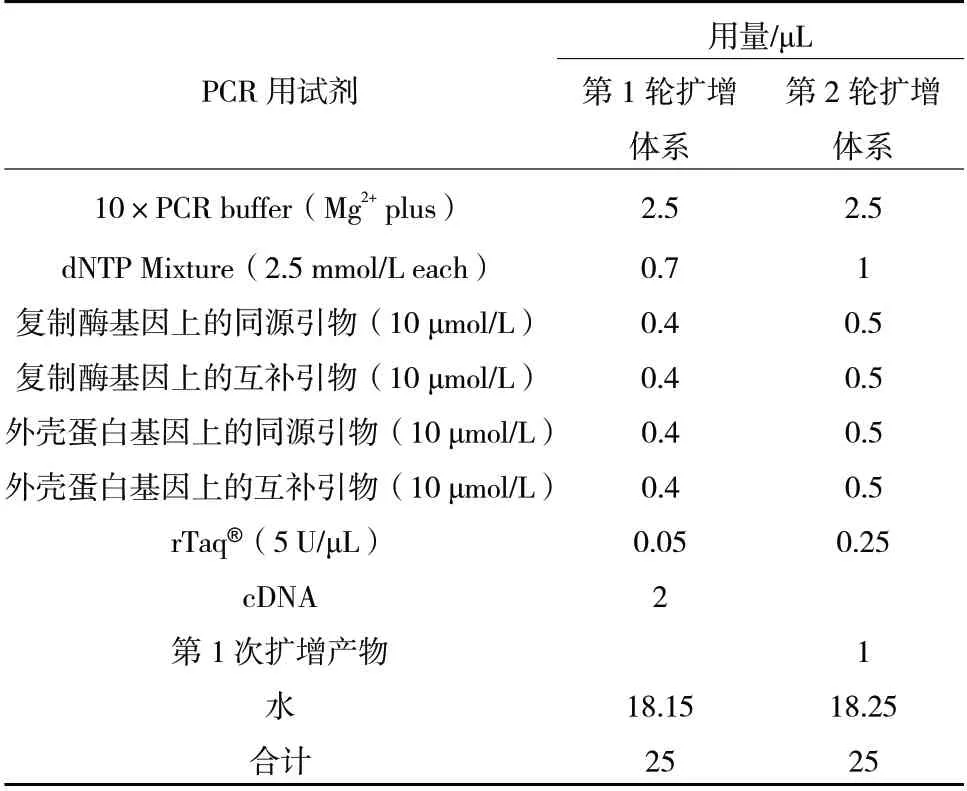
表2 GRSPaV 的双重巢式PCR 扩增体系

图2 双重巢式PCR 扩增中引物组合用量的优化
2.4 检测效果比较
分别采用普通、单一巢式和双重巢式RT-PCR对葡萄试管苗样品进行病毒检测,结果显示,2 对普通引物RSP 52/53 和RSP 9F/9R 对GRSPaV 的检出率均为51.4%,合计为65.1%;2 对巢式引物rep F1/R1→repF2/R2 和cpF1/R1→cpF2/R2 对GRSPaV的检出率分别为88.1%和80.7%,总和为93.6%;而双重巢式引物组合repF1/R1-cpF1/R1→repF2/R2-cpF2/R2 对GRSPaV 的检出率与2 个单一巢式RTPCR 的检测率总和一致,较2 个普通RT-PCR 的总和提高28.5 个百分点(表3)。

表3 不同方法的GRSPaV 检测效果
3 结论与讨论
本研究利用GRSPaV 的2 组单一巢式扩增引物repF1/R1→repF2/R2 和cpF1/R1→cpF2/R2,通过对两轮PCR 扩增体系的优化,建立了GRSPaV 双重巢式RT-PCR 检测技术体系,其检出率与2 个片段单一巢式PCR 的检出率总和相同,有效保证了检测的准确性。
以核酸检测为基础的RT-PCR 和巢式PCR 方法,具有简单、易操作、敏感性高、特异性强、结果直观等优点,已成为病原检测的重要手段,在果树病毒的检测中被广泛应用[7,13-14,17]。尤其是巢式RTPCR 技术,可显著提高果树病毒的检测效率,有效避免非目的片段的扩增[18-20]。然而,对于GRSPaV等一些序列变异较大的病毒,仍然存在假阴性的风险,需要通过增加检测频率或采用不同检测引物的方法来提高检测的准确度[13-14]。
针对GRSPaV 的2 个基因片段同时进行检测,一般单一巢式PCR 需要进行4 个PCR 反应,而本研究通过2 个PCR 反应便完成了巢式扩增,不仅减少了2 个PCR 反应及对应的琼脂糖凝胶电泳,试剂用量也相应减少,该检测方法实现了GRSPaV 检测的节本、精准和高效,满足大规模样品快速、准确的检测需要,而且操作简单,适用于田间样品的病毒种类鉴定,以及无病毒葡萄种苗生产各个环节的病毒鉴定等。
