毒素-抗毒素系统对微生物活的非可培养状态形成的影响研究进展
2022-09-01张铁华孟玲玲
张铁华,孟玲玲,赵 凤
(吉林大学食品科学与工程学院,吉林 长春 130062)
微生物的生存面临着来自宿主以及自然环境的压力,尤其是受到不断变化的自然环境(如低温、高温、重金属、高渗透压、消毒剂、抗生素等)的挑战。为了适应恶劣环境,一些微生物会选择形成一种低代谢活性但高抗性的生命形式,如芽孢、活的非可培养(viable but non-culturable,VBNC)状态、持留菌等。芽孢是产芽孢细菌(主要是芽孢杆菌属和梭菌属)在环境营养条件缺乏时,在菌体内形成的一种休眠体。芽孢含水量极低、抗逆性强,食品工业也以对芽孢的杀灭效果来衡量产品的灭菌效果。VBNC状态和持留状态是非芽孢形成菌在面对不良环境时形成的一种休眠状态。处于持留状态的细菌对多种药物具有耐受性,从而导致治疗失败。处于VBNC状态的致病菌和腐败菌仍然有造成食品腐败变质及致病的风险,并且当条件适宜时,其可能会恢复为可培养状态,这给食品产业和人类健康造成了严重的威胁。已有证据表明VBNC状态致病菌可能参与食源性疾病暴发,1998年日本发生了由VBNC状态肠出血性大肠杆菌O157:H7(enterohemorrhagic)污染的腌渍鲑鱼籽所引起的严重食物中毒事件。无独有偶,日本由干制鱿鱼引发的食物中毒事件同样是由VBNC状态的肠炎沙门氏菌()所引起。为了减少由VBNC状态微生物引起的食品安全隐患,需要抑制微生物VBNC状态的形成;为了靶向控制VBNC状态的形成,需要对微生物VBNC状态的形成机制有正确认知。目前关于微生物VBNC状态的研究多集中在诱导条件、复苏条件及检测方法的探索上,对其形成机制的研究还不全面。而关于VBNC状态形成的机制主要有两种假设:一种认为极端的条件会造成细菌氧化损伤,进而抑制其生长,最终导致VBNC状态的形成;另一种认为VBNC状态的形成与芽孢的形成类似,是基因调控的结果。
毒素-抗毒素(toxin-antitoxin,TA)系统由两个共表达的基因组成,其中一个编码毒素,另一个编码抗毒素。毒素可以抑制细菌生长,而抗毒素可以中和毒素抑制其发挥毒性作用。在环境恶劣时,TA系统被激活并且参与调控细菌生长。研究表明TA系统参与了微生物持留状态与VBNC状态的形成。不过,不良环境对TA系统的激活方式及TA系统与VBNC形成关系的研究还不全面。本文将重点综述TA系统与微生物VBNC状态形成的关系。
1 微生物的VBNC状态与持留状态
1982年,Xu Huaishu等研究霍乱弧菌()和大肠杆菌()在海洋与河口环境的存活规律时首次发现了VBNC状态,处于该状态的微生物仍具有代谢活性及完整的细胞结构,但在常规固体培养基中无法繁殖形成菌落。VBNC状态是非芽孢形成菌处于不良环境时形成的一种休眠状态,是微生物所采取的一种生存策略(图1)。目前发现已有100多种微生物能够形成VBNC状态,包括多种食源性致病菌及腐败菌。传统的细菌培养法被认为是检测食源性致病菌的金标准,但VBNC状态细菌的不可培养性使得这种基于可培养性的检测方法检测不到VBNC状态的细菌,这会导致食品中的细菌含量被大大低估,从而带来微生物风险。目前对于VBNC细胞数的确定都是基于间接方法,即通过测定微生物的活细胞数以及可培养细胞数来间接获得,二者的差值即为VBNC细胞数。
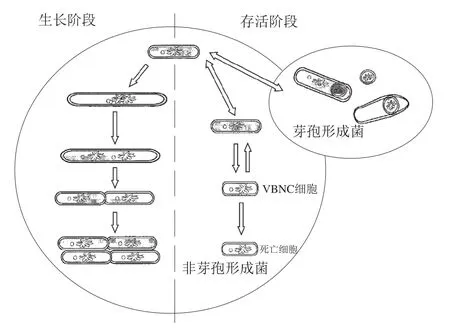
图1 细菌的生命周期[10]Fig. 1 Life cycle of bacteria[10]
目前已知的可以诱导微生物进入VBNC状态的因素包括温度、营养、pH值、渗透压、氧气浓度、重金属、抗生素、消毒剂、洗涤剂、防腐剂等;除此之外,干燥、巴氏杀菌、紫外照射、高压二氧化碳、脉冲电场、超声波、热超声等食品加工过程也会诱导微生物进入VBNC状态。VBNC状态微生物较常见的特征包括细胞形态改变、代谢活性降低、对外界刺激的抗性提高、基因表达发生变化等。当条件适宜时,比如逆转诱导压力、添加化学物质、与宿主细胞共培养或添加复苏促进因子Rpf,有些VBNC状态微生物能够复苏,重新获得在培养基上生长繁殖的能力。比如创伤弧菌()在5 ℃低温条件下进入VBNC状态,将其移至室温后,VBNC状态的创伤弧菌成功实现复苏;通过添加吐温-80的方法可以使VBNC状态的金黄色葡萄球菌()复苏;VBNC状态的铜绿脓假单胞菌()在与其宿主变形虫共培养2 h后成功复苏。值得注意的是,部分处于VBNC状态的致病菌仍保留一定毒性,而且致病性会伴随复苏恢复。本实验室在食品常用的贮藏条件下——冷藏(4 ℃)和冷冻(-20 ℃),研究了食品添加剂柠檬酸对金黄色葡萄球菌VBNC状态形成的影响。研究发现,冷藏和冷冻条件均使柠檬酸体系中的金黄色葡萄球菌进入VBNC状态,而且形成的VBNC细胞对胃肠液的抗性明显增强;另外,胰蛋白胨大豆肉汤培养基、热激处理、添加丙酮酸钠、添加吐温-80的方法均使VBNC细胞实现了复苏;实时荧光定量聚合酶链式反应分析发现VBNC细胞中与黏附和生物被膜形成相关的一些基因表达发生了变化,并且发现生物被膜形成能力有随着复苏而恢复的潜力。鉴于VBNC状态微生物的潜在危害,其已引起了研究者的广泛关注。
抗生素持留菌是指在抗生素处理过程中产生的一部分对抗生素有耐受性的细胞。与携带可遗传耐药因子的耐药细胞不同,抗生素持留菌通常在抗生素处理过程中呈现低的代谢活性,这使得它们不需要经历基因突变而能够耐受抗生素。2015年,Ayrapetyan等提出了休眠连续体假说(图2),认为微生物的持留状态与VBNC状态有着密切关系。该假说指出某些环境胁迫(如抗生素处理)会诱导细胞中抗毒素的降解,导致其同源毒素(图2中的红色三角形)被释放,释放的毒素会通过影响细胞新陈代谢来影响细胞的生长。在环境胁迫处理前期,产生耐受性的非生长细胞——持留菌,该状态菌可以在环境胁迫消除后快速恢复生长。然而,如果细胞长期暴露在环境胁迫下,积累的游离毒素量会增加,使细胞的代谢活性进一步降低,导致休眠程度增加,使细胞进入VBNC状态。当环境胁迫去除后,处于VBNC状态的细胞与持留菌相比需要更长的时间实现复苏。2018年,Ayrapetyan等首先从VBNC细胞和持留菌的形成条件及二者对抗生素的耐受性等表型特征方面阐述了VBNC细胞和抗生素持留菌之间的关联性;其次阐述了细菌在氨基酸饥饿下的应激反应、蛋白质水解、TA系统、ATP消耗等参与调控抗生素持留菌的分子机制也参与了VBNC状态的调控,这说明VBNC细胞和抗生素持留菌在调控机制上有很多相似之处;虽然二者有诸多相似之处,但作者从VBNC细胞和抗生素持留菌的复苏动力学角度论述了它们是两种不同的休眠状态,其中VBNC细胞处于较深的休眠状态,而抗生素持留菌则处于较短暂的早期休眠状态。
本实验室在对金黄色葡萄球菌VBNC状态形成机制的研究过程中,从VBNC细胞诱导液中分离出了一种蛋白,通过序列比对发现该蛋白属于一种毒素蛋白,并通过实验证明该蛋白会显著影响VBNC细胞的形成。目前,已有大量研究证明TA系统参与持留菌的形成,但有关TA系统与VBNC状态形成关系的报道仍较少。本文将从TA触发系统及TA系统本身在VBNC状态微生物中的表达情况及对VBNC状态形成的作用综述TA系统对微生物VBNC状态形成的影响。
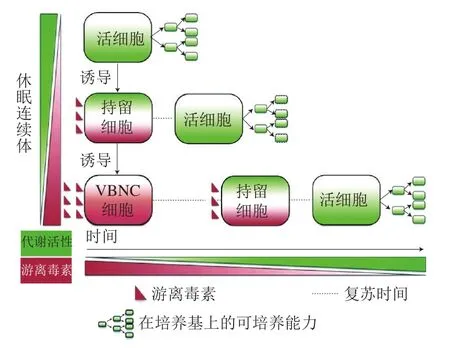
图2 微生物休眠连续体假说[32]Fig. 2 Schematic representation of the microbial dormancy continuum hypothesis[32]
2 TA系统概述
典型的TA系统由稳定的毒素和不稳定的抗毒素组成,二者的编码基因位于细菌质粒或染色体中。毒素和抗毒素协同表达,构成一个发挥多种功能的调控系统,在细菌耐受外界压力、发挥毒力作用、抵御噬菌体侵染、调控生物膜形成、维持基因组稳定性等多个方面发挥作用。除了典型的TA系统外,研究者还发现了非典型的三组分TA系统,由毒素蛋白、抗毒素、转录调控因子或者分子伴侣组成,其中分子伴侣可以促进抗毒素折叠以及保护抗毒素免于降解。
根据毒素与抗毒素的化学组成及二者相互作用的方式,可将TA系统分为8 种类型,其中包括6 种被广泛报道的TA系统及2 种新提出的TA系统,被命名为I~VIII型TA系统。其中,I、III型及VIII型TA系统的抗毒素是RNA,其余5 种TA系统中的抗毒素都是蛋白质;另外,除了最新发现的VIII型TA系统的毒素是RNA,其余TA系统的毒素都是蛋白质。在这8 种TA系统中,抗毒素抑制毒素发挥作用的方式多样,可概括为抑制毒素蛋白的翻译、直接与毒素结合而影响其功能的发挥、干扰毒素与靶标的结合、作为适配器促进毒素蛋白的降解、对毒素进行修饰等。现对每种TA系统中抗毒素与毒素的作用方式进行介绍。在I型TA系统中,抗毒素是RNA,其序列与编码毒素蛋白的mRNA序列是互补的,因此抗毒素可与编码毒素蛋白的mRNA结合,抑制毒素翻译,从而起到调控毒素表达的作用。在II型TA系统中,毒素与抗毒素都是蛋白质,抗毒素蛋白通过与毒素蛋白的亲和结合而抑制毒素的毒性。在III型TA系统中,抗毒素是RNA,能直接作用于毒素蛋白,从而抑制毒素活性。在IV型TA系统中,抗毒素是蛋白质,但是不能直接与毒素蛋白结合,而是通过与毒素蛋白的靶标相互作用,从而间接抑制毒素蛋白发挥功能。在V型TA系统中,抗毒素是一种核糖核酸酶(ribonuclease,RNase),可特异性切割编码毒素蛋白的mRNA,阻止其翻译。在VI型TA系统中,抗毒素SocA作为适配器促进酪蛋白裂解酶(caseinolytic protease,Clp)XP对毒素蛋白SocB的降解。不同于以上6 种类型,在Hha/TomB、TglT/TakA以及HepT/MntA这3 种TA系统中,抗毒素(TomB、TakA、MntA)通过对其同源毒素(Hha、TglT、HepT)修饰而发挥对毒素蛋白的拮抗作用,研究者建议将这种类型的TA系统命名为“VII型TA系统”。在大肠杆菌的Hha/TomB TA系统中,抗毒素TomB可氧化毒素蛋白Hha保守的半胱氨酸残基,从而使毒素蛋白失活;在结核分枝杆菌()的TglT/TakA TA系统中,抗毒素TakA是一种新型的非典型丝氨酸蛋白激酶,通过磷酸化毒素蛋白TglT的S78位点而抑制毒素蛋白的活性;在广泛存在于细菌和古生菌中的HepT/MntA TA系统中,MntA抗毒素具有核酸转移酶活性,可将3 个AMP转移到毒素蛋白HepT活性位点附近的酪氨酸残基上,抑制毒素发挥作用。在VIII型TA系统中,毒素SdsR(也称RyeB)和抗毒素RyeA是由相同位点的DNA正负链分别编码的sRNA,因此抗毒素可以与毒素互补形成碱基对以中和毒素的作用。但TA系统的成员并不只有这8 种。Li Ming等近期在上发文报道了一类全新的TA系统,该系统由两个sRNA组成,包括毒素和抗毒素,该TA系统可有效守护常间回文重复序列丛集/常间回文重复序列丛集关联蛋白系统(clustered regularly interspaced palindromic repeats/CRISPR-associated proteins system,CRISPR-Cas)的结构和功能。CRISPR-Cas系统是在微生物中广泛存在的抗病毒免疫系统,Li Ming等发现当这种新的TA系统与CRISPR-Cas偶联存在时,Cas效应蛋白可以和抗毒素共同抑制毒素的表达,而一旦Cas效应蛋白被破坏(如病毒侵入),毒素就会表达并杀死微生物细胞,从而保护群体中其他细胞不被侵染,这是一种利他主义的群体防御策略。
通过TA系统成员的不断增加,可以发现TA系统在微生物中存在普遍性,由此可见TA系统对微生物的生存发挥重要作用。
3 TA系统对VBNC状态形成的影响
在外界环境恶劣时,微生物TA系统会被激活,其中的抗毒素含量下降,毒素游离出来,发挥毒性作用,进而抑制微生物生长。关于TA系统在不良环境中如何被激活存在争议,目前研究者提出了激活TA系统的两种模式,分别是被动模式和主动模式。被动模式认为,微生物为了应对逆境降低了编码抗毒素的mRNA的翻译速率,导致抗毒素含量降低,毒素活性得以发挥。在被动模式中,TA系统中抗毒素的产生速率易变,但其降解速率相对恒定。主动模式认为,不良环境会刺激微生物产生信号分子,信号分子进一步触发蛋白酶降解抗毒素,使毒素活性得以发挥,进而影响细菌生长。在主动模式中,TA系统中抗毒素的产生速率恒定,但其降解速率易变。关于TA系统激活模式存在不同看法,可能是菌种的差异性及TA系统的复杂性导致的。TA触发系统对TA系统的激活属于主动模式,而且已有研究表明TA触发系统与VBNC状态形成存在一定关系。
3.1 TA触发系统对VBNC状态形成的影响
TA触发系统包括、、、、、、和这8 种基因。已有研究表明TA触发系统中的、、、、与微生物VBNC状态的形成存在一定关系。基因编码信号分子鸟苷四磷酸(guanosine tetraphosphate,ppGpp)的合成酶蛋白RelA,ppGpp可以感知环境胁迫、调控DNA复制及转录,是一种可诱导微生物进入持留状态和VBNC状态的应激因子;基因编码的SpoT蛋白具有ppGpp水解酶活性和微弱的合成酶活性;编码的Lon蛋白酶是ATP依赖蛋白酶,可以降解II型抗毒素;编码外切聚磷酸酶(exopolyphosphatase,PPX),经典的PPX是单功能的,可维持多聚磷酸盐(polyphosphate,PolyP)的稳态,另一类是双功能的PPX/鸟苷五磷酸水解酶(PPX/guanosine pentaphosphate phosphohydrolase,PPX/GPPA),PPX/GPPA酶同时具有PPX和GPPA活性,负责产生ppGpp;编码多聚磷酸盐激酶(polyphosphate kinase,PPK),可介导PolyP的合成,而PolyP可激活Lon蛋白酶降解抗毒素。Zhang Jingfeng等用氨苄西林诱导阪崎肠杆菌()进入VBNC状态,并比较了阪崎肠杆菌、、、、、这6 种基因在对数生长期和VBNC状态下的转录水平,结果发现、、、、基因在VBNC细胞中的表达显著上调,而基因在VBNC细胞中的表达没有显著性变化,因此提出了阪崎肠杆菌VBNC状态形成的可能机制,即RelA和PPX/GPPA作用生成ppGpp,ppGpp通过激活PPK来积累PolyP,积累的PolyP可进一步激活Lon蛋白酶使抗毒素降解,由此释放的游离毒素诱导阪崎肠杆菌进入VBNC状态。
除了从TA触发系统整体出发揭示其与VBNC状态形成的关系,还有研究从TA触发系统中某个组分入手探讨它对VBNC状态形成的影响,下文对TA触发系统中单个组分的作用进行介绍。
3.1.1对VBNC状态形成的影响
在VBNC状态微生物中的差异表达已在多项研究中得到证实。Mishra等在4 ℃淡水体系中诱导霍乱弧菌的VBNC状态,并分别比较了诱导第0、3、7、16、23天后(已进入VBNC状态)菌体中的表达水平,发现在VBNC菌体中的表达量上调了60.8 倍。Zhang Jingfeng等用氨苄西林处理阪崎肠杆菌,结果发现在VBNC细胞中的表达量上调了3.7 倍。上述研究均发现TA触发系统中的基因在VBNC状态微生物中超量表达,因此推测RelA可能参与VBNC状态的形成,这种推测被Jayakumar等的研究证实。Jayakumar等比较了4 ℃和30 ℃下人工海水中诱导霍乱弧菌野生型与缺失株进入VBNC状态的时间,结果显示在30 ℃下二者进入VBNC状态的时间没有显著性差异,但在4 ℃下野生型比缺失株更快进入VBNC状态,这表明可以促进霍乱弧菌VBNC状态的形成。但值得注意的是,在VBNC状态微生物中的表达情况与菌株类型有关。在5 ℃条件下,Nowakowska等用人工海水诱导霍乱弧菌临床分离株(C-基因型)和环境分离株(E-基因型)进入VBNC状态,研究发现C-基因型的VBNC细胞与指数期细胞的表达水平没有显著性差异,而对于E-基因型的VBNC细胞,的表达较指数期细胞显著提高。通过上述研究,认为在某些微生物的VBNC状态形成中起到一定作用,这种作用的发挥应与ppGpp有关。
3.1.2 Lon蛋白酶对VBNC状态形成的影响
Lon蛋白酶通过降解II型抗毒素而导致菌体内的毒素抗毒素比例失调,引起游离毒素的释放,一些毒素会抑制微生物的复制、翻译过程,进而调控微生物进入休眠状态。Zhang Jingfeng等用氨苄西林诱导阪崎肠杆菌,结果发现VBNC细胞中基因的表达量显著上调了63.0 倍。目前关于Lon蛋白酶在VBNC状态形成中的作用研究还比较少。然而,另一种与Lon蛋白酶有相似底物识别域的压力应激蛋白酶已经被证明在VBNC状态形成中发挥重要作用。当研究金黄色葡萄球菌中各种蛋白酶对菌体内3 种抗毒素MazE、Axe1和Axe2的半衰期影响时,发现只有或缺失株的抗毒素很稳定,因此认为ClpPC是降解金黄色葡萄球菌中抗毒素的主要蛋白酶。Kusumoto等对鼠伤寒沙门氏菌()的野生型菌株及Δ和突变株进行VBNC状态诱导,发现Δ和突变株中的RpoS蛋白表达水平比野生型菌株中更高,而且突变株进入VBNC状态的时间也出现延迟,这说明ClpX中的323~355位残基在ClpX功能发挥上至关重要,并且ClpX可以通过降解RpoS来促进VBNC状态的形成。基于上述研究,推测与Clp蛋白酶类似,TA触发系统中的Lon蛋白酶同样通过降解抗毒素来促进微生物VBNC状态的形成。
3.2 TA系统中毒素和抗毒素对VBNC状态形成的影响
Ayrapetyan等于2015年提出了微生物的休眠连续体假说,认为微生物的VBNC状态是比持留状态更深层的休眠状态,二者之间存在许多相似的表型特征,并且有一些共有的分子机制调控二者的形成。研究发现TA系统可通过多种机制调控细胞生长和持留性,近年也有研究证明TA系统亦参与VBNC状态的形成。
Pedersen等研究发现诱导毒素基因和的转录会使大肠杆菌进入VBNC状态,随后诱导抗毒素基因和的转录会完全逆转这种状态;同时该研究者发现的转录会严重抑制该菌的翻译能力,而的转录会同时抑制DNA的复制与蛋白质翻译。Christensen等也发现毒素ChpAK和ChpBK会抑制大肠杆菌的菌落形成及蛋白质翻译能力。Korch等研究发现毒素基因在大肠杆菌中的过表达会抑制大分子合成并诱导VBNC状态的形成。Christensen-Dalsgaard等研究发现霍乱弧菌中的毒素基因在大肠杆菌中过表达可以激活切割mRNA,抑制翻译,从而促使该菌进入VBNC状态。Demidenok等首次证实了TA系统参与分枝杆菌()休眠状态的形成,研究发现该菌在向VBNC状态转变过程中伴随着毒素基因的上调表达,进一步通过实验发现过表达毒素基因可以促使耻垢分枝杆菌()进入VBNC状态,而过表达抗毒素基因则使细胞不能形成VBNC状态。Hino等将副溶血性弧菌()中II型TA系统的毒素基因在大肠杆菌中表达使大肠杆菌的细胞形态从杆状变为丝状,同时细胞进入VBNC状态;而与抗毒素基因共表达后对大肠杆菌的生长没有影响,并且可以抑制由单独表达引起的菌体细胞形态变化。因为细菌形态变化通常与细胞不完全分裂有关,因此VP1843毒素蛋白可能通过抑制细胞分裂而使微生物形成VBNC状态。Ayrapetyan等研究了II型TA系统和中毒素基因和在VBNC状态创伤弧菌中的表达情况,发现在VBNC菌体中和的表达分别上调了16.8 倍和7.0 倍,但的表达没有显著性变化,另外、以及的表达分别显著上调了20、23 倍和111 倍,这些毒素基因在VBNC细胞中的过量表达表明这些TA系统可能在VBNC状态形成中发挥促进作用。Gupta等对结核分枝杆菌中的一种TA系统MparDE2进行研究,发现毒素基因在大肠杆菌中的异位表达可以促使大肠杆菌进入VBNC状态;进一步通过实验发现MParE2毒素蛋白可以抑制DNA旋转酶活性;当将一定比例的MParD2抗毒素与MParE2毒素蛋白混合孵育30 min后再加入DNA旋转酶反应混合物中,DNA旋转酶可以正常发挥功能;然而,当DNA旋转酶与MParE2先孵育一段时间,再加入MParD2则不能逆转这种抑制作用。因此可以得出MParE2毒素蛋白是通过抑制微生物体内DNA旋转酶的功能而诱导VBNC状态的形成。总之,以上研究都表明TA系统中的毒素蛋白对微生物VBNC状态的形成起促进作用。Aakre等研究了新月柄杆菌()的一种非典型TA系统SocAB中的毒素SocB与抗毒素SocA的互作机制,发现在有表达的细胞中诱导表达之后,细胞活性和形态没有显著变化;然而,在没有表达的细胞中诱导表达5 h后,细胞活性显著下降,菌落形成受到抑制,并且导致了细胞丝状化;并发现毒素SocB通过与滑动钳直接相互作用而抑制DNA复制延伸,由此也可推测TA系统参与了对微生物VBNC状态形成的调控。
通过上述研究成果,本文总结了TA系统对微生物VBNC状态形成的可能影响机制(图3):在不良环境下,TA触发系统中的基因发生差异表达,引起抗毒素的降解,导致毒素-抗毒素的比例失调,使游离毒素含量增加,这些游离毒素通过抑制DNA复制及蛋白质翻译、促进mRNA断裂、抑制细胞分裂等促进微生物VBNC状态的形成。
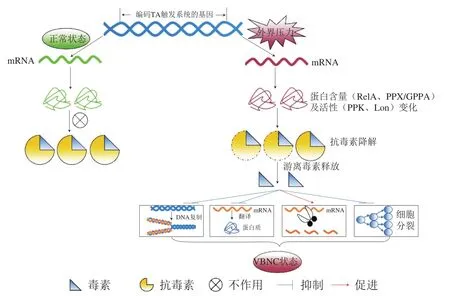
图3 TA系统对微生物VBNC状态形成的可能影响机制Fig. 3 Possible mechanisms for the influence of TA systems on the formation of microbial VBNC
4 结 语
微生物进入VBNC状态后代谢活性降低,且不能在常规培养基上生长繁殖,因此VBNC状态微生物不能被常规平板计数检测,也不能进行某些生理活性检测,引起假阴性的检测结果,从而给人类健康带来潜在威胁。已有证据表明VBNC状态致病菌参与食源性疾病暴发。本文从微生物普遍存在的TA系统出发,根据已有的研究成果,提出了TA系统对微生物VBNC状态形成的可能影响机制。但是,为了有效控制VBNC状态的形成,目前的研究还远远不够,除了要明确TA系统中毒素和抗毒素在VBNC菌体中的表达量及在VBNC状态形成中的作用方式之外,还应研究抗毒素对毒素解除制约的确切机制以及毒素在VBNC状态形成中发挥作用的活性位点,从而为寻找抑制VBNC状态形成的方法提供明确方向。此外,新的TA系统的发现也为揭示微生物的VBNC状态形成机制提供研究方向。
