紫甘薯多糖分离、组分鉴定及抗氧化代谢机理
2022-09-01戴威威鞠秀云
袁 博,卜 伟,戴威威,鞠秀云,王 欣,*
(1.江苏徐淮地区徐州农业科学研究所,农业农村部甘薯生物学与遗传育种重点实验室,江苏 徐州 221131;2.江苏师范大学生命科学学院,江苏 徐州 221116)
紫甘薯是甘薯()的一种紫色品种,是重要的经济作物,可作为粮食、饲料和工业原料使用,具有重要的产业地位。研究表明,紫甘薯块根提取物具有抗氧化、抗肿瘤、降血糖等作用,可用于预防心血管疾病和糖尿病,保健功能开发价值极高。
紫甘薯中含有多种重要的活性成分,如花色苷、多酚、黄酮和多糖。其中多糖是具有抗氧化、抗肿瘤、调节免疫、降血糖等功效的一类天然生物大分子,也是食品中重要的功能因子之一。研究开发紫甘薯多糖,探究其活性机制是目前紫甘薯多糖研究领域热点问题。Sun Jian等从紫甘薯中分离获得一种碱溶性多糖,研究表明其具有调节肠道微生物和抗炎症的活性。Tang Chao等从紫甘薯中分离获得一种可以调节免疫力的多糖,研究表明其可以增强小鼠体内免疫球蛋白A等免疫蛋白的表达水平。此外,紫甘薯多糖还在抗氧化、抗肿瘤、益生和护肝方面具有重要的应用潜力。
由于氧化因子的存在,细胞内会因氧化和抗氧化作用失衡导致氧化应激的发生,细胞内活性氧(reactive oxygen species,ROS)积累过量时会破坏细胞内生物大分子,如造成蛋白质氧化和DNA损伤,最终导致机体产生病理变化。目前,对于细胞氧化损伤的研究主要集中于测定氧化损伤过程中关键酶(如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalyse,CAT)和谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px))活力以及脂质氧化产物(丙二醛(malonaldehyde,MDA))的含量以评价氧化应激的水平。
本研究以紫甘薯为原料,通过高速逆流色谱技术分离获得一种水溶性多糖,通过高效液相色谱法(high performance liquid chromatography,HPLC)和气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)分别鉴定其单糖组成和糖苷键构型;利用HO构建细胞氧化应激模型,以评估紫甘薯多糖的抗氧化特性;同时通过代谢组学阐释紫甘薯多糖抗氧化的代谢机制,以期为紫甘薯多糖的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
紫甘薯(‘徐紫薯8号’)采自江苏徐州,洗净、切块、低温烘干备用。
鼠李糖(rhamnose,Rha)、葡萄糖(glucose,Glc)、甘露糖(mannose,Man)、半乳糖(galactose,Gal)、阿拉伯糖(arabinose,Ara)、葡萄糖醛酸(glucuronic acid,GlcA)(纯度均大于98%) 上海源叶生物科技有限公司;乙腈、甲醇、氯化钠(均为色谱纯)和其余试剂(均为分析纯) 国药集团化学试剂有限公司;100T-500T ROS测定试剂盒(化学荧光法)、CAT测定试剂盒(可见光法)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定试剂盒等均购自南京建成生物工程研究所。
1.2 仪器与设备
AB Triple 4600高分辨液相色谱-飞行时间质谱(liquid chromatography-time of flight mass chromatography,LC-TOF MS)、4500三重四极杆液相色谱串联质谱(liquid chromatography-tandem mass spectrometer,LC-MS/MS) 美国AB SCIEX公司;7890A-5975C GC-MS仪 美国安捷伦科技公司;OptiChromeA-600高速逆流色谱仪 江阴逆流科技有限公司。
1.3 方法
1.3.1 紫甘薯多糖提取
称取风干紫甘薯块1 kg,以料液比1∶10(/)加入蒸馏水超声提取30 min,过滤,反复操作3 次,合并提取液。调节pH值为4,向提取液中加入终质量分数2%纤维素酶(10 000 U/g),室温水解2 h,然后加入终质量分数2%酸性蛋白酶解液(≥45 U/mg)继续水解1 h。减压旋蒸浓缩多糖提取液至原有体积的1/3后加入一定体积的体积分数95%乙醇溶液至乙醇终体积分数为75%,静置过夜,3 000 r/min下离心,弃去上清液得沉淀。65 ℃水浴减压浓缩除去乙醇,加超纯水溶解,冷冻干燥获得紫甘薯粗多糖(polysaccharide from purple sweet potato,PSPP)。利用Sevag法去除PSPP中的蛋白质:取PSPP溶于蒸馏水中(1∶10,/),按体积比4∶1加入氯仿-正丁醇混合溶液(4∶1,/),混合后,转移至分液漏斗中,振荡、静置、分层,取上层水相溶液按体积比继续加入氯仿-正丁醇混合溶液后萃取。反复3~4 次,直至上层溶液在250~280 nm波长处无吸收峰,冷冻干燥获得去除蛋白的PSPP。
1.3.2 紫甘薯多糖的分离纯化
配制甲醇-甲基叔丁基醚-水混合溶液(3∶1∶2,/),静置过夜,下层为流动相,上层为固定相。使用高压泵将上层相以1 mL/min的速率泵入高速逆流色谱仪中,当出口出现液体后,开启高速逆流色谱仪,转速为10 000 r/min,转向为正向,柱温30 ℃。利用高压泵将下层相泵入高速逆流色谱仪中(1 mL/min)中,稳定60 min。取1 g冻干PSPP,使用5 mL下层相溶剂溶解,使用针泵注入PSPP溶液,开启自动接收器,使用示差检测器进行监测。取吸收峰对应的接受试管样品,冷冻干燥,分别获得纯化多糖PSPP01、PSPP02、PSPP03和PSPP04。采用DPPH自由基清除能力测定试剂盒测定DPPH自由基清除率,筛选抗氧化活性最大的多糖,结果显示只有PSPP03具有较明显的DPPH自由基清除活性,故以PSPP03进行后续实验。
1.3.3 PSPP03分子质量测定及傅里叶变换红外光谱分析
利用高效液相凝胶色谱(high performance gel permeation chromatography,HPGPC)法进行分子质量分析,色谱柱为OHpak SB-804HQ柱(8.0 mm×300 mm,10 μm),流动相为0.1 mol/L NaSO,流速为0.5 mL/min,柱温35 ℃,采用示差检测器检测。以分子质量为4 300、20 000、44 100、63 000 Da和123 500 Da的葡聚糖为标准品,以保留时间和葡聚糖标准品分子质量的对数进行拟合,得到线性回归方程,根据标准曲线方程计算PSPP03的分子质量。
采用傅里叶变换红外光谱对多糖结构信息进行表征:取约10 mg样品按质量比1∶200加入溴化钾,充分研磨后,放入压片机压片。使用傅里叶变换红外光谱仪进行分析,扫描范围500~4 000 cm(步长为1 cm)。
1.3.4 PSPP03单糖组成分析
PSPP03单糖组成分析参照文献[19]进行。取500 mg PSPP03加入安瓿瓶中,加入5 mL盐酸-甲醇溶液(2 mol/L),在氮气保护下置于80 ℃金属浴中水解15 h,氮气吹干,加入5 mL三氟乙酸(trifluoroacetic acid,TFA)溶液(2 mol/L),升温至120 ℃,继续水解2 h。冷却,过滤除去不溶物,减压旋转蒸发浓缩除去TFA,加水洗涤,再旋转蒸发浓缩,反复3 次,向最后一次浓缩产物加入2 mL蒸馏水,溶解即得完全水解产物PSPP03-B,待用。
使用HPLC分析单糖组成,流动相为体积分数0.05%甲酸-水溶液,流速0.5 mL/min,色谱柱为Repromer Ca(250 mm×8 mm,9 μm),柱温40 ℃,使用示差检测器进行监测。采用相同的方法分析Man、GlcA、Rha、Glc、Gal、Ara标准品。
使用0.5 mol/L的TFA溶液对PSPP03进行不完全水解(料液比为1∶20),用超纯水透析(截留分子质量50 000 Da),透析后取透析袋内样品(PSPP03-B)用2 mol/L的TFA溶液进行水解(料液比为1∶20),按照上述方法测定单糖组成,以确定主链单糖和侧链单糖组成。
1.3.5 PSPP03甲基化组成分析
取500 mg PSPP03于反应瓶中,加入2 mL干燥的二甲基亚砜(dimethyl sulfoxide,DMSO)溶液,溶解后加入20 mg干燥的NaOH,超声1 h使NaOH完全溶解,冰浴30 min,加入1 mL干燥的碘甲烷,在氮气的保护下,超声处理反应液1 h。加入蒸馏水终止甲基化反应。加入1 mol/L乙酸溶液中和反应。用超纯水对反应液进行透析(截留分子质量50 000 Da)至袋内颜色透明,冷冻干燥。将甲基化的多糖样品溶于体积分数90%甲酸溶液,密封后110 ℃解聚反应6 h。反应结束后减压蒸干,分别加入3 mL甲醇重复蒸干5 次。转移样品于含有2 mol/L TFA溶液的安瓿管中,封管后110 ℃水解反应2 h,随后减压蒸干。再加入3 mL蒸馏水充分溶解样品,随后加入30 mg NaBH还原乙酰化后制得甲基化的乙酸衍生物,使用氯仿萃取,回收氯仿层物质,减压浓缩后进行GC-MS分析。
GC条件:毛细管柱为HP-5(30 m×0.32 mm,0.25 μm),进样口温度250 ℃,程序升温,起始温度为80 ℃,以10 ℃/min升至260 ℃,保持10 min。
MS条件:电子电离离子源,离子源温度280 ℃,氦气流速1 mL/min。
1.3.6 多糖中花青素鉴定及活性检测
取适量PSPP03,按质量体积比1∶2加入水溶解,超声辅助溶解,过滤,清液转移至DEAE-52大孔树脂柱内,使用体积分数20%~60%的乙醇溶液进行洗脱,分别收集有色段(花青素)和无色段洗脱液。将用斐林试剂检测出含有多糖的无色段洗脱液合并,冷冻干燥获得去除花青素的多糖PSPP03-E。有色段浓缩后,使用氮气吹干仪进行处理,获得有色段物质PSPP03-P,PSPP03-P使用体积分数0.5%甲酸-甲醇溶液溶解后,利用LC-MS/MS进行分析。利用矢车菊素-3葡萄糖为内标(标准曲线方程:=417 726-108 870,=0.999 7)进行定量计算。
质谱条件:正离子模式全扫描和自动二级离子扫描,扫描范围为100~1 200/,载气为干燥氮气,离子源温度550 ℃,雾化气压力55 psi,涡轮增压气压力55 psi,气帘气压力25 psi,全扫描分析。
液相色谱条件:选用ACQUITY UPLC HSS T3 C色谱柱(2.1 mm×100 mm,1.7 μm),流动相A为体积分数5%甲酸-水溶液,B为体积分数5%甲酸-乙腈溶液,梯度洗脱为0~8 min 97% A,8~30 min 92% A,30~35 min 80% A,35~40 min 75% A,随后流动相A体积分数升至97%,稳定5 min。
为探究PSPP03结构对抗氧化能力的影响,采用DPPH自由基清除能力测定试剂盒分析PSPP03-E和PSPP03-P的抗氧化活性。
1.3.7 细胞培养、造模和给药处理
HepG2细胞培养于完全培养基(DMEM培养基+10%(质量分数,后同)胎牛血清+1%链霉素-青霉素溶液),取对数生长期的HepG2细胞,接种至6 孔板中,24 h细胞贴壁情况良好、覆盖率为80%时给药。
实验分组:对照组(CK)为正常培养细胞;造模组(HO处理组)为体积分数30% HO溶液孵育6 h;给药组(HO+PSPP03)为不同质量浓度(25 μg/mL和100 μg/mL,根据DPPH自由基清除率所选择)PSPP03预处理24 h,再用HO孵育6 h。
1.3.8 细胞活力测定
采用噻唑蓝(thiazolyl blue,MTT)法测定细胞活力,取1.3.7节培养细胞,每孔加入5 g/L MTT处理4 h,弃掉上清液,加入DMSO重悬,振荡10 min溶解沉淀,用酶标仪于490 nm波长处测定吸光度。细胞存活率按下式计算,设置6 个平行。

1.3.9 ROS及抗氧化酶活力测定
按1.3.7节培养细胞,使用ROS测定试剂盒(化学荧光法)测定ROS水平。同理,MDA、SOD、CAT、GSH-Px和还原型/氧化型谷胱甘肽(reduced glutathione/oxidized glutathione,GSH/GSSG)等水平均采用相应试剂盒进行测定。
1.3.10 代谢组学分析
取1.3.7节培养细胞并离心,沉淀中加入适量甲醇-丙酮(1∶1,/)混合溶液,超声提取30 min,12 000 r/min冷冻离心15 min,取上清液,使用旋转蒸发仪浓缩至干,使用0.5 mL甲醇溶解残余物,过0.22 μm滤膜,进LC-MS/MS分析。
色谱条件:选用ACQUITY UPLC HSS T3 C色谱柱(2.1 mm×100 mm,1.7 μm),流动相A为体积分数0.1%甲酸-水溶液,流动相B为体积分数0.1%乙腈-水溶液。梯度洗脱:0~5 min,5% B;5~10 min,5%~90% B;10~15 min,90% B;11 min,5% B。流速0.5 mL/min,进样量为10 μL,柱温35 ℃。
质谱条件:电喷雾电离离子源,正离子模式,碰撞能量(40±15)eV,电压5 500 V,离子源温度600 ℃,雾化气压力55 psi,涡轮增压气压力55 psi,气帘气压力25 psi,全扫描分析,质量扫描范围55~1 000 Da,一级质谱采集频率为0.25 s,二级质谱采集频率0.1 s。
1.4 数据处理与分析
统计数据采用GraphPrism 8.0软件进行统计分析,采用单因素分析法进行显著性分析,以<0.05表示差异显著。
代谢组学数据采用Peakview软件对采集的谱图进行峰提取,利用Markview软件对原始数据进行预处理。得到的数据集导入SIMCA 13.0软件进行主成分分析和正交偏最小二乘判别分析,获得差异代谢物。根据差异代谢物的碎片信息,在人类代谢组数据库(The Human Metabolome Database,HMDB)中进行比对,最终鉴定出差异代谢物。将差异代谢物导入MetaboAnalyst 5.0软件检索出富集代谢通路。
2 结果与分析
2.1 紫甘薯多糖分离纯化及鉴定结果
图1A为PSPP高速逆流色谱分离图,可以看出,PSPP在高速逆流色谱上共有4 个明显分离的峰。每个色谱峰分离度较好,表明可以利用高速逆流色谱对紫甘薯多糖进行一步分离、纯化。通过收集各色谱峰样品,对各色谱峰样品进行抗氧化活性测试,如图1B所示,PSPP03抗氧化活性最好,DPPH自由基清除率达到(92.27±5.03)%,接近PSPP的DPPH自由基清除率((95.05±6.77)%)。同质量浓度下,PSPP03 DPPH自由基清除率显著高于VC(<0.05),其他3 个多糖DPPH自由基清除率都不足10%,因此选取PSPP03作为后续研究的多糖样本。
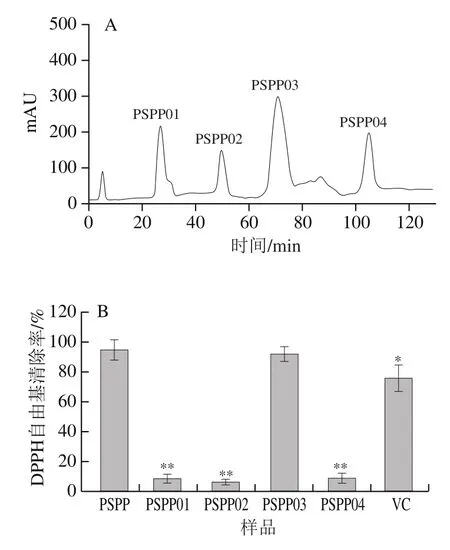
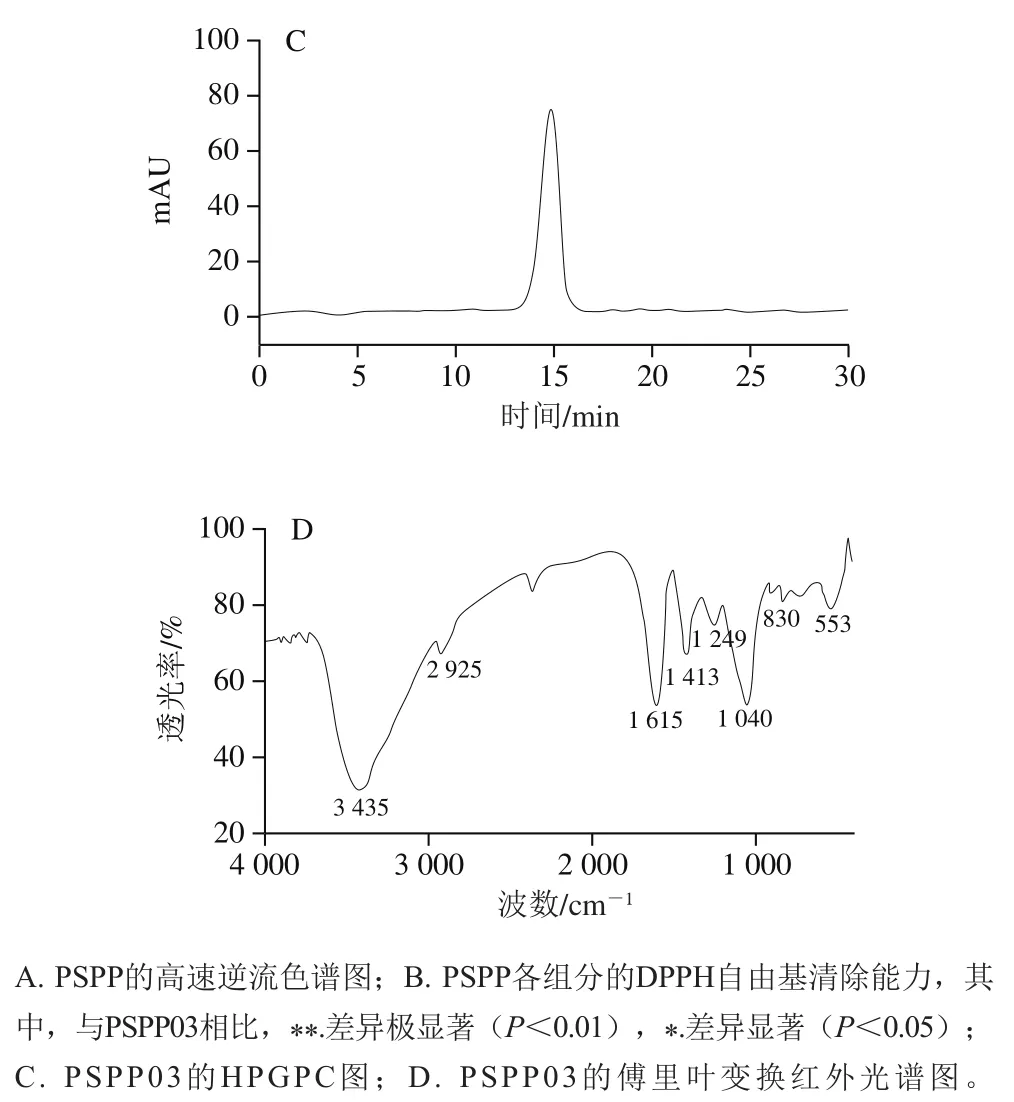
图1 紫甘薯多糖分离纯化及鉴定结果Fig. 1 Isolation and identification of polysaccharides from purple sweet potato
2.2 PSPP03分子质量测定结果
使用不同分子质量的葡聚糖作为标准品,利用HPGPC得到线性回归方程为lg=1.257 1-4.092 7(=0.997 2)。将PSPP03在HPGPC中的保留时间代入线性回归方程,计算得到分子质量为29.1 kDa。通过图1C可知,PSPP03在HPGPC上吸收峰相对狭窄且对称,说明PSPP03分子质量分布相对均一,为均一组分。
2.3 PSPP03傅里叶变换红外光谱分析结果
PSPP03的傅里叶变换红外光谱如图1D所示,3 435 cm处是—OH的伸缩振动峰,1 615 cm处吸收峰可能归属于糖醛酸中C=O基团,1 413 cm处吸收峰则可能是由多糖中甲基的弯曲振动所引起,同时1 040 cm处吸收峰由C—O—C的伸缩振动引起,提示PSPP03组分中存在吡喃糖环。综上,PSPP03在红外谱图中存在多糖的特征吸收峰,且可能为酸性多糖。
2.4 PSPP03单糖组成
利用HPLC分析PSPP03完全水解产物和不完全水解的产物PSPP03-B,结果如图2所示,PSPP03主要是由-Ara、-Man、-Rha、-GlcA和-Glc组成,物质的量比为16.2∶25.3∶7.1∶8.6∶10.8。PSPP03不完全水解后单糖主要为-Ara、-Man、-Rha和-Glc,物质的量比为10.6∶24.76∶6.6∶6.2,表明PSPP03主链主要是由这4 种单糖组成,侧链主要以-GlcA和部分-Ara和-Glc组成。
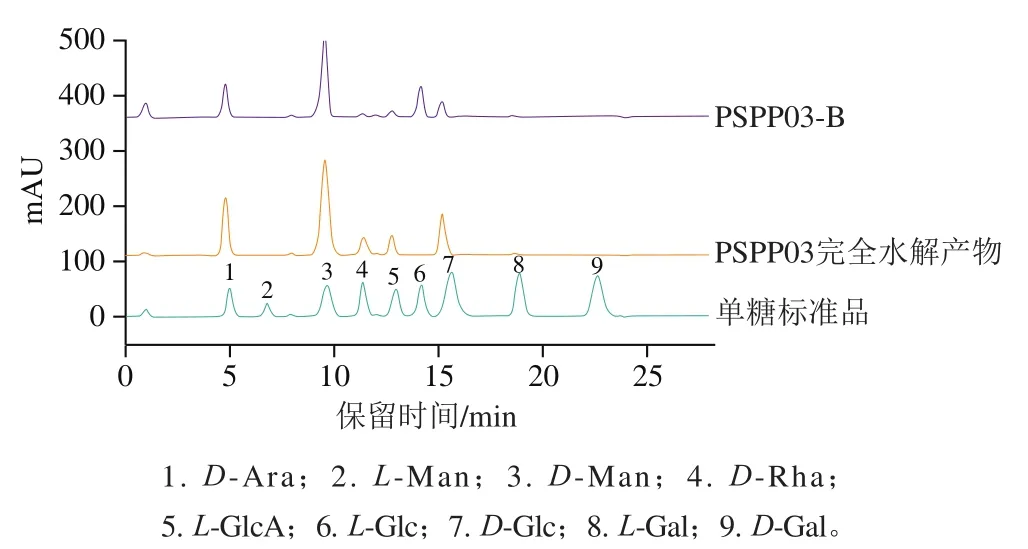
图2 PSPP03单糖组成HPLC色谱图Fig. 2 HPLC chromatogram showing monosaccharide composition of PSPP03
2.5 PSPP03甲基化分析结果
甲基化分析是一种检测多糖主链中糖苷键类型的有效方法。利用GC-MS对PSPP03甲基化产物进行分析,通过比对保留时间和质谱碎片信息,如表1所示,PSPP03结构中主要有7 种连接类型,包括→4)-Ara-(→1、→3)-Man-(1→、→3,4)-Man-(1→、→3,6)-Man-(1→、→3)-Glc-(1→、Glc-(1→和→4)-Rha-(1→,通过计算,上述7 种连接类型的物质的量比为21.34∶16.24∶2.65∶15.61∶15.61∶10.08∶11.75。根据单糖组成、物质的量比和甲基化物质的量比的结果,推测Glc-(1→可能是GlcA完全甲基化后被还原的产物。因此,结合单糖组成分析,PSPP03的主链主要连接类型可能有→4)-Ara-(→1、→3)--Man-(1→、→3,4)--Man-(1→、→3,6)--Man-(1→、→3)--Glc-(1→和→4)--Rha-(1→,而侧链的连接形式可能主要为-Glc-(1→以及→4)--Ara-(→1和→3)--Glc-(1→。
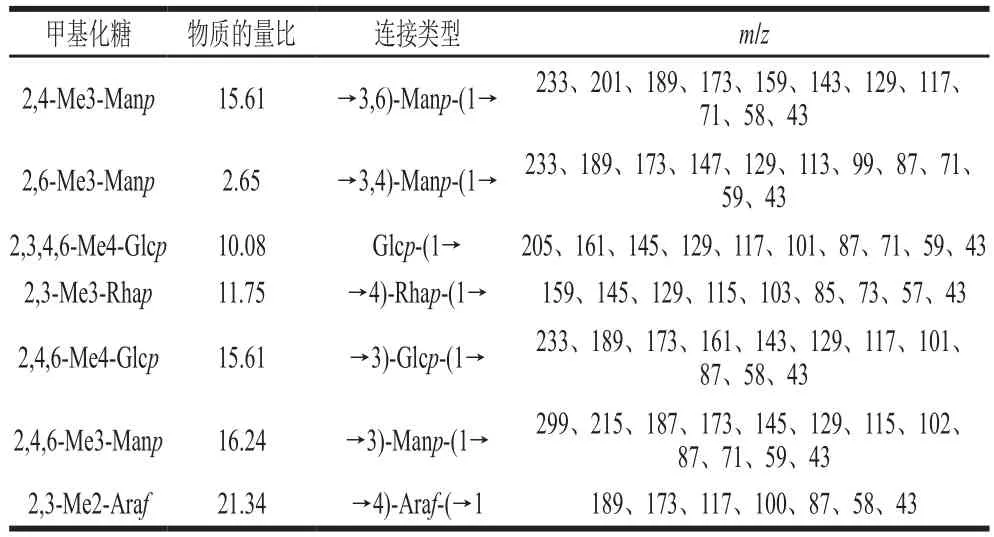
表1 PSPP03甲基化组成分析结果Table 1 Methylation results of PSPP03
2.6 PSPP03中花青素分析结果
根据多糖和花青素结构特点,花青素结构中的羟基易与多糖中羟基通过氢键进行结合。利用LC-MS/MS对PSPP03中花青素组分进行鉴定,结果如表2所示。PSPP03共鉴定出4 个花青素组分,分别为矢车菊素-3-槐糖苷-5-葡萄糖、芍药素-3-槐糖苷-5-葡萄糖、矢车菊素-3-羟基苯甲酰槐糖苷-5-葡萄糖和矢车菊素-3-(6’’’-咖啡酰槐糖苷)-5-葡萄糖。通过内标定量计算后,4 种花青素在PSPP03中的含量分别为14.68、12.62、2.85 μg/100 mg和6.82 μg/100 mg。结果表明,PSPP03结构中存在一定含量的花青素,其主要成分为矢车菊素-3-槐糖苷-5-葡萄糖和芍药素-3-槐糖苷-5-葡萄糖。

表2 PSPP03中花青素鉴定及含量Table 2 Identification and concentrations of anthocyanins in PSPP03
2.7 PSPP03对HepG2细胞抗氧化酶活力及非酶抗氧化物质的影响
对不同质量浓度PSPP03的DPPH自由基清除率进行测定,结果如图3A所示。DPPH自由基清除率随着PSPP03质量浓度增加而增加,当质量浓度为100 μg/mL时,DPPH自由基清除率达到了(94.05±18.12)%,PSPP03质量浓度为25 μg/mL时,DPPH自由基清除率为(55.62±8.03)%,半抑制质量浓度为22.19 μg/mL。因此后续细胞氧化损伤测试选择用PSPP03的25 μg/mL和100 μg/mL两个质量浓度。
图3B为不同处理组(CK、HO组、HO+25 μg/mL PSPP03和HO+100 μg/mL PSPP03)HepG2细胞的存活率。可以看出,PSPP03可以极显著提高细胞的HO耐受性,提高细胞存活率。当使用25 μg/mL PSPP03孵育细胞时,细胞存活率为(68.73±8.14)%,而HO处理组细胞存活率仅为(27.84±6.97)%。当PSPP03质量浓度为100 μg/mL时,细胞存活率为(94.17±4.50)%,与CK组并无显著差异。结果表明,PSPP03可以有效提高细胞在HO氧化作用下的细胞存活率,提示PSPP03具有良好的细胞抗氧化活性。
细胞内ROS、GSH和MDA水平反映了细胞内氧化程度,SOD、GSH-Px等酶活力反映细胞内抗氧化能力。图3C~F为PSPP03对细胞内抗氧化酶活力及非酶抗氧化物质(如GSH等)含量的影响。
从图3C可以看出,HO处理后,细胞内的ROS水平激增至CK组的4 倍(<0.01)。当加入PSPP03进行细胞孵育后,细胞内的ROS含量极显著低于HO处理组,且与质量浓度呈正相关,当质量浓度为25 μg/mL时,ROS相对水平是HO处理组的39.11%(<0.01),质量浓度为100 μg/mL时,ROS相对水平是HO处理组的24.59%(<0.01),接近CK组,说明PSPP03可以降低或者清除因HO引起的细胞内ROS积累。
图3D为PSPP03对细胞内CAT和SOD相对活力的影响,HO处理后,SOD和CAT的活性被抑制,相对活力仅分别为CK组的35.42%和38.89%(<0.01)。与HO处理组相比,当加入PSPP03后,质量浓度为25 μg/mL和100 μg/mL时CAT相对活力分别增加了1.28 倍和1.71 倍(<0.01),SOD活力分别增加了1.65 倍和2.00 倍(<0.01)。CAT在细胞内的主要作用是通过分解HO减轻细胞氧化损伤。SOD在人体内起氧化平衡作用,主要是通过清除细胞内的超氧阴离子自由基来保护细胞免受氧化损伤。
图3E为PSPP03对细胞内GSH-Px相对活力和GSH相对含量的影响,经HO处理后,细胞内GSH-Px相对活力极显著下降(<0.01),活力下降至CK组的16.44%,GSH含量也下降到CK组的30.76%。加入PSPP03后,GSH-Px相对活力极显著提高(<0.01),质量浓度为25 μg/mL和100 μg/mL时分别提高了3 倍和7 倍。表明PSPP03可以通过提高细胞内GSH-Px活性催化细胞内过氧化物分解,减轻细胞所受过氧化物的损伤。GSH是细胞中重要的非酶类抗氧化物质之一,其主要作用是维持免疫系统稳定和抗氧化。本研究中,GSH相对含量在PSPP03作用后较HO处理组有所增加。GSH在细胞内主要通过淬灭自由基和清除过氧化物来减轻细胞氧化程度,其含量反映细胞氧化程度。GSH转化过氧化物过程需要GSH-Px的催化,本研究中HO处理会降低GSH-Px的活性,因此会造成细胞内GSH无法转变为GSSG,从而导致细胞内过氧化物积累。加入PSPP03后,一方面提高了GSH-Px活力,促进了GSH的催化形成;另一方面,PSPP03可能通过触发GSH合成代谢通路,从而促进GSH的转化或生成。
MDA是细胞内脂类物质分解的最终产物,MDA的积累会导致细胞代谢受阻,造成细胞功能障碍,甚至死亡。GSSG是GSH的氧化产物,GSSG与MDA的含量都能够反映细胞的氧化损伤程度。PSPP03对细胞内MDA相对含量的影响如图3F所示,HO作用后,细胞内MDA相对含量是CK组的2.32 倍(<0.01);当PSPP03作用后,MDA含量出现下降趋势,且下降程度与PSPP03质量浓度成正比,25 μg/mL和100 μg/mL时,MDA相对含量分别下降到HO处理组的54.67%和41.06%(<0.01)。GSSG相对含量变化趋势与MDA相似,HO处理会促使细胞内GSSG含量激增,上升到CK组的6.21 倍(<0.01)。当PSPP03处理后,GSSG相对含量在25 μg/mL和100 μg/mL PSPP03作用下分别下降到HO处理组的32.64%和20.00%(<0.01)。结果提示,PSPP03可以有效减少HO作用下细胞内MDA和GSSG的积累,降低细胞的氧化损伤。
对去除花青素后的多糖(PSPP03-E)进行抗氧化活性分析,结果如图4所示,去除花青素后,PSPP03-E抗氧化活性较未处理PSPP03下降了9.48%(<0.05),活性下降幅度较小。对洗脱掉的花青素(PSPP03-P)进行DPPH自由基清除活性测定,结果表明,PSPP03-P活性与未处理PSPP03相比DPPH自由基清除率下降了26.50%(<0.01)。通过比较可知,PSPP03的抗氧化活性主要来源于多糖部分,结合的花青素对抗氧化活性影响相对较小。
研究表明,多糖的结构与抗氧化活性有直接关系。吡喃型结构一般被认为是多糖抗氧化的重要结构因素,根据表1质谱数据对比数据库可知本研究中获得多糖中Man、Rha、Glc构型均为吡喃型。同时PSPP03中存在一定量的花青素(表2),研究表明花青素具有较强的抗氧化性。本研究中,洗脱后的花青素抗氧化活性仍超过60%,说明花青素的存在对PSPP03抗氧化性也有一定的贡献。
多糖可以通过清除DPPH自由基和ROS以及提高抗氧化酶活性达到抗氧化的目的。如Fang Zhiyu等发现南瓜多糖可以通过清除ROS和提高CAT活性达到抗氧化的目的。此外,多糖还可以降低细胞非酶系氧化物质,如MDA、GSSG等水平,从而减轻氧化损伤程度。如朱慧民等发现红豆沙多糖能够通过降低MDA含量从而减轻心肌缺血-再灌注损伤小鼠模型中心肌细胞的氧化损伤。本研究中,从紫甘薯中分离获得的多糖PSPP03可以有效地提高细胞内抗氧化酶系活性,同时能够影响非酶系抗氧化物质的水平,减轻HO对细胞的损伤。
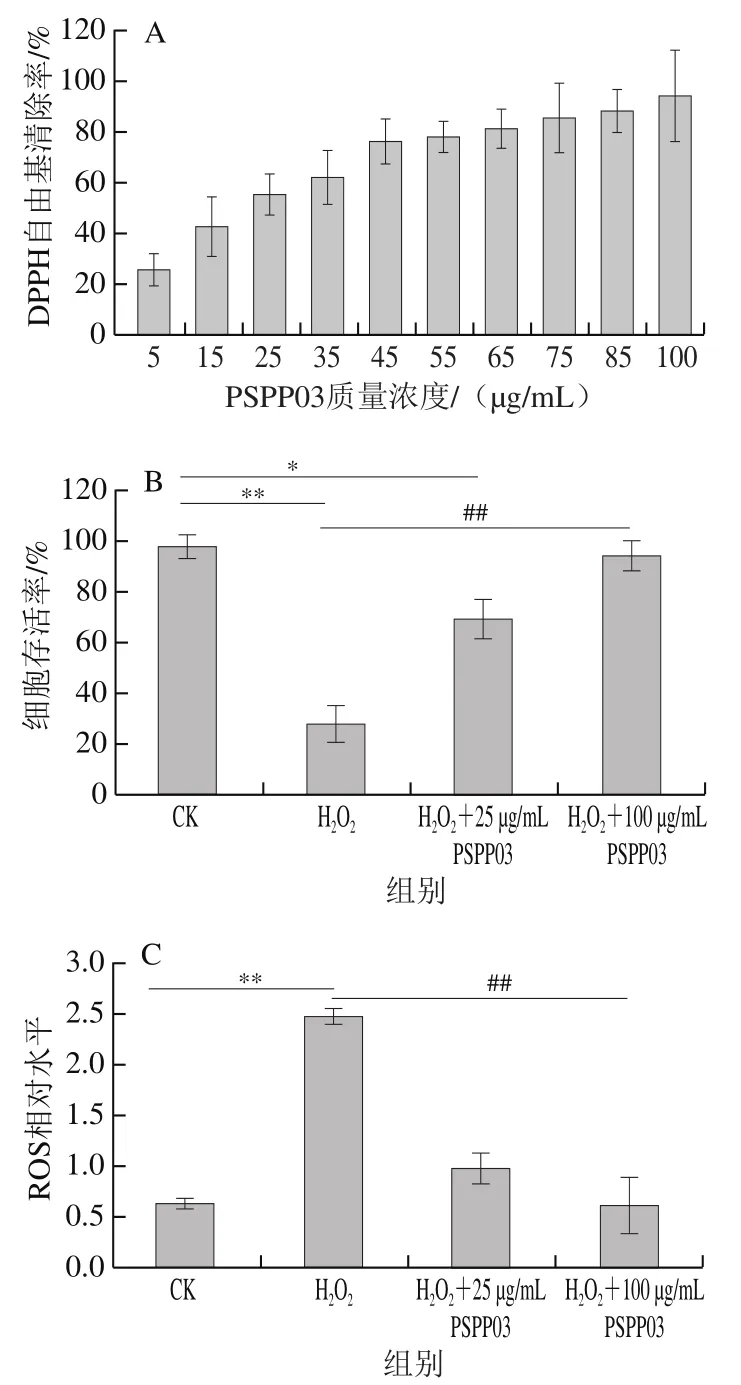
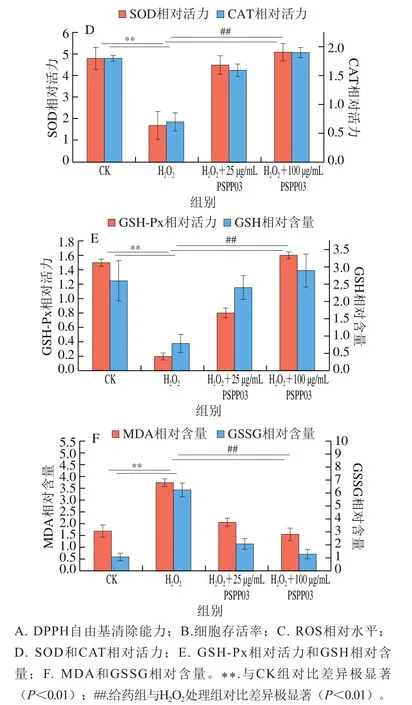
图3 基于细胞氧化损伤模型的PSPP03抗氧化活性Fig. 3 Antioxidant activity of PSPP03 in cell model of oxidative damage
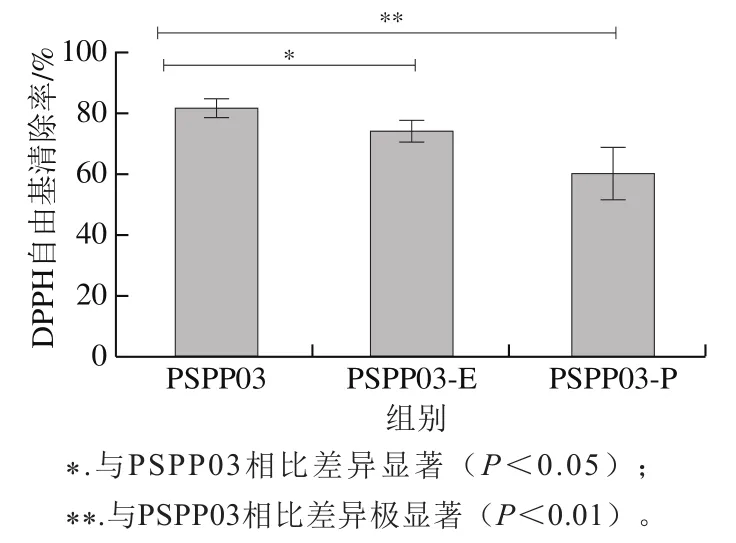
图4 PSPP03洗脱花青素前后的抗氧化能力Fig. 4 Antioxidant capacity of PSPP03 before and after removal of anthocyanins
2.8 PSPP03抗氧化代谢机理
对模型细胞代谢物进行提取、分析,经过软件归一化和转化后,导入软件进行主成分分析,结果如图5A所示。4 组细胞代谢物样本在组内聚集,而组间有明显的距离,表明该模型建立良好,能很好地预测结果。根据图5A进行分析,PSPP03两个给药组和HO处理组对主成分1影响显著,且从距离判断,给药组对主成分1的影响要强于HO处理组。
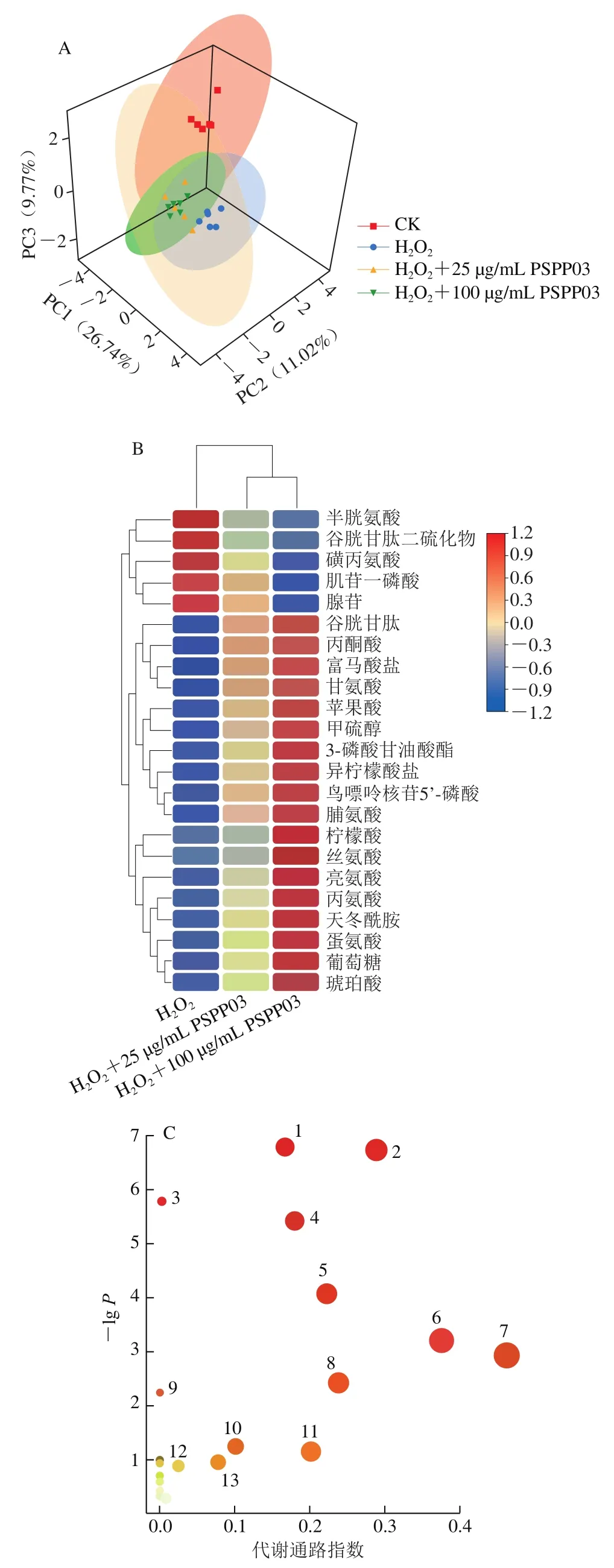
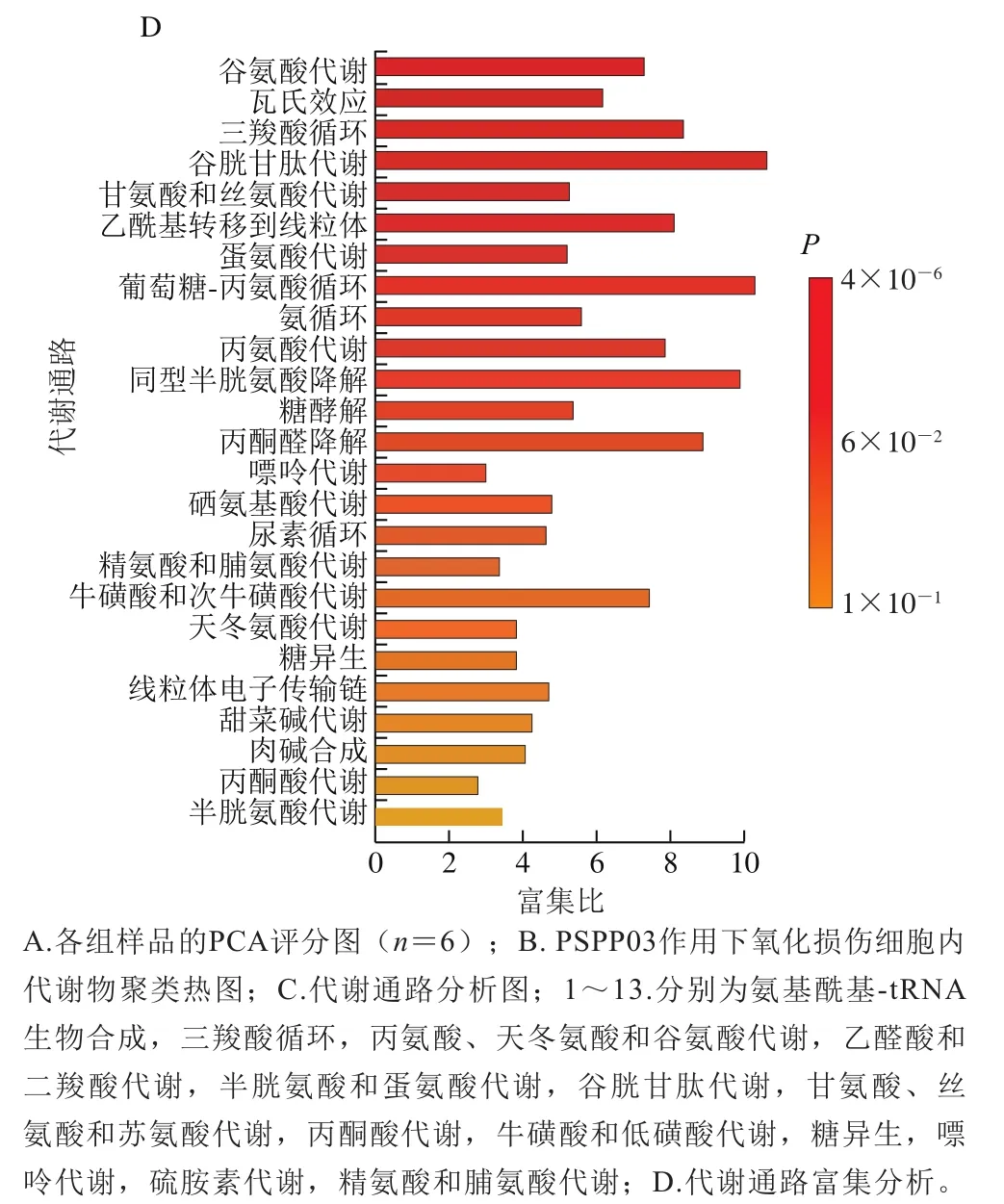
图5 基于代谢组分析PSPP03对H2O2诱导的氧化损伤细胞代谢谱的变化Fig. 5 Metabolomics analysis of changes in metabolic profile of cells induced by PSPP03 and H2O2
根据质谱数据,对4 组样品中的代谢物进行鉴定,结果如表3所示,根据显著性共鉴定出23 个具有显著性差异(<0.05且VIP>1.5)的差异代谢物,其中17 个差异代谢物上调,6 个差异代谢物下调。根据鉴定的化合物种类,PSPP03处理引起的细胞内差异代谢物质主要分为2 类:一类为碳水化合物;另一类为氨基酸。利用MetaboAnalyst软件进行代谢通路富集分析,发现PSPP03主要可以影响细胞的糖代谢(三羧酸循环、丙酮酸代谢和糖异生)和氨基酸代谢途径。图5B为PSPP03作用下氧化损伤细胞内23 种差异代谢物的聚类热图,可以明显看出高质量浓度PSPP03给药组可以显著提高部分代谢物的相对含量,如柠檬酸和丝氨酸。柠檬酸是三羧酸循环中重要的中间产物,通过代谢通路的影响分析,三羧酸循环在PSPP03给药后受到显著影响(图5C、D)。三羧酸循环可以影响氨基酸代谢,如精氨酸合成以及丙氨酸、天冬氨酸和谷氨酸代谢等。此外,PSPP03还对丝氨酸的合成与代谢起到促进作用,丝氨酸在细胞内可以通过谷氨酸半胱氨酸连接酶的作用转化为谷胱甘肽,对抗氧化具有重要的作用。同时,差异代谢物中,还存在3 个嘌呤代谢相关的化合物——肌苷一磷酸、鸟嘌呤核苷5’-磷酸和腺苷。这3 种代谢物与细胞内ATP能量代谢具有一定的关联,提示PSPP03对细胞中的三羧酸循环也可能具有一定的影响。
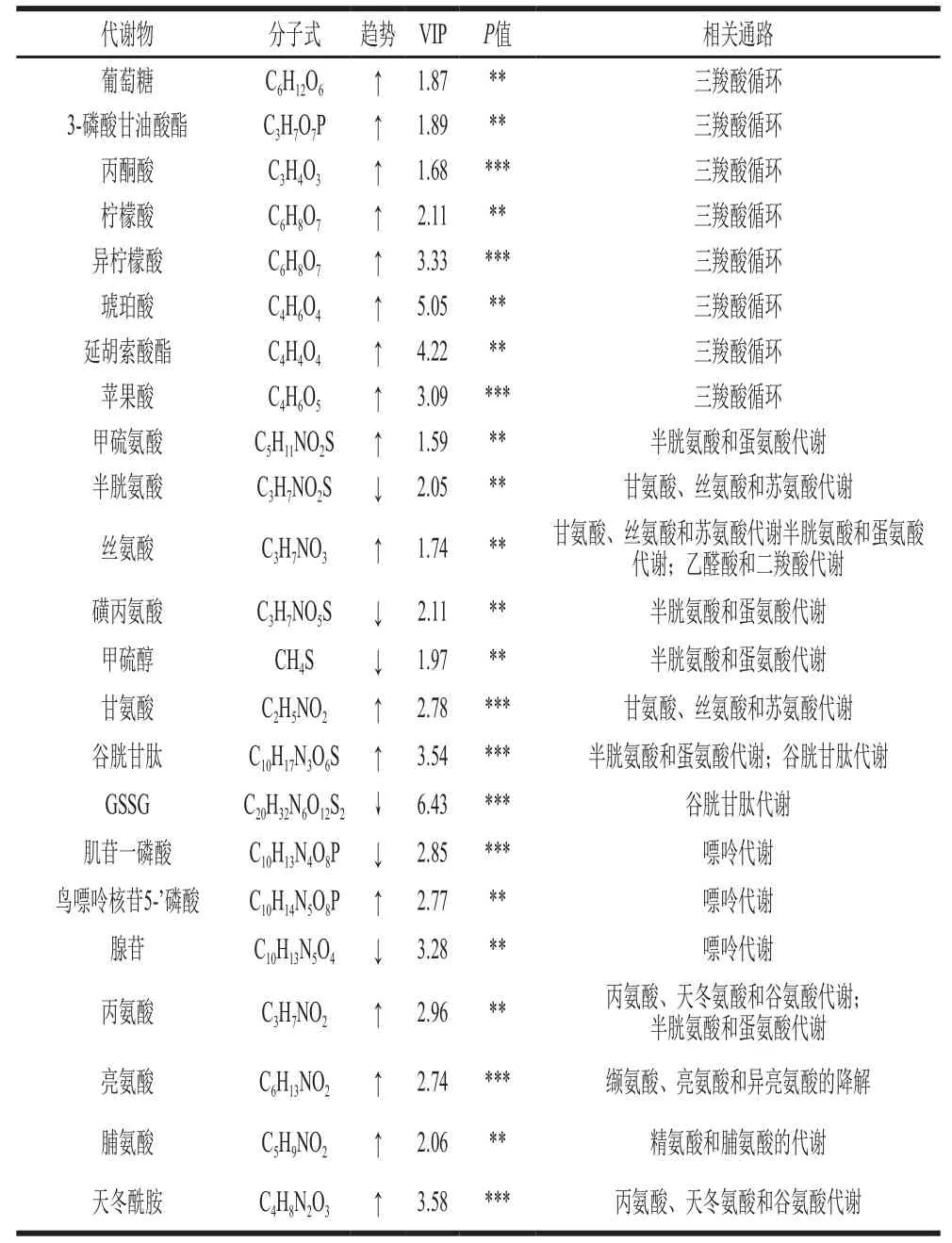
表3 基于LC-MS鉴定PSPP03给药组和H2O2处理组差异代谢物Table 3 Identified differential metabolites between PSPP03- and H2O2-treated cells
为验证代谢组结果,挑取6 种差异代谢物利用LC-MS/MS进行精确定量,结果如表4所示。经过PSPP03给药后,25 μg/mL给药组中各指标丙酮酸、柠檬酸、丝氨酸和脯氨酸物质的量分别是HO处理组的1.38、1.33、2.03、1.67 倍,100 μg/mL给药组中各指标物质的量分别是HO处理组的1.49、1.39、3.55、1.84 倍。而腺苷和GSSG在25 μg/mL PSPP03给药条件下分别下降到HO处理组的58.45%和49.92%,100 μg/mL PSPP03条件下分别下降到HO处理组的22.48%和21.14%。
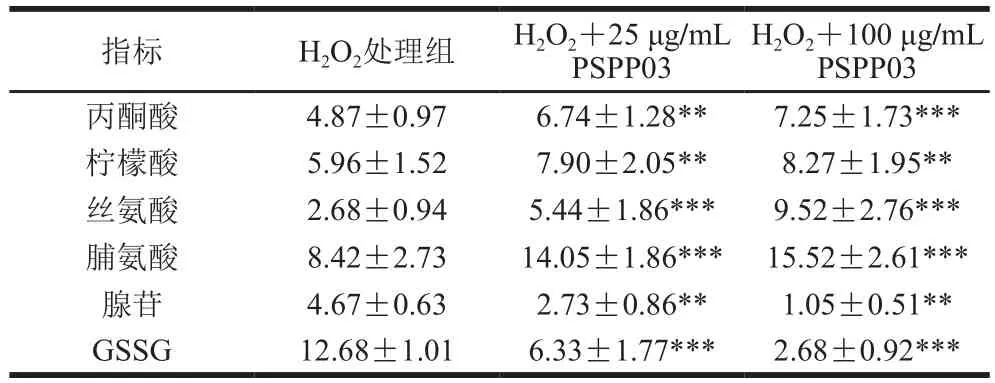
表4 基于LC-MS/MS对部分差异代谢物进行定量分析Table 4 Quantitative analysis of differential metabolites by LC-MS/MS mmol
3 结 论
本研究从紫甘薯中分离获得4 个纯多糖,DPPH自由基清除能力分析结果表明PSPP03具有显著的抗氧化潜力。
利用HPLC技术对PSPP03的结构进行了初步分析,其主要由-Ara、-Man、-Rha、-GlcA和-Glc组成,物质的量比为16.2∶25.3∶7.1∶8.6∶10.8。甲基化分析结果表明其主链连接主要构型为→4)--Ara-(→1、→3)--Man-(1→、→3,4)--Man-(1→、→3,6)--Man-(1→、→3)--Glc-(1→和→4)--Rha-(1→,而侧链的连接形式可能主要为-Glc-(1→以及→4)--Ara-(→1和→3)--Glc-(1→。PSPP03中含有一定量的花青素,主要成分为芍药素-3-槐糖苷-5-葡萄糖苷和矢车菊素-3-槐糖苷-5-葡萄糖苷,其可能主要以氢键形式结合。通过分析比较抗氧化性可知,PSPP03的抗氧化活性主要来源于多糖部分。
利用HO诱导建立氧化损伤细胞模型,探究了PSPP03细胞抗氧化能力。结果表明PSPP03可以显著降低细胞内ROS水平,减轻氧化损伤程度;同时显著提高SOD、CAT、GSH-Px等抗氧化酶活力和GSH水平;显著降低GSSG和MDA等有害物质含量。
代谢组学分析结果表明,PSPP03细胞内抗氧化代谢机制有可能是通过促进相关氨基酸代谢和三羧酸循环从而减轻细胞的氧化损伤。
