卵清白蛋白-没食子酸-葡聚糖共聚物对白藜芦醇稳定性和抗氧化性的影响
2022-09-01孟令莉侯惠静张晓燕雷丹丹何雨薇吴子健
孟令莉,张 晗,侯惠静,张晓燕,雷丹丹,赵 培,何雨薇,吴子健,*
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津职业大学生物与环境工程学院,天津 300410)
白藜芦醇是一种广泛存在于浆果(如葡萄)、坚果(如花生)以及块茎(如虎杖)等中的疏水性非黄酮类多酚化合物,并且反式白藜芦醇(图1)结构较稳定,具有更强的抗氧化、抗炎、抗癌、保护心脏和保护神经等生理活性。然而白藜芦醇的水溶性低,稳定性差(在酸性pH值下或光照条件下极易降解),极大地限制了其在食品以及医药行业中的应用。目前,有学者利用多糖等天然或人造大分子包埋改善白藜芦醇的稳定性,如Wang Peng等通过淀粉凝胶颗粒提高白藜芦醇稳定性和缓慢释放,进而提高其利用率;Jo等利用蜡质玉米淀粉和壳聚糖封装白藜芦醇的Pickering乳剂提高其在肠道保留时间。

图1 反式白藜芦醇的结构式Fig. 1 Chemical structure of trans-resveratrol
乳液分为水包油(O/W)和油包水(W/O)两类。乳液中含有纳米或微米级固体颗粒(如蛋白质、多糖或磷脂)被称为Pickering乳液。Pickering乳液可有效提高疏水性物质(特别是疏水性功能性成分,如类胡萝卜素类、多酚类物质)的水溶性、稳定性以及生物利用度。其中,蛋白质是常用的Pickering乳液的乳化剂,蛋白分子中的疏水区域可吸附于疏水性物质的表面,促进疏水性物质在水中的分散;然而,蛋白质易受到热处理、pH值和离子强度的影响,甚至发生变性和团聚,造成由蛋白质稳定体系的相分离。而蛋白质与多酚或多糖结合会提高其稳定性:在蛋白质-多糖共聚物中,蛋白部分可吸附于油滴表面,而多糖部分不仅具有水溶性,又可产生强烈的空间阻碍防止油滴聚集,更具有对热、pH值、离子强度较高的稳定性,因而常用于疏水性活性物质(如姜黄素、叶黄素、-胡萝卜素等)的包埋;另外,Pickering乳液体系中,油滴的比表面积大,被封装的疏水性物质易与氧分子和自由基发生氧化,可通过在共聚体系中增加多酚来提高其抗氧化性能,多酚与多糖-蛋白之间可通过共价或非共价作用形式进行结合,特别是多酚与多糖-蛋白之间的共价结合不仅使所获得的多酚-多糖-蛋白具有更高的稳定性(即pH值稳定性、热稳定性以及对离子强度的稳定性等),而且具有更强的抗氧化性,使所包封的疏水性物质受到多酚的保护,目前该三元共聚物可应用于稳定生物活性物质的Pickering乳液中,如:Yan Yong等使用的牛血清白蛋白-葡聚糖(dextran,DEX)-绿原酸三元共聚物显著提高了负载叶黄素Pickering乳液的理化稳定性以及叶黄素的生物可及性。卵清白蛋白(ovalbumin,OVA)是源于鸡卵清的含糖基的球蛋白,分子质量为44.3 kDa,其蛋白部分由385 个氨基酸残基组成,一半以上是疏水性氨基酸残基,具有优异的功能特性(如乳化、增稠、胶凝和发泡),可作为生物活性物质的包封载体,可显著改善姜黄素的水溶性和光稳定性,然而,OVA热稳定性差且在等电点附近易产生沉淀,而通过美拉德反应对OVA进行糖基化改性可有效改善其热稳定性和pH值稳定性等加工特性;此外,DEX是一类还原性多糖,可与蛋白质进行共价结合,提高蛋白的乳化、凝胶等功能特性;没食子酸(gallic acid,GA)是一种小分子植物多酚,具有很强抗氧化作用,其分子中的羟基和羰基基团可与蛋白质或多糖形成稳定的复合物,使形成的共聚物或复合物具有较高的乳化稳定性(emulsification stability index,ESI)和抗氧化能力。
本研究为提高白藜芦醇稳定性和抗氧化性能,采用OVA、GA和DEX结合的共聚物作为封装材料,并利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳、傅里叶变换红外光谱、荧光光谱法等对共聚物的结构进行表征,采用高压均质法制取包埋白藜芦醇的Pickering乳液,通过动态光散射技术来评价乳液的稳定性,通过测定贮存期间白藜芦醇的含量和乳液的抗氧化性能等进一步研究OVA-GA-DEX对白藜芦醇的稳定性及抗氧化性能的影响。
1 材料与方法
1.1 材料与试剂
白藜芦醇(≥98%)、OVA(≥90%)、DEX(≥95%,10 kDa)、GA(≥98%)、中链甘油三酯(medium chain triglycerides,MCT) 上海源叶生物科技有限公司;蛋白Marker 上海麦克林试剂有限公司;SDS、考马斯亮蓝R250、-巯基乙醇 北京索莱宝科技有限公司;邻苯二甲醛、三羟甲基氨基甲烷、,,’,’-四甲基二乙胺 生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯,实验用水由实验室超纯水机制备。
1.2 仪器与设备
NanoPhotomerer-N50超微量紫外分光光度计 德国Implen公司;LGJ-20F真空冷冻干燥机 北京松源华兴科技发展有限公司;LUMOS傅里叶变换显微红外光谱仪德国布鲁克公司;SE 260型垂直电泳系统 美国Hoefer公司;UV-1800紫外-可见分光光度计 苏州岛津仪器有限公司;FL970型荧光分光光度计 香港Techcomp公司;Infinite M200 Pro多功能酶标仪 瑞士Tecan公司;AH100B高压均质机 加拿大ATS工程公司;NanoSight NS300纳米颗粒跟踪分析仪 马尔文帕纳科公司;Phenom XL扫描电子显微镜 美国飞纳公司;FJ200-SH型数显高速均质分散器 上海标本模型厂。
1.3 方法
1.3.1 OVA样品前处理
将OVA按照1~2 g/100 mL分散于超纯水中,25 ℃磁力搅拌3 h使其充分溶解,得到的蛋白溶液于4 ℃贮存12 h过夜,然后4 ℃、6 000 r/min离心10 min,取上清液,并除去不溶物,采用UV法,将上清液中的蛋白质量浓度调至约10.00 mg/mL。
1.3.2 共聚物的制备
参考Rawel等采用碱法接枝和Sun Jun等的干热美拉德反应法制备OVA-GA、OVA-DEX和OVA-GA-DEX共聚物:将OVA按照1 g/100 mL分散于超纯水中,加入GA(OVA与GA质量比5∶1)搅拌至充分溶解,使用0.5 mol/L NaOH溶液调pH值至9.0,混合物在室温下搅拌反应24 h后使用透析袋(截留分子质量8 000~14 000 Da)透析48 h,冻干获得OVA-GA共聚物;OVA和DEX质量比1∶1混合均匀,使OVA质量浓度为10 mg/mL,将混合物冻干后将其置于相对湿度79%,60 ℃条件下反应72 h获得OA-DEX共聚物粉末。将OVA-GA粉末代替OVA重复上述步骤制备OVA-GADEX共聚物粉末。
1.3.3 SDS-PAGE分析
参照Yu Yali等的方法进行SDS-PAGE测定。
1.3.4 接枝度测定
参照Sun Jun等的方法测定共聚物的接枝度。
1.3.5 傅里叶变换红外光谱分析
参考Ahmad等的方法,使用配备了DTGS探测器的红外光谱仪,将样品通过金门钻石单反射ATR进行扫描,扫描范围4 000~600 cm,分辨率为4.0 cm。使用OMNIC软件,对光谱的酰胺I代进行傅里叶去卷积,并使用多重高斯曲线拟合和二阶导数计算,计算出二级结构的组成。
1.3.6 内源性荧光测定
参考Xiao Nanhai等的方法:将样品粉末溶解于磷酸盐缓冲溶液(10.0 mmol/L,pH 7.2)至蛋白质量浓度为0.2 mg/mL,进行荧光扫描,操作条件如下:激发波长280 nm,发射波长范围300~500 nm,狭缝宽度5.00 nm,扫描速率1 200 nm/min。
1.3.7 表面疏水性测定
参考Yu Yali等的方法:用磷酸盐缓冲溶液(10 mmol/L,pH 7.2)将各样品中蛋白质量浓度至0.01~0.05 mg/mL,取4 mL样品与20 µL ANS溶液(8.0 mmol/L)混合,25 ℃孵育2 min后测定其荧光强度。操作条件如下:设置激发波长390 nm,发射波长400~600 nm,扫描速率600 nm/min,将荧光强度对蛋白质量浓度作图进行拟合,曲线的斜率即表面疏水性()。
1.3.8 乳化性和ESI
参考Li Xueqi等的方法:将样品用超纯水配成蛋白质量浓度为5 mg/mL的样品溶液,以体积比3∶1将蛋白溶液与大豆油混合,采用高速均质分散器在10 000 r/min搅打2 min,分别于第0和30分钟从底部吸取溶液50 µL,将其加入到5 mL 0.1%的SDS溶液中混合均匀,测定OD,乳化性(emulsifying activity index,EAI)和ESI按式(1)、(2)计算:
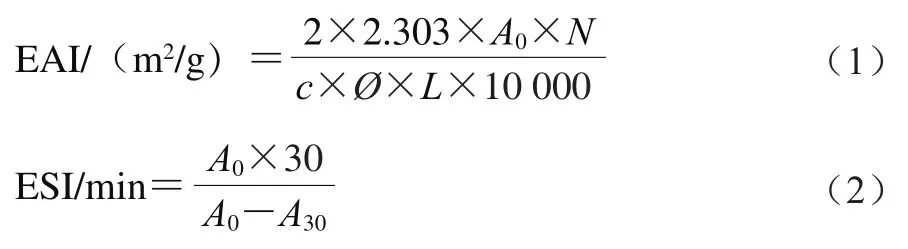
式中:为第0分钟吸光度;为第30分钟吸光度;为稀释倍数;为蛋白质量浓度/(g/mL);为油相体积分数0.25;为光经1 cm。
1.3.9 Pickering乳液的制备
参考Wang Chaonan和Wang Peng等的方法进行:白藜芦醇加入到含有90% MCT和10%(/)乙醇溶液中使其质量浓度为5 mg/mL,避光搅拌1 h使白藜芦醇充分溶解。将含有白藜芦醇的MCT溶液和共聚物水溶液(以10 mg/mL蛋白质量浓度计)以5∶95(/)混合,10 000 r/min搅拌2 min,后采用高压均质机均质(600 bar,4 ℃)7 次得到封装白藜芦醇的乳液。
1.3.10 白藜芦醇含量的测定
将75%乙醇溶液与乳液19∶1(/)比例混合,使白藜芦醇充分溶出后适当稀释,测定波长306 nm的吸光度,采用白藜芦醇制得标准曲线,按式(3)计算乳液中白藜芦醇的保留率:

式中:为包埋时白藜芦醇的质量浓度,其原始质量浓度为250 µg/mL;为所得乳液中白藜芦醇的质量浓度/(µg/mL)。
1.3.11 Pickering乳液粒径的测定
用超纯水将样品乳液稀释400 倍,采用纳米颗粒跟踪分析仪检测Pickering乳液的平均粒径和粒径分布。对于所有的实验,测定均重复3 次,每次5 组,时间为1 min,测定时平衡2 min,温度设为25 ℃。
1.3.12 抗氧化活性测定
1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picrylhydrazyl,DPPH)自由基清除率按Feng Jilu等的方法适当修改:使用去离子水将乳液稀释10 倍,使用乙醇配制1.2 mmol/L DPPH溶液,2 mL DPPH-乙醇溶液加入1 mL样品溶液,混合置于暗处室温下反应30 min。测定吸光度。DPPH自由基清除率按式(4)计算:

式中:为去离子水和DPPH/ABTS溶液吸光度;为样品和乙醇吸光度;为样品和DPPH/ABTS溶液吸光度。
2,2’-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-amino-di(3-ethyl-benzothiazoline sulphonic acid-6)ammonium salt,ABTS)阳离子自由基清除率测定按照Kevij等的方法适当修改:将ABTS溶液(7.0 mmol/L)和过硫酸钾溶液(2.45 mmol/L)以1∶1(/)比例混合,暗处静置16 h,使用去离子水稀释,使在波长734 nm处的吸光度为0.7±0.02,取0.2 mL样品乳液加入3 mL ABTS溶液混合反应,测定吸光度。ABTS阳离子自由基清除率按式(3)计算。
1.4 数据统计分析
使用SPSS 23进行数据分析,差异显著性采用单因素ANOVA检验,<0.05,差异显著;使用GraphPad Prism 8软件进行绘图。
2 结果与分析
2.1 SDS-PAGE和接枝度分析
SDS-PAGE可有效确定DEX或GA与OVA是否发生了共价结合,以及接枝后共聚物的分子质量。如图2A所示,OVA样品显示其分子质量为44 kDa,OVA-GA共聚物样品条带高于44 kDa,比OVA分子质量大,且条带的颜色较深,OVA-DEX共聚物样品条带从44 kDa开始往上扩展,而且越往分子质量大的部分条带颜色越深,说明分子质量较OVA增大,OVA-GA-DEX共聚物样品条带也是从44 kDa附近开始往上扩展,但与泳道4中的OVA-DEX样品相比,条带在44~70 kDa颜色更深;SDSPAGE图谱结果说明:OVA与DEX、OVA与GA发生了共价结合,这与Kim等和Yan Yong等的研究结果一致;如图2B所示,OVA-DEX的接枝度((12.73±0.74)%)明显高于OVA-GA-DEX((8.51±0.35)%),对比OVA-GA-DEX在44 kDa与OVA-DEX比还有较明显的电泳条带,这是由于GA与部分游离氨基结合从而占据了一部分空间位阻,使DEX更难以和蛋白结合导致。
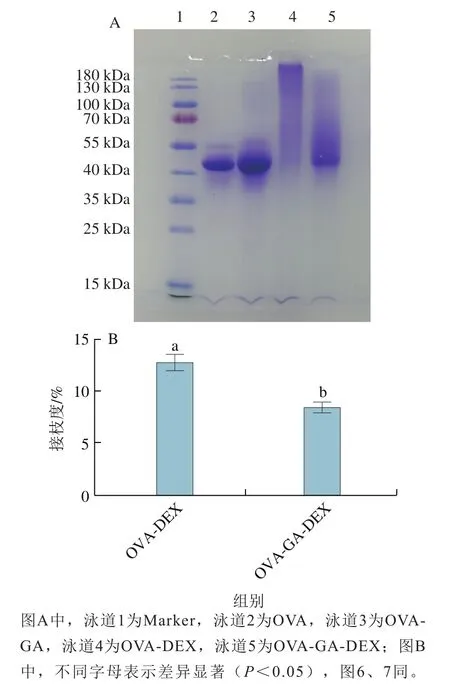
图2 共聚物的SDS-PAGA(A)和接枝度(B)Fig. 2 SDS-PAGE pattern (A) and grafting degree of conjugates (B)
2.2 傅里叶变换红外光谱分析
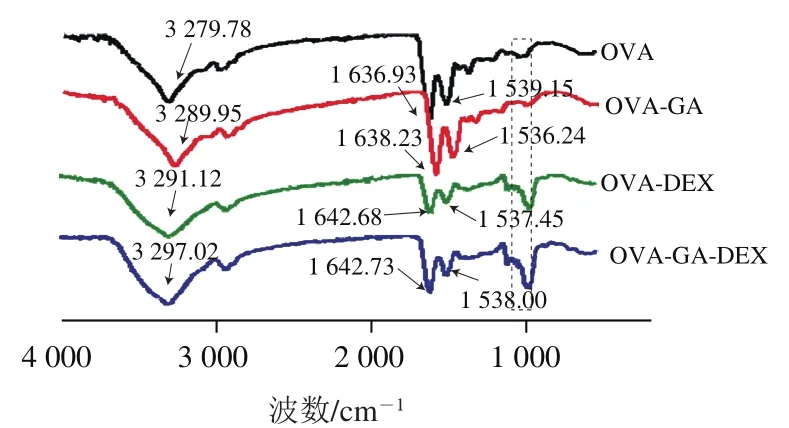
图3 OVA及共聚物的傅里叶变换红外光谱图Fig. 3 Fourier transform infrared spectra of OVA and conjugates

图4 OVA及共聚物二级结构组成Fig. 4 Secondary structure compositions of OVA and conjugates
傅里叶变换红外光谱是研究分子中基团的有效手段,也可分析蛋白质的二级结构组成。如图3所示,共聚物图谱在3 300~3 200 cm中峰变宽并向更大的波数移动,而在3 300~3 200 cm范围代表O—H键,因此这是与蛋白共价结合的DEX、GA结构中含有—OH引起;蛋白质酰胺I带(1 600~1 700 cm,主要是C=O拉伸)和酰胺II带(1 500~1 600 cm,C—N伸缩与N—H弯曲)都与蛋白质的二级结构有关,在酰胺I带,接枝DEX的共聚物在1 630~1 650 cm出现条带变化并且共聚物的峰值蓝移到较高波数,这是美拉德反应产生的特征峰,表明OVA、DEX和GA通过C—N、C=O共价相互作用,一般来说,在评估二级结构蛋白变化时,酰胺I带比酰胺II带更敏感,因此对酰胺I带采用傅里叶自反褶积和高斯函数计算其二级结构组成。如图4所示,与OVA相比,共聚物的二级结构发生了不同的变化,共聚物的-螺旋减少、无规卷曲增加,这与Yan Yong等研究结果一致。1 220~1 010 cm处的吸收带与C—N的反对称拉伸有关,在1 220~1 010 cm处,共价结合DEX的共聚物出现了明显的峰,表明OVA与DEX反应时,产生了更多的C—N键,这与Liu Xiangju等的结果一致,另外,美拉德反应消耗了一部分羰基和氨基,生成了Amadori化合物(C=O)、Schiff碱(C=N)和吡嗪(C—N),都会使共聚物的峰强度和位置发生变化。
2.3 内源荧光光谱分析

图5 OVA及共聚物的内源荧光光谱Fig. 5 Intrinsic fluorescence spectra of OVA and conjugates
色氨酸残基是蛋白质的内源荧光探针,可用于表征蛋白质分子中色氨酸残基内部疏水性环境的变化以及蛋白质构象变化,OVA蛋白分子中含有3 个色氨酸残基(分别为Trp、Trp和Trp)。如图5所示,各物质的荧光强度由高到低依次为OVA>OVA-DEX>OVAGA>OVA-GA-DEX,3 种共聚物的荧光强度明显比OVA低,其中OVA-GA-DEX和OVA-GA的荧光强度接近,但比OVA-DEX下降更显著,这表明相比于DEX,GA对OVA蛋白的荧光强度显示出更强的猝灭效果。原因在于蛋白质与GA共价反应是在碱性条件下进行的,此时GA会首先被氧化成相应的醌类物质,然后直接与蛋白质上的游离氨基、色氨酸残基、赖氨酸残基以及半胱氨酸残基发生共价结合,特别是与色氨酸残基发生共价结合,会导致蛋白质的荧光强度降低,另外,蛋白的荧光淬灭还可能是多酚吸收了一部分荧光信号,使多酚的单独作用较DEX使蛋白本身荧光强度更低。
2.4 共聚物表面疏水性分析
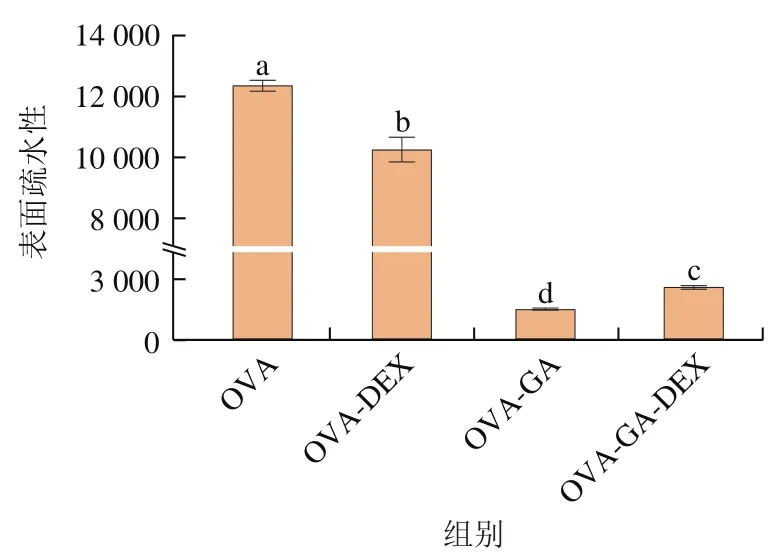
图6 OVA及共聚物的表面疏水性Fig. 6 Surface hydrophobicity of OVA and conjugates
蛋白质的外源性荧光强度以及蛋白质表面疏水性也是直接表征蛋白构象是否发生变化的一个重要表征手段。OVA中的385 个氨基酸残基,约一半以上为疏水性氨基酸残基,隐藏在OVA结构内部,当疏水基团暴露在极性环境中或蛋白的结构展开时,表面疏水性会发生变化。如图6所示,OVA-GA、OVA-DEX、OVA-GADEX的表面疏水性比OVA显著低,这表明OVA在与DEX或GA共价结合后的共聚物更加亲水,降低了蛋白质的疏水性,并且DEX和GA的遮蔽作用妨碍了ANS探针更难与蛋白质分子表面疏水区域结合。加热会使OVA结构展开,内部的疏水结构暴露,因此DEX与OVA-GA共价物结合后,OVA-GA-DEX的表面疏水性比OVA-GA高(<0.05),这与Cui Yanchun等的研究结果一致,并且GA与OVA共价结合后产生了一定的空间位阻,使亲水的DEX更难与OVA-GA结合,导致OVA-GA-DEX共价物的表面疏水性较OVA-GA显著提高。
2.5 共聚物的EAI和ESI分析

图7 OVA及共聚物的EAI和ESIFig. 7 EAI and ESI of OVA and conjugates
蛋白质的EAI是指蛋白质形成乳液的能力,而蛋白质的ESI则与蛋白在乳化过程中稳定液滴的能力有关,两者结合可以分析共聚物是否能形成稳定的Pickering乳液。如图7所示,OVA-DEX的EAI比OVA显著提高(<0.05),而OVA-GA-DEX的EAI比OVA-GA也显著提高(<0.05),说明在相同分子基础上,通过结合DEX可有效提高共聚物的EAI,而OVA-GA的EAI比OVA显著降低(<0.05),且OVA-GA-DEX的EAI比OVA-DEX也显著降低(<0.05),说明GA的共价结合降低了共聚物的EAI;OVA-GA的ESI最大,为(46.9±0.59)min,而OVA-GA-DEX与OVA相比有较为明显地提高(<0.05),另外OVA-GA的ESI与OVA的相比显著提高(<0.05),说明GA对于OVA的ESI影响较大,而OVA-DEX的ESI与OVA的相比无显著差异(>0.05),说明DEX对于OVA的ESI影响不大,另外OVA-GA-DEX与OVA-DEX的ESI差异性也不大(>0.05),说明先共价GA的OVA分子再历经DEX的糖基化,ESI没有明显的变化。一般来说,蛋白质是两亲性分子,在水包油乳状液中,蛋白质的疏水基团向油相移动,而极性部分向水相移动。蛋白质作为乳化剂吸附在油滴表面形成界面膜,降低乳化过程中油水界面的界面张力,防止油滴絮凝聚结,保持乳液的稳定性。在OVA-DEX、OVA-GADEX的EAI与OVA、OVA-GA相比均有提高,可见DEX的加入使蛋白质在油-水界面上强烈吸附,提高了蛋白的EAI,同时,DEX提供的空间斥力阻止了油滴的聚集,这与先前的研究报道:在水包油乳液中,多糖有助于蛋白质在油水界面吸附并且使乳液更加稳定结果一致。另外,由于多酚是亲水性分子,形成的OVA-GA共聚物具有更高的亲水性,因此难以吸附在油滴表面,导致EAI降低,但GA提供的空间斥力可防止油滴的聚集,提高了ESI。因此,从EAI和ESI看,OVA-GA、OVA-DEX、OVA-GADEX都具有形成较为稳定Pickering乳液的能力。
2.6 平均粒径及粒径分布分析


图8 乳液的粒径分布Fig. 8 Particle size distribution of emulsions

表1 乳液的平均粒径Table 1 The average particle size of emulsions nm
平均粒径代表了Pickering乳液整体的颗粒度大小,粒径分布范围越集中表示乳液均匀度越高。如表1所示,初始制得的Pickering乳液的平均粒径在36~40 nm,差异不大(>0.05),另外,乳液的粒径分布在30~50 nm之间(图8A),表明由OVA、OVA-GA、OVA-DEX、OVA-GA-DEX制成的Pickering乳剂颗粒度分散均匀。4 ℃贮存28 d后,Pickering乳液的平均粒径和粒径分布有不同程度的改变,OVA稳定的Pickering乳液的平均粒径增大到(57.5±6.31)nm,OVA-GA、OVA-DEX、OVA-GA-DEX制得的Pickering乳液平均粒径分别增大到(89.17±14.09)、(103.63±8.71)nm和(106.1±11.83)nm,显著高于由OVA制得的乳液平均粒径(<0.05);从粒径分布看,乳液的颗粒大部分粒径分布小于50 nm,相比OVA制得的Pickering乳液,共聚物乳液在低温条件下乳液颗粒更容易聚集,这可能是在贮存期间,吸附在油滴表面的蛋白由于与其他吸附蛋白的静电排斥和未吸附蛋白的疏水相互作用,会从界面上剥离下来导致,另外,由于蛋白质-多酚共价物中多酚的氧化和交联可能导致颗粒尺寸增大,形成稳定的聚集体,这些聚集体能够通过疏水相互作用或胶束状结构使亲脂性水不溶性药物溶解形成稳定的网络结构。结合表面疏水性和EAI看,DEX或GA的作用使OVA疏水性降低,使得共聚物对油的包裹性较弱,导致油滴的聚集。在25 ℃贮存28 d后,OVA制得的Pickering乳液平均粒径较小(126.7±12.83)nm,OVA-GA制得的Pickering乳液具有较大的平均粒径(157.83±13.39)nm,而OVA-DEX(138.57±11.08)nm,OVA-GA-DEX(141.37±10.04)nm的Pickering乳液的平均粒径与OVA,OVA-GA差异不大(>0.05),从粒径分布看(图8C),粒径大小主要分布在200 nm以内,在200~600 nm只有少量分布,不足以改变乳液的平均粒径。值得注意的是,OVA制得的Pickering乳液粒径在600~800 nm有少量分布,这说明由OVA制得的Pickering乳液中的颗粒向更大粒径凝聚。在50 ℃贮存28 d后,与4 ℃和25 ℃贮存比,平均粒径发生了相反的变化,OVA制得的乳液比OVA-GA、OVADEX、OVA-GA-DEX制得的Pickering乳液显示出更大的平均粒径,从粒径分布来看(图8D),共聚物制得的Pickering乳液的粒径主要分布在200 nm以内,以小于100 nm为主,OVA制得的乳液颗粒的粒径在400~800 nm有明显的分布,这表示在温度较高的情况下,蛋白受热发生凝聚导致乳液颗粒逐渐变大,而在共价物制得的Pickering乳液中,由于多糖或多酚的作用,以及未接枝到蛋白上的游离多糖继续在湿热环境中与蛋白发生美拉德反应,增大了乳液中颗粒的斥力,进而形成一个稳定的结构,阻止了颗粒过大的凝聚,结果表明,OVA及其共聚物制得的Pickering乳液颗粒分布均匀,经过不同条件下28 d贮存后,OVA制得的Pickering乳液更适合在低温条件下贮存,在常温和高温条件下粒径向更大的趋势凝聚,共聚物尤其是OVA-GA-DEX更能使Pickering乳液在高温下保持稳定。
2.7 共聚物对白藜芦醇乳液贮存稳定性和抗氧化性的影响


图9 贮存过程中白藜芦醇含量变化Fig. 9 The contents of RES in emulsions during storage

图10 Pickering乳液的抗氧化能力Fig. 10 Antioxidant capacity of Pickering emulsion
如图9A所示,0d,OVA、OVA-DEX、OVAGA以及OVA-GA-DEX对白藜芦醇的包埋率分别为(77.34±0.88)%、(80.13±0.67)%、(90.31±0.77)%以及(89.09±0.30)%,其中,OVA-GA和OVA-GA-DEX显示出较高的包埋率(<0.05),说明GA的共价结合有利于OVA能更好地包埋白藜芦醇。通过每周取样检测乳液中白藜芦醇含量的方式,可以看出在不同贮存条件(4、25、50 ℃、光照4 ℃)下,共聚物对白藜芦醇的保护能力。白藜芦醇对光、热敏感,尤其是在光照条件下极易发生降解,如图9D所示,白藜芦醇含量在光照贮存下最低,对于不同共聚物的Pickering乳液,白藜芦醇含量为OVAGA>OVA-GA-DEX>OVA-DEX>OVA,其中OVA-GA或OVA-GA-DEX制得的Pickering乳液白藜芦醇含量更高,这与GA本身具有较强的抗氧化作用有关,而DEX可提高乳液的稳定性。因此,OVA-GA、OVA-DEX、OVA-GA-DEX提供了一个稳定的环境并且GA提供了一定的抗氧化能力,阻止了白藜芦醇氧化降解。结合乳液粒径分布看,与OVA制得的Pickering乳液相比,共聚物稳定的Pickering乳液粒径分布更加集中,这显示出Pickering乳液乳体系更加稳定,形成的致密的网状结构减少了包裹白藜芦醇油溶液的析出,进而防止了白藜芦醇的氧化降解,使白藜芦醇的保留率更高。如图10所示,对于刚制备的Pickering乳液,OVA-GA((82.32±0.17)%、(80.7±3.89)%),OVA-DEXGA((83.34±0.38)%、(85.69±6.30)%)制得的Pickering乳液具有更高的ABTS阳离子自由基和DPPH自由基清除率。这和GA本身具有抗氧化活性有关。研究表明,具有抗氧化活性的酚类物质与蛋白共价作用可明显提高蛋白的抗氧化活性。OVA-DEX制得乳液的ABTS阳离子自由基清除能力((61.21±0.10)%)明显高于OVA((53.68±1.24)%)制得的Pickering乳液(<0.05),另外,OVA-DEX共聚物乳液中白藜芦醇的含量较高,使乳液的抗氧化能力较强。经28 d贮存后,乳液的抗氧化活性发生了不同的变化,如图10所示,对于不同贮存条件,抗氧化活性表现较为一致,结果为4 ℃>25 ℃>50 ℃>光照4 ℃,这和白藜芦醇的含量变化具有一致性。在贮存28 d后,对比同一物质制得的Pickering乳液,光照4 ℃条件下白藜芦醇的含量最低,4 ℃贮存下白藜芦醇的含量最高,另外,高温会促使蛋白-多糖的美拉德湿热反应,形成更多糖基化产物,并且随着共聚物的量增多,Pickering乳液稳定性进一步增强,因此可以看出,共聚物尤其是OVA-GA-DEX更能在长时间的热环境中保持稳定。
3 结 论
GA或DEX与OVA可共价结合形成3 种聚合物(OVAGA、OVA-DEX、OVA-GA-DEX),改变了OVA蛋白的二级结构组成,其中OVA-GA-DEX有更好的亲水性并提高乳液的ESI。3 种共聚物尤其是OVA-GA-DEX制得的Pickering乳液具有更好的稳定性,其乳液颗粒粒径分布更加均匀且平均粒径更小(尤其在50 ℃贮存28 d后的平均粒径为(85.07±10.74)nm),乳液的抗氧化性能测定显示OVA-GA-DEX更高(如光照贮存后DPPH自由基清除率为(31.32±0.71)%,ABTS阳离子自由基清除率为(22.87±0.58)%),因此,OVA-GA-DEX共聚物可较好地稳定白藜芦醇,并改善其抗氧化性能。
