盐胁迫对两个高羊茅品种幼苗生长及生理特性的影响
2022-08-31朱天奇鲁泽宇胡桑源李光裕李尤月游翔凯高双红刘铁芫许岳飞
朱天奇, 鲁泽宇,胡桑源, 李光裕, 李尤月, 游翔凯, 高双红, 刘铁芫, 许岳飞
(西北农林科技大学草业与草原学院, 陕西 杨凌 712100)
近年来,随着城市绿地规模的扩增和运动场地的建立,草坪的使用越来越广泛,草坪已经成为现代生活不可缺少的组成部分。草坪草作为优良的地被植物,可以美化环境、净化空气、降低噪音、调节小气候,为人类提供舒适安全的运动环境,并且具有独特的美学价值,因此市场对草坪的需求量日益增加[1-2]。
高羊茅(FestucaarundinaceaSchreb.)是羊茅属(Festuca)植物,其根系发达,植株强健,抗逆性和抗病性强,具有较强的耐盐碱能力,适应范围广,是应用最广泛的冷季型草坪草之一[3]。
我国北方地区气候干燥,多次灌溉会造成土壤次生盐渍化,进而使草坪草遭受一定程度的盐胁迫,从而影响草坪绿地的质量和使用寿命[4]。盐胁迫影响植物的生长发育,如抑制种子萌发[5]、根系长度、株高和结实率[6]等,同时,盐胁迫降低植物对土壤水分的利用率,影响植物光合作用,并引起渗透胁迫、离子毒害[7]等原初效应,破坏植物体内正常的生理生化[8]过程,进而引起氧化胁迫、营养亏缺等次生胁迫。同一物种的不同品种对逆境的响应有所差异,有研究表明不同高羊茅品种对盐胁迫的耐受程度不同[9],因此,本研究以两个不同盐敏感度的高羊茅品种为对象,研究盐胁迫下其幼苗形态及生理变化,以期为提高高羊茅的耐盐性提供一定的理论依据,同时为我国北方地区高羊茅的栽培和管理提供一定的理论指导与技术支持。
1 材料与方法
1.1 试验设计
本试验供试高羊茅(FestucaarundinaceaSchreb.)品种为‘钛极-2LS’(Festucaarundinacea‘Titanium 2LS’)和‘易凯’(Festucaarundinacea‘Easycare’),种子于2020年购买于克劳沃(北京)生态科技有限公司,于4℃冰箱储存。将两个高羊茅品种(‘钛极-2LS’和‘易凯’)的种子用10%NaClO溶液浸泡,180 r·min-1摇10 min,倒掉上清液,用蒸馏水冲洗3次,播种至已消毒的装有石英砂的花盆(直径9 cm×高15 cm)中,每盆播种40粒种子左右,每个品种12盆,对照组和处理组各6盆,放置于培养架(光周期:光通量密度10 000 lx,湿度60%,光期16 h,25℃;暗周期:光通量密度0 lx,湿度50%,暗期8 h,20℃)进行培养。每24 h浇一次水,两周后,选择长势均一的高羊茅幼苗,将每盆间苗至10株,并开始浇Hoagland营养液,每周两次,每次每盆30 mL。3周后,使用NaCl溶液进行处理,为了避免瞬时冲击对高羊茅幼苗的影响[10],设定初始浓度为50 mmol·L-1,每24 h增加一次盐浓度(50 mmol·L-1),最终浓度为500 mmol·L-1,继续处理14 d,然后取样进行相关指标的测定。
1.2 测定方法

1.3 数据分析
使用GraphPad Prism 8软件统计数据并进行双因素方差分析(Two-Way ANOVA),结果以平均值±标准差(M±SD)表示,使用Duncan’s法进行多重比较(P<0.05表示差异显著,P<0.01表示差异极显著),统计图使用软件GraphPad Prism 8绘制。
2 结果与分析
2.1 盐胁迫对两个高羊茅品种幼苗生长的影响
株高、叶宽、分蘖数和根系长度能够直观表示植物生长状况(图1),与对照组相比,盐处理下‘钛极-2LS’和‘易凯’的株高、叶宽和分蘖数均减少且差异达到极显著水平(P<0.01),其根系长度也显著下降,且CK和盐处理条件下‘钛极-2LS’的分蘖数均显著高于‘易凯’(P<0.01)。盐胁迫下,两个高羊茅品种的地上部鲜重和地下部鲜重均显著减少(P<0.01),其中‘钛极-2LS’和‘易凯’的地上部鲜重分别减少了78.52%和64.39%;地下部鲜重分别减少了74.17%和82.69%;地上部干重分别减少了46.20%和67.64%;地下部干重分别减少了32.59%和80.00%,可以看出在盐胁迫下‘钛极-2LS’的地上部鲜重减少幅度高于‘易凯’,而地下部鲜重以及地上部和地下部的干重减少幅度均低于‘易凯’,且‘易凯’的地上部干重和地下部干重在盐胁迫下均显著减少而‘钛极-2LS’减少不显著,这些结果表明在高盐胁迫下‘钛极-2LS’受到的损伤比‘易凯’小。
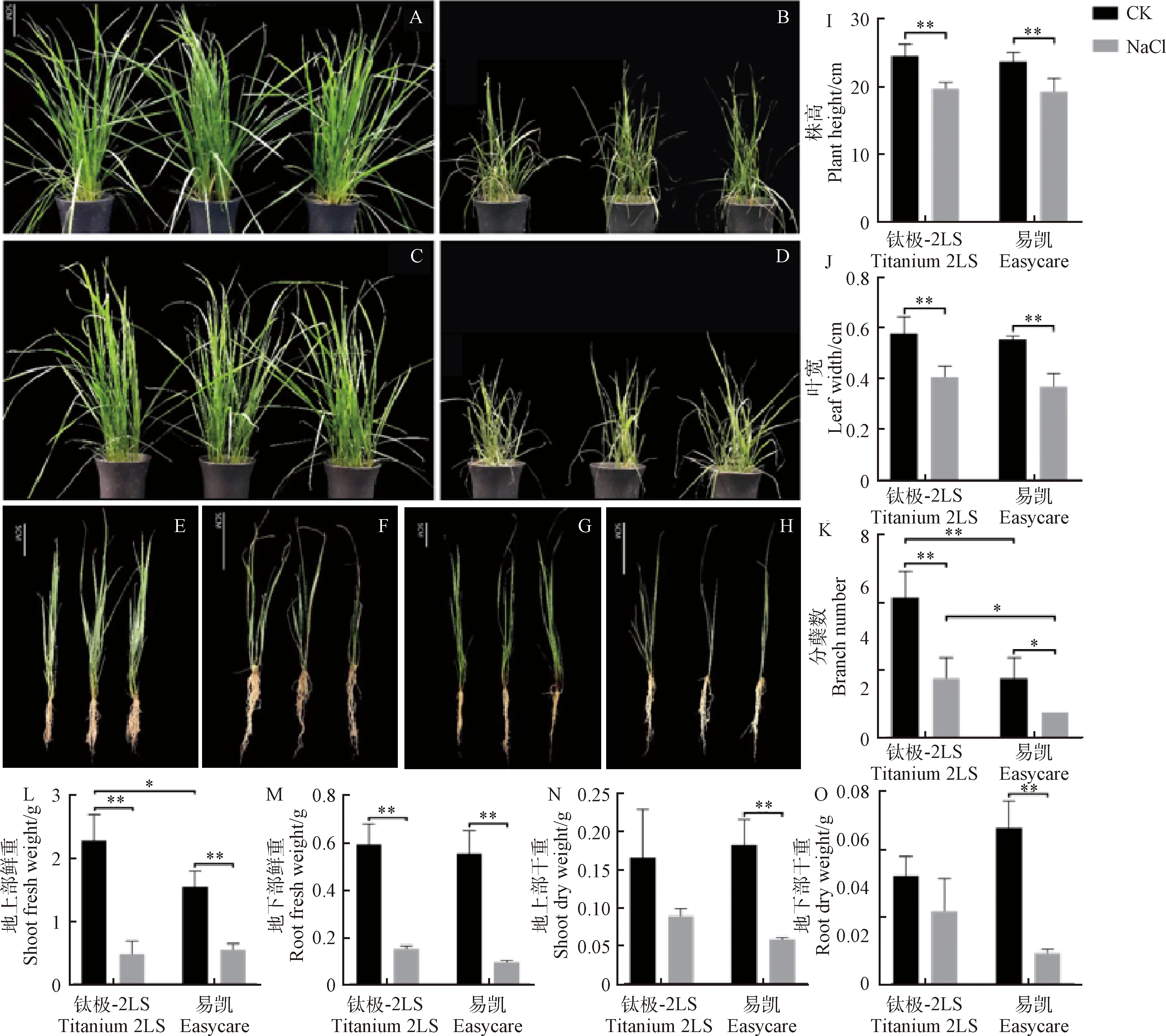
图1 盐胁迫对两个高羊茅品种幼苗生长的影响Fig.1 Effects of NaCl on seedling growth of two tall fescue seedlings注:(A)对照下‘钛极-2LS’的地上部分形态;(B)盐处理下‘钛极-2LS’的地上部分形态;(C)对照下‘易凯’的地上部分形态;(D)盐处理下‘易凯’的地上部分形态;(E)对照下‘钛极-2LS’的整株形态;(F)盐处理下‘钛极-2LS’的整株形态;(G)对照下‘易凯’的整株形态;(H)盐处理下‘易凯’的整株形态;(I)株高;(J)叶宽;(K)分蘖数;(L)地上部鲜重;(M)地下部鲜重;(N)地上部干重;(O)地下部干重。*表示P<0.05;**表示P<0.01。下同Note:(A)Morphology of aboveground part of ‘Titanium-2LS’ under control conditions;(B)Morphology of aboveground part of ‘Titanium-2LS’ under NaCl conditions;(C)Morphology of aboveground part of ‘Easycare’ under control conditions;(D)Morphology of aboveground part of ‘Easycare’ under NaCl conditions;(E)Morphology of the whole plant of ‘Titanium-2LS’ under control conditions;(F)Morphology of the whole plant of ‘Titanium-2LS’ under NaCl conditions;(G)Morphology of the whole plant of ‘Easycare’ under control conditions;(H)Morphology of the whole plant of ‘Easycare’ under NaCl conditions;(I)Plant height;(J)Leaf width;(K)Branch number;(L)Shoot fresh weight;(M)Root fresh weight;(N)Shoot dry weight;(O)Root dry weight. * means P<0.05;** means P<0.01. The same as below
2.2 盐胁迫对两个高羊茅品种幼苗离子含量的影响
与对照组相比,盐胁迫处理组两个品种幼苗的地上部和地下部Na+含量均增加,K+含量均减少,且差异显著(P<0.01)。值得注意的是,盐胁迫下‘易凯’的地下部Na+高于‘钛极-2LS’且差异显著(P<0.01),虽然地上部Na+含量也呈现出相同趋势,但差异不显著。盐胁迫处理下,‘钛极-2LS’和‘易凯’的地上部Na+含量分别增加7.93倍和12.62倍;地下部Na+含量分别增加1.12倍3.08倍,地上部K+含量分别减少31.32%和21.70%;地下部K+含量分别减少72.66%和62.47%;地上部K+/Na+分别减少了92.30%和95.08%;地下部K+/Na+分别减少了87.48%和92.08%,可以看出盐胁迫下‘钛极-2LS’地上和地下部分K+含量和K+/Na+减少幅度均高于‘易凯’,而地上和地下部分Na+含量增加幅度低于‘易凯’,且‘易凯’波动幅度更大(图2)。

图2 盐胁迫对两个高羊茅品种幼苗离子含量的影响Fig.2 Effects of NaCl on ion content of two tall fescue seedlings注:(A)地上部K+含量;(B)地上部Na+含量;(C)地上部K+/Na+比值;(D)地下部K+含量;(E)地下部Na+含量;(F)地下部K+/Na+比值Note:(A)K+ content of shoot;(B)Na+ content of shoot;(C)K+/Na+ ratio for shoot;(D)K+ content of root;(E)Na+ content of root;(F)K+/Na+ ratio for root
2.3 盐胁迫对两个高羊茅品种幼苗脯氨酸及可溶性糖含量的影响
与对照组相比,盐胁迫下,两个品种的脯氨酸含量均显著增加(P<0.01),‘钛极-2LS’和‘易凯’的脯氨酸含量分别增加9.74倍和6.30倍,‘钛极-2LS’的脯氨酸增加量大于‘易凯’,且盐胁迫组‘钛极-2LS’的脯氨酸含量显著高于‘易凯’(P<0.01)(图3)。与对照相比,盐胁迫下,两个高羊茅品种幼苗的可溶性糖含量均显著增加(P<0.01),‘钛极-2LS’和‘易凯’的可溶性糖含量分别增加3.54倍和2.92倍,‘钛极-2LS’的可溶性糖增加量高于‘易凯’,且盐胁迫组中‘钛极-2LS’的可溶性糖含量高于‘易凯’(图3)。

图3 盐胁迫对两个高羊茅品种幼苗脯氨酸(A)和可溶性糖含量(B)的影响Fig.3 Effects of NaCl on proline content (A) and soluable sugar content (B) of two tall fescue seedlings
2.4 盐胁迫对两个高羊茅品种幼苗光合特性的影响
与对照相比,盐胁迫下两个高羊茅品种幼苗的PSⅡ最大光化学效率均显著下降(P<0.01),其中‘钛极-2LS’的PSⅡ最大光化学效率下降了47.10%,‘易凯’下降了48.50%;盐处理后两个品种的PSⅡ实际光化学效率的变化趋势与其PSⅡ最大光化学效率相似,‘钛极-2LS’的PSⅡ实际光化学效率显著地下降了51.33%(P<0.05),‘易凯’下降了63.79%(P<0.05);在盐胁迫下,‘钛极-2LS’和‘易凯’的光化学猝灭系数均有显著下降(P<0.05),‘钛极-2LS’下降了43.68%,‘易凯’下降了47.21%。盐胁迫后的‘钛极-2LS’和‘易凯’的光化学猝灭系数没有显著差异,两个品种的对照组之间也无显著差异;盐处理下的‘钛极-2LS’和‘易凯’的光合电子传递速率与相应的对照组相比都显著下降(P<0.05),‘钛极-2LS’的光合电子传递速率下降了62.76%,‘易凯’下降了63.80%,盐处理组的‘钛极-2LS’和‘易凯’的光合电子传递速率无显著差异,对照组‘钛极-2LS’和‘易凯’的光合电子传递速率也无显著差异,此外,两个高羊茅品种幼苗的净光合速率、蒸腾速率、气孔导度和胞间二氧化碳浓度均显著下降(P<0.01)(图4)。

图4 盐胁迫对两个高羊茅品种幼苗光合特性的影响Fig.4 Effects of NaCl on the Photosynthetic characteristics of two tall fescue seedlings注:(A)净光合速率;(B)蒸腾速率;(C)气孔导度;(D)胞间CO2浓度;(E)PSⅡ最大光化学效率;(F)PSⅡ实际光化学效率;(G)光化学猝灭系数;(H)光合电子传递速率Note:(A)Net photosynthetic rate;(B)Transpiration rate;(C)Stomatal conductance;(D)Intercellular CO2 concentration;(E)Maximal efficiency of PSⅡ photochemistry;(F)Actual quantum yield of PSⅡ;(G)Photochemical quenching coefficient;(H)Electron transport rate
2.5 盐胁迫对两个高羊茅品种幼苗抗氧化酶系统的影响
盐胁迫下,两个高羊茅品种幼苗‘钛极-2LS’和‘易凯’的SOD活性较CK均显著下降(P<0.05)。‘钛极-2LS’的SOD活性下降了25.99%,而‘易凯’的SOD活性下降了49.89%,盐胁迫组和对照组的‘钛极-2LS’的SOD活性都显著高于‘易凯’的SOD活性(P<0.05);盐胁迫下,‘钛极-2LS’的POD活性较CK上升了34.05%(P<0.01),而‘易凯’POD活性较CK变化不显著,CK处理下两个品种的POD活性有显著差异(P<0.05),但盐胁迫处理下两个品种的POD活性并无显著差异。两个高羊茅品种的对照组和盐胁迫组之间的CAT活性没有显著变化,两个高羊茅品种的CAT活性之间无显著差异(图5)。
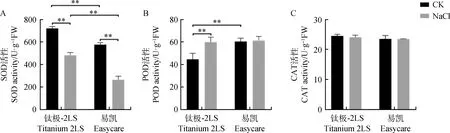
图5 盐胁迫对两个高羊茅品种幼苗SOD活性(A)、POD活性(B)和CAT活性(C)的影响Fig.5 Effects of NaCl on the SOD activity (A),POD activity (B),and CAT activity (C) of two tall fescue seedlings
3 讨论
3.1 盐胁迫对两个高羊茅品种幼苗生长的影响
植物在逆境胁迫下,外部形态会发生一系列变化来适应不良外界环境对自身造成的伤害。株高、叶宽、分蘖数、生物量都是能够直观反映植物生长的重要指标。有研究表明,盐胁迫会导致植物的株高降低、叶片变细、分蘖减少[18-19]。本研究中,两个高羊茅品种幼苗的株高、叶宽、分蘖数在盐处理后均显著下降(P<0.01),与前人的研究结果一致。而且两个高羊茅品种地下部生物量的减少均高于地上部,表明盐胁迫对于两个品种地下部的影响更大,可能是因为盐胁迫限制了地上部分的生长,减少了光合产物如糖类的合成,因此运输到地下部的能量物质减少[20],所以本研究中的两个高羊茅品种地下部分生长受抑制程度大于地上部分。
3.2 盐胁迫对两个高羊茅品种幼苗离子含量变化的影响
盐胁迫会破坏植物离子平衡,植物体内会积累大量Na+,高水平的Na+会影响K+的吸收,导致K+的减少,从而影响K+/Na+,限制光合活性[21]。离子毒害会破坏植物的营养结构,影响植物正常的生理代谢活动,K+/Na+被视为衡量植物体内离子平衡的指标。K+作为植物体内一种重要的营养元素,可以调控植物体的离子平衡,提高促进渗透调节的效率[3]。在我们的研究中,盐处理后两个高羊茅品种的地上部和地下部Na+含量均增加,K+含量均减少,K+/Na+降低,这与在狗牙根(CynodonRich.)中的研究结果一致[21]。值得注意的是,盐胁迫下‘钛极-2LS’根中的Na+含量少于‘易凯’,K+含量多于‘易凯’,从而维持相对较高的K+/Na+平衡,因此重度盐胁迫对‘钛极-2LS’的离子毒害相对较小,说明‘钛极-2LS’具有较强的耐盐性。
3.3 盐胁迫对两个高羊茅品种幼苗脯氨酸和可溶性糖含量变化的影响
脯氨酸具有极强的亲水性,可以稳定细胞内的原生质胶体及组织内的代谢过程,防止细胞脱水[3]。可溶性糖可以维持较高的渗透压,降低水势,稳定细胞内的细胞膜和原生质胶体,盐胁迫下植物会通过积累可溶性糖以抵御不良外界环境[22]。因此植物体内脯氨酸和可溶性糖含量的高低可以在一定程度上反映植物耐盐性的强弱。本研究中,两个高羊茅品种幼苗在盐处理后均积累大量的脯氨酸和可溶性糖,这与在黄花苜蓿(Medicagofalcata)上[23]的研究结果一致,但处理组‘钛极-2LS’较‘易凯’积累更多的脯氨酸和可溶性糖,这说明相比‘易凯’,‘钛极-2LS’在高盐胁迫下可以积累更多的渗透调节物质来抵抗盐胁迫对自身带来的伤害,进而维持自身的生命活动。
3.4 盐胁迫对两个高羊茅品种幼苗光合特性的影响
盐胁迫导致Na+大量积累,气孔调节会被扰乱,植物的光合作用会受到很大的影响,植株生长也会受到抑制[24-26]。气孔导度表示气孔张开的程度,在一定程度上也影响着植物的光合作用和蒸腾作用。本研究中,盐胁迫下两个高羊茅品种光合参数均受到影响,这与在甘草(GlycyrrhizauralensisFisch.)中的研究一致[27]。在遭受逆境胁迫时,植物对光能的利用率会下降,光系统之间的电子传递也会受到抑制。盐胁迫在一定程度上会抑制PSⅡ的功能,导致PSⅡ实际光化学效率下降[28]。本研究中,盐胁迫下两个高羊茅品种幼苗的PSⅡ均受到抑制,这表明盐胁迫会很大程度上损伤PSⅡ的功能,使高羊茅光合作用受到影响,从而影响高羊茅的正常生长。
3.5 盐胁迫对两个高羊茅品种幼苗抗氧化酶系统的影响
植物耐盐性的强弱与自身抗氧化酶活性和渗透调节能力强弱密切相关[7]。盐胁迫初期,植物启动自身响应胁迫的机制,SOD,POD及CAT等抗氧化酶的活性会暂时升高以适应胁迫的影响[29]。但如果植物长时间遭受盐胁迫,其活性氧代谢平衡遭到破坏,进一步导致抗氧化酶系统遭到破坏,抗氧化酶活性下降[30]。本研究中两个高羊茅品种在盐胁迫后除‘钛极-2LS’的POD活性增强外,测定的其他抗氧化酶活性均受到抑制,这与在棉花(Gossypiumspp.)中的研究结果一致[30],‘钛极-2LS’耐盐性较强可能是因为其POD能够长时间保持相对较高的活性,从而继续参与ROS代谢,维持幼苗生长。前人研究发现[31-32],在受到胁迫后,植物中的CAT活性通常是先上升后下降。在我们的研究中,盐胁迫下两个高羊茅品种的CAT活性与对照组相比略有下降,这与前人的研究结果基本一致。
4 结论
盐胁迫下两个高羊茅品种幼苗的生长和生理特性均会受到一定的影响,但是‘钛极-2LS’受到的影响比‘易凯’小,因此‘钛极-2LS’的耐盐性比‘易凯’更强。此外,本研究中两个高羊茅品种幼苗在离子含量、脯氨酸含量以及可溶性糖等方面变化的差异较明显,所以我们认为离子含量、脯氨酸含量和可溶性糖含量可以作为评定高羊茅耐盐性的指标。
