花棒种子萌发对NaCl及聚乙二醇胁迫的响应
2022-08-31王晓佳李运毛冯学瑞刘佳欣
邹 瑾, 王晓佳, 曹 兵*, 李运毛, 冯学瑞, 刘佳欣
(1. 宁夏大学农学院, 宁夏 银川 750021; 2. 宁夏银川市中山公园, 宁夏 银川 750001)
我国西北地区为大陆性气候区,降水稀少,植被分布稀疏,土壤蒸发量较大,盐分在地表聚集,导致盐渍化问题显著[1],荒漠化问题长期存在,生态环境修复问题受到广泛关注。许多学者对西北地区的荒漠化治理、植被恢复以及对盐渍化土地的开发利用等问题进行了研究,认为改善本地区生态环境最有效、最经济的生物措施是栽种耐盐、耐旱植物[2-4]。花棒(HedysarumscopariumFisch. et Mey.)为豆科岩黄耆属半灌木,其生长迅速,根系发达,树形独特,具有抗旱、耐风蚀、适应性强的特点,是优良的固沙灌木树种[5]。花棒不仅可以营造独特的沙漠景观,其根际和非根际中的根瘤菌与其本身共生形成根瘤,实现共生固氮,对当地生态平衡的维持、土壤改良等有着重要贡献。此外,其枝干中富含油脂,可以作为生物燃料的补充,嫩枝叶可成为牛羊饲料,种子可以榨油[6],花期较长,花色艳丽,不仅可以用来作为潜在能源植物[7],也是优质的蜜源植物[8]。由此可见,花棒的生态和经济价值都十分显著[9]。生产中主要通过植苗和直播造林方式应用,花棒种植方式简单、成本较低,被广泛用于沙区生态环境的修复治理。
对于干旱荒漠区植物种子而言,盐分和湿度是测定其抗逆性的重要影响因素[10-12],研究植物抗逆性的关键时期是种子萌发时期。在植物所遭受的各种非生物灾害中,干旱对其生长造成的危害最为严重[13];盐适应性是盐生环境下植物生存的首要条件,亦是干旱区植物长期进化过程中需适应的重要因子[14]。采用NaCl和PEG-6000处理种子,分别模拟盐、旱胁迫环境,探究植物种子萌发期的抗逆性[15],这种试验方法已在柠条[16-17]、刺铃铛[18]、沙蒿[19]等植物的抗盐旱研究中成功应用,但不同植物其种子萌发期、苗期、幼年期等不同生长发育阶段对土壤水分和盐分有不同的适应性[20]。花棒根系发达、叶片小,抗旱性强,是干旱沙区植被恢复与重建的优选树种之一。目前对花棒的研究主要集中在沙埋深度影响[21]、环境因子影响[22]及其生理生态[5]等方面,未见有关其种子萌发期抗旱、耐盐的研究报道。本试验采用不同浓度的NaCl溶液和PEG-6000溶液,分别模拟不同程度盐胁迫和干旱胁迫环境,测定花棒种子萌发指标,分析花棒种子萌发期对盐、旱胁迫的反应,以期为花棒的人工培育及直播造林提供参考依据。
1 材料与方法
1.1 试验材料
花棒种子于2021年在宁夏上谷农牧种子公司购买。试验所用盐(NaCl)、聚乙二醇6000(PEG-6000)分析纯试剂,均为天津市大茂化学试剂厂生产。
1.2 试验方法
1.2.1种子预处理 试验前挑选种粒饱满、大小相同、无病虫害的花棒种子,去除果荚[22],用0.3%的高锰酸钾溶液浸泡消毒(10 min)后,用蒸馏水进行反复冲洗,滤纸吸干表面水分备用。
1.2.2试验设计 试验采用纸上发芽法,配置不同浓度的NaCl溶液和PEG-6000溶液,分别模拟不同程度盐胁迫和干旱胁迫环境下花棒种子的萌发状况。按照Michel[23]、陈东凯[19]等的方法,结合预试验结果,本试验确定设置5个不同浓度(质量分数)NaCl溶液,分别为0.2%,0.4%,0.6%,0.8%,1.0%模拟盐胁迫[24-25];设置5个不同浓度(质量分数)PEG-6000溶液,分别为5%,10%,15%,20%,25%模拟干旱胁迫[26-27],PEG-6000浓度对应水势为-0.10,-0.20,-0.40,-0.60,-0.86 MPa[28]。试验共设置12组处理,其中蒸馏水对照(CK1,CK2)2组,NaCl溶液5组,PEG-6000溶液5组;每组处理3个重复,共计36个培养皿,每培养皿放置30粒种子,培养皿标记处理编号。先将培养皿(内径90 mm)用高压灭菌锅进行消毒30 min,取出放入双层大小与培养皿内径一致的干净无菌滤纸。用移液枪往对应编号的培养皿中分别加入不同浓度的NaCl溶液及无菌蒸馏水(CK1)、不同浓度的PEG溶液及无菌蒸馏水(CK2),至滤纸饱和并依次称重记录。将所有处理的培养皿放入人工气候箱中培养,温度为25℃、湿度60%、光照昼夜时间为12 h/12 h。每天定量加入各溶液,补充散失水分,同时称重并做好记录,每2 d更换滤纸,维持正常环境水势[29]。
1.3 指标测定及方法
本试验从种子置床之日起每隔24 h观察1次,种子露白即可认定为萌发;在3次重复中,有1粒以上的种子出现萌发,可认定是种子萌发开始期,每天在规定的时间内观察种子萌芽情况并做好记录[18],参照《国际种子检验规程》,以连续3 d无种子发芽作为发芽试验的结束。完成试验后,做好各指标计算工作,选择胚根完整的10株幼苗,用精度为0.02 mm的数显游标卡尺测量其胚根长并取平均值。正常萌发阈值的确定参照《GB7908-1999林木种子质量分级》[30],以花棒一级种子发芽率为标准,发芽率高于70%而低于对照组,则认定为该浓度对种子萌发有影响;发芽率低于70%,则被认定该浓度抑制了种子萌发,其他萌发指标参照发芽率抑制浓度,以对照组的50%为标准判定。
逐日萌发率(Daily germination rate,DGR)=t/N×100%,t为萌发期内每天正常发芽种子数量。
发芽率(Germination rate,GR)=n/N×100%,n代表正常发芽种子数量,N为种子总数。
发芽势(Germination potential,GP)=m/N×100%,m为总萌芽天数前1/3 d种子发芽数量。
发芽指数(Germination index,GI)=∑(Gt/Dt),Gt为在t天发芽种子数量,Dt为对应发芽天数。
活力指数(Vigor index,VI)=GI×Sx,Sx为种子胚根长度。
1.4 数据处理
使用Microsoft excel 2010对数据进行整理,用SPSS 26.0软件进行统计分析(多重比较选择Duncan方法,其中置信水平具体为95%),用Origin 2018软件来进行绘图。
2 结果与分析
2.1 盐胁迫对花棒种子萌发的影响
2.1.1盐胁迫对花棒种子逐日萌发率的影响 在不同NaCl浓度处理下,花棒种子起始萌发天数分别为第1,1,1,4,5,5 d(图1)。随NaCl浓度不断升高,花棒种子起始萌发时间延后,不同浓度NaCl对花棒萌发存在不同程度抑制作用:种子逐日萌发率峰值均明显低于CK1,当盐胁迫逐步增强时,种子逐日萌发率峰值出现时间明显滞后,种子停止萌发天数对应分别为第6,11,14,14,12,14 d。
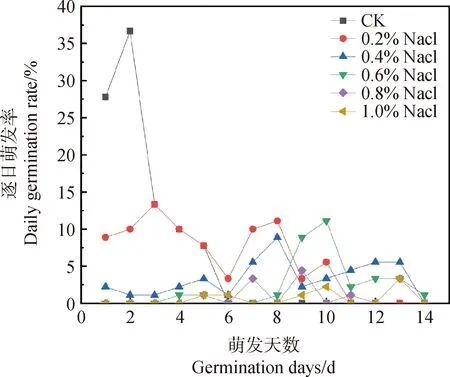
图1 不同浓度NaCl胁迫对花棒种子逐日萌发率的影响Fig.1 Effects of different concentrations of NaCl stress on daily germination rate of Hedysarum scoparium seeds
2.1.2盐胁迫对花棒种子发芽率及发芽势的影响 不同浓度NaCl溶液处理,花棒种子发芽率、发芽势差异性显著(图2)。随着NaCl浓度逐渐升高,花棒种子的发芽率整体呈下降趋势,且与对照组表现出显著差异(P<0.05)。当使用0.2%浓度的NaCl溶液处理种子时,花棒种子发芽率为83.3%,高于70%,为对照组的87.1%;当NaCl溶液浓度为0.4%时,种子发芽率为46.7%,为对照组的47.1%,出现明显抑制作用;当溶液浓度达到1.0%时,种子的发芽率低至8.9%,仅为对照组的9.3%。说明当NaCl浓度逐步升高时花棒种子的发芽率呈线性降低,当NaCl浓度为0.2%时,花棒种子发芽率受到一定影响,当NaCl溶液浓度达到0.4%时,花棒种子发芽率明显降低,该浓度明显抑制种子发芽。

图2 不同浓度NaCl胁迫对花棒种子发芽率与发芽势的影响Fig.2 Effects of different concentrations of NaCl stress on germination rate and germination potential of Hedysarum scoparium seeds注:不同小写字母表示同一溶液不同浓度处理下差异显著(P<0.05),下同Note:Differen lowercase letters indicate the significant difference under different concentrations of the same solution at the 0.05 level,the same as below
发芽势是指在种子萌发试验中,从开始发芽到最高峰时,已经发芽的种子数占测试种子总粒的比重[31]。当NaCl溶液浓度逐步升高时,花棒种子发芽势整体呈下降趋势。用0.2%浓度NaCl溶液处理花棒种子时,其发芽势为50%,为对照组的52.3%;当NaCl溶液浓度达到0.4%时,其发芽势为1.1%,仅为对照的10.4%,出现明显抑制作用;随着浓度增高,花棒种子发芽势急剧降低,与对照存在显著差异(P<0.05)。
2.1.3盐胁迫对花棒种子发芽指数及活力指数的影响 发芽指数是指测试种子发芽成活指数情况,用来表示该测试种子实际均值发芽率[32]。花棒种子在不同浓度NaCl溶液处理后,其发芽指数和活力指数总体皆呈下降趋势,且差异显著(图3)。当使用0.2%浓度的NaCl溶液处理花棒种子时,种子发芽指数为36.1,为对照组的54.8%;当NaCl浓度达到0.4%时,其发芽指数为10.9,为对照的16.5%,产生明显抑制作用(P<0.05);当NaCl浓度达到1.0%时,其发芽指数仅为1.3,为对照的2.0%。可见,随着处理浓度的升高,花棒种子发芽指数下降幅度明显增加,受抑制作用明显。
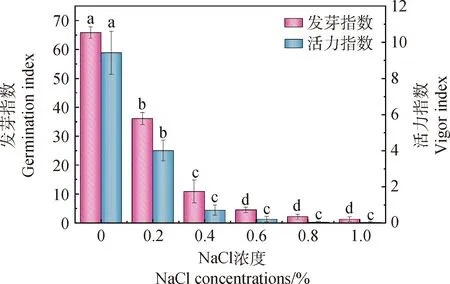
图3 不同浓度NaCl胁迫对花棒种子发芽指数与活力指数的影响Fig.3 Effects of different concentrations of NaCl stress on germination index and vigor index of Hedysarum scoparium seeds
活力指数用来表示种子迅速整齐萌发潜势和生长力情况[33]。在NaCl溶液的不同浓度处理下,花棒种子的活力指数整体呈下降趋势。当使用0.2%浓度的NaCl溶液处理花棒种子时,种子活力指数为4.0,为对照组的42.6%,开始产生抑制作用;当使用NaCl浓度达到0.4%时,其活力指数为0.7,仅为对照组的7.4%,产生明显抑制作用(P<0.05)。可见,相对于其他萌发指标,活力指数对NaCl胁迫响应较为敏感。
2.2 干旱胁迫对花棒种子萌发的影响
2.2.1干旱胁迫对花棒种子逐日萌发率的影响 干旱胁迫下花棒种子起始萌发天数分别为第1,1,1,1,1,3 d(图4)。当PEG-6000溶液达到25%的浓度时,花棒种子起始萌发的时间延后,抑制了萌发进程。当PEG-6000溶液为5%,10%,15%时,花棒种子逐日萌发率的峰值分别为36%,24%,17%,均小于对照组CK2,但与对照组的逐日萌发率峰值同天出现。当PEG-6000溶液浓度≥20%时,种子逐日萌发率的峰值出现明显滞后现象。

图4 不同浓度PEG-6000胁迫对花棒种子逐日萌发率的影响Fig.4 Effects of different concentrations of PEG-6000 stress on daily germination rate of Hedysarum scoparium seeds
2.2.2干旱胁迫对花棒种子发芽率及发芽势的影响 随着PEG-6000溶液浓度逐步升高,花棒种子发芽率及发芽势呈下降趋势(图5)。当PEG-6000溶液为15%时,花棒种子的发芽率达到87.7%,为对照的91.6%,此时与对照组差异不显著;当溶液浓度达到20%时,种子发芽率开始降低为67.7%,与对照组差异显著(P<0.05);当PEG-6000溶液为25%时,花棒种子发芽率降低至25.7%,仅为对照组的26.9%。可见,当PEG-6000溶液浓度高于20%时,发芽率低于70%,该环境对花棒种子发芽率存在显著抑制作用。
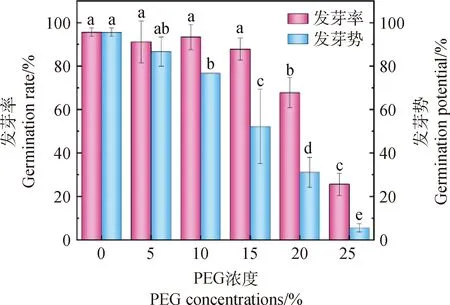
图5 不同浓度PEG-6000胁迫对花棒种子发芽率和发芽势的影响Fig.5 Effects of different concentrations of PEG-6000 stress on germination rate and germination potential of Hedysarum scoparium seeds
对于发芽势来说,当PEG-6000溶液浓度为5%时,种子发芽势为86.7%,为对照组的90.7%,与对照组无显著差异;当溶液浓度达到10%时,种子发芽势为77.0%,为对照组的80.5%,与对照组产生显著差异(P<0.05),但与5%浓度处理发芽势差异不显著;当溶液浓度逐步增加到15%时,其种子发芽势为52.2%,为对照组的54.6%;当浓度增加至20%时,花棒种子发芽势为31.1%,仅为对照组的32.5%,产生明显抑制作用;当溶液浓度达到25%时,花棒种子发芽势降低至5.6%。因此,随着PEG-6000溶液浓度的升高,花棒种子的发芽率及发芽势均呈下降趋势,当PEG-6000溶液浓度高于15%时,对花棒种子的发芽率及发芽势产生明显抑制作用。
2.2.3干旱胁迫对花棒种子发芽指数及活力指数的影响 随着PEG-6000溶液浓度的升高,花棒种子的发芽指数与活力指数均呈下降趋势(图6)。当PEG-6000溶液浓度为5%时,花棒种子发芽指数为62.3,与对照组无显著差异;当PEG-6000溶液浓度为10%时,其发芽指数为53.6,为对照组的83.4%,虽未产生抑制作用,但表现出显著差异(P<0.05);当PEG-6000溶液浓度为15%时,种子发芽指数为35.6,为对照组的55.4%,没有产生明显抑制作用;当溶液浓度为20%时,种子发芽指数为22.0,为对照组的34.2%,此时产生明显抑制作用;在溶液浓度达到25%时,种子发芽指数仅为5.0。

图6 不同浓度PEG-6000溶液胁迫对花棒种子发芽指数与活力指数的影响Fig.6 Effects of different concentrations of PEG-6000 stress on germination index and vigor index of Hedysarum scoparium seeds
随着PEG-6000溶液浓度不断升高,花棒种子活力指数下降幅度不断增大,表现出显著差异(P<0.05)。当溶液浓度为5%时,其活力指数为7.4,为对照的79.6%;当PEG-6000溶液浓度为15%时,花棒种子活力指数为3.8,为对照组的40.4%,开始产生抑制作用;当溶液浓度升高至20%时,其活力指数为1.3,为对照组的14%,抑制作用明显;当溶液浓度达到25%时,其活力指数仅为0.1,为对照组的1.0%。由此可得出,随着PEG-6000溶液浓度升高,种子活力指数下降,当PEG-6000溶液浓度大于15%时,活力指数下降趋势明显,种子生长潜力明显降低,可见花棒种子活力指数对PEG-6000胁迫响应较为明显。
3 讨论
3.1 花棒种子萌发对NaCl胁迫的响应
本试验通过运用不同浓度NaCl溶液模拟不同程度盐胁迫环境,观察记录花棒种子在盐胁迫环境下萌发情况,探讨花棒种子的耐盐性。关于NaCl溶液对种子萌发的影响,目前有两种结果,乔枫、朱金方等在沙棘[34]和柽柳[35]种子上得出的研究结果显示,低浓度NaCl胁迫有助于种子萌发[3],高浓度时则存在抑制作用。张建锋等[36]在研究流苏和香椿种子时得出结果显示,各浓度NaCl胁迫均会抑制种子萌发,且浓度越大,引发的抑制作用会越明显。本试验得出的结果与张建锋等研究结果相似。当NaCl浓度为0.2%时,花棒种子内部膜系统可以有效修复[37],该浓度发芽率为83.3%,未产生抑制作用;随着NaCl浓度增加,种子内部膜系统的修复逐渐延缓,当浓度达到0.4%时,种子内部膜系统不能修复,发芽率仅为46.7%,受抑制作用较为明显。在本试验中,低于0.2% NaCl浓度并未抑制种子的萌发,当浓度不断升高时,花棒种子各项萌发指标急剧下降。由此可推知,在含盐量较低的环境下,花棒种子具有一定的耐受性,该研究结果和杨佳鑫[38]、朱金方等[35]研究观点相似,后期应开展系统选育,以培育耐盐品种,探究利用沙区地下盐水进行固沙造林的方法。
3.2 花棒种子萌发对模拟干旱胁迫的响应
PEG-6000是常见的大分子渗透调节剂,通过对种子渗透压进行调整,改变水势环境,对水分进入种子内进行限制[39],使种子内的各种细胞、酶处于活化状态。因此,采取PEG-6000溶液处理花棒种子,模拟干旱对种子的胁迫试验,实际上是利用其对种子所具有的这种渗透调节作用[40]。通过本试验发现,当PEG-6000溶液≤5%时,花棒种子萌发能力受到影响并不显著,当溶液浓度高于15%时,花棒种子各萌发指标均与对照存在显著差异。可见,当PEG-6000浓度≤15%时,花棒种子的发芽能力未受到明显影响;而当溶液浓度达到20%时,各项发芽指标明显受抑制作用;当PEG-6000溶液浓度为25%时,对应环境水势具体为-0.86 MPa[41],在这种环境下花棒种子的发芽率为25.6%,说明在重度干旱胁迫环境下,花棒种子也具有一定的耐受性。有研究表明,轻微干旱胁迫环境能促使种子启动自我保护机制,缓解种子吸胀过程中对膜系统造成的损伤,这对修复膜系统极为有益,进而有助于植物种子发芽率的提升[42-43]。姜生秀、刘帅等对沙冬青[44]、沙棘[34]、柽柳[45]等沙生植物抗旱性研究结果与上述结果一致。本试验得出的结果与上述结果不同,花棒种子的发芽率受种子采摘年份影响较大,低浓度PEG-6000环境对花棒种子发芽率的提升不明显,所以轻微干旱是否能促使种子萌发,可能还与受到胁迫种子的种类、采摘年份及其生长环境等因素有关。
通过本试验可知,花棒种子萌发能力随NaCl和PEG-6000溶液浓度的升高均呈下降趋势,揭示了花棒种子萌发的NaCl和PEG-6000浓度界限,对其选择适宜栽植的环境条件和区域提供参考价值。本试验初步得到了花棒种子在盐旱条件下的萌发阈值,但是花棒种子在萌发过程中,其生理指标受盐旱胁迫下出现的具体特征、相应变化以及构建耐盐基因载体,改良植株培育等问题,还需要进行深入研究。
4 结论
本试验结果表明,随着NaCl浓度的升高花棒的萌发能力呈下降趋势,当NaCl浓度高于0.2%时,种子各项萌发指数均急剧下降,说明花棒耐盐性相对较低。随着PEG-6000溶液浓度的升高花棒种子萌发能力同样呈下降趋势,当PEG-6000溶液浓度高于15%时,种子各萌发指标显著降低,种子萌发受抑制作用明显。因此,花棒种子萌发能忍耐的模拟盐胁迫和干旱胁迫的浓度分别为0.2% NaCl,15% PEG-6000,花棒种子萌发期能忍耐低盐分、中度干旱胁迫。
