煤矸石山不同植物根际土壤AM真菌群落多样性分析
2022-08-31甄莉娜刘丽珍王润梅
甄莉娜, 刘丽珍, 牛 艳, 李 侠, 李 朕, 吴 娜, 王润梅
(山西大同大学生命科学学院应用生物技术研究所, 山西 大同 037009)
煤矸石是煤矿开采过程中产生的固体废弃物,矸石的长期堆积,不仅占用耕地,甚至会发生自燃,产生CO,SO2等酸性气体,污染矿区空气、土壤和水源[1],使矿区生态环境被严重破坏[2]。
AM真菌属球囊菌门专性营养共生真菌,存在于绝大多数生态系统中[3]。AM真菌能与90%以上的陆生和水生植物根系形成共生体,参与植物的生理代谢过程[4]。在矸石山恢复初期,植物与AM真菌存在良好的共生关系[5],AM真菌以其庞大的菌丝网络系统将植物与土壤有机地联合起来,能够促进宿主植物对土壤氮、磷、钾等矿质元素及水分的吸收,改善植物的营养状况[6]。不仅能提高植物的生物量,还能够改良矿区土壤的理化性状、提高土壤生产力[7]。对煤矸石山矿区植被演替、生态系统稳定以及修复重金属污染土壤具有重要意义。
AM真菌群落组成受到多种因素的影响,如海拔、降水量、植物类型、土壤pH值、盐度、粒径、养分含量、矸石山高度等[8-11]。AM真菌群落组成、丰富度及多样性指数等在不同植物根际土壤中存在差异[9]。植物、土壤和菌根真菌之间的相互关系,对矿区等受扰动土壤生态系统功能的恢复具有重要意义。煤矸石山较高的AM真菌多样性,可能会缓解外界干扰对矸石山植物多样性造成的影响。
环境和共生植物种类影响了不同类群AM真菌群落的多样性。球囊霉属(Glomus)在不同生态环境中均是优势属,在所有采样点的出现频率和相对丰度最大[12],有研究发现根内球囊霉、球囊霉和隐球囊霉是半干旱矿区常见的AM真菌[13]。禾本科植物广泛存在于各个生态系统中,在草地群落组成的出现率和丰富度均居首位[14]。有研究发现煤矸石矿区周边禾本科植物最多,早期修复植被均能与AM真菌形成良好的共生关系[6]。菊科植物种类多,植株富含脂肪,可形成菌根[15],其盖度的增加,对土壤AM真菌的群落结构和多样性有重要的影响力[16];藜科植物是常见的非菌根植物,主要分布在荒漠和半荒漠草地,于宏清研究表明大部分藜科植物在盐碱地都存在菌根侵染现象,AM真菌可以显著提高藜科植物生物量,提高抗盐胁迫和养分吸收的能力[17]。
AM真菌对煤矿区植物群落的恢复重建有重要的促进作用[18],AM真菌群落多样性的增加可以提高植物群落多样性,进而提高生态系统的稳定性[19],以往研究主要集中在菌根真菌对矿区植物生长状况、养分吸收、重金属胁迫、细菌和真菌多样性等方面[20-21],而关于矸石山植物根际AM真菌多样性的研究较少。本文以煤矸石山不同植物类型土壤根际AM真菌为研究对象,检测不同恢复阶段优势植物AM真菌群落的多样性,比较不同植物根际土壤理化性质、AM真菌群落组成、相对丰度及多样性指数间的差异,为煤矸石山的生态恢复提供理论和实践依据。
1 材料与方法
1.1 采样地概况
大同市晋华宫矿是大同煤矿集团下属的国有大型矿井之一,坐落于山西省北部,113°13′E,40°10′N,距大同12.5 km,矿区内有丰富的矿产资源,可采储量1.5亿t。地处低山丘陵黄土地貌景观,井田内部为黄土覆盖,属中温带大陆性气候,干燥少雨,降水量集中在7,8,9三个月,年平均最大降水量为628.3 mm,年温差大,平均气温为5.1℃。
1.2 样品采集
在大同市晋华宫矿煤矸石山区随机采样,于7月份进行矸石山不同坡向植物调查,设置草本植物样方为1 m×1 m,共18个,在每个样方内选取矸石山常见植物取样,主要包括禾本科狗尾草(Setariaviridis)、虎尾草(Chlorisvirgata)、草地早熟禾(Poapratensis),豆科植物紫花苜蓿(Medicagosativa)、黄花草木樨(Melilotusofficinalis)、山野豌豆(Viciaamoena),藜科植物灰绿藜(Chenopodiumglaucum)、猪毛菜(Salsolacollina)、地肤(Kochiascoparia),菊科植物苍耳(Xanthiumsibiricum)、黄花蒿(Artemisiaannua)和大籽蒿(Artemisiasieversiana)。利用抖根法采集根际土壤,抖动植物根系,去除根表面附着的大部分土壤,只保留根周围1 mm左右的土,利用无菌生理盐水洗下,离心,收集根际土。幼嫩根系保存于FAA(福尔马林5 mL、冰醋酸5 mL、70%酒精90 mL)固定液中,在实验室中进行根系侵染状况检测。另根际土用冰盒储存带回实验室,在-80℃保存。
1.3 AMF Illumina MiSeq测序
土壤丛枝菌根真菌群落多样性委托“美吉生物科技有限公司”检测,根据 E.Z.N.A.®soil DNA kit (Omega Bio-tek,Norcross,GA,U.S.) 说明书进行微生物群落总DNA抽提,利用琼脂糖凝胶电泳及NanoDrop2000技术,分别检测提取DNA的质量、浓度与纯度;利用引物扩增丛枝菌根真菌基因V4-V5高变区,测序区ITSrRNA的扩增引物序列为:AMV4.5 NF (F)-AAGCTCGTAGTTGAAT-TTCG、AMDGR(R)-CCCAACTATCCCTATT AATCAT,使用PCR(GeneAmp 9700)热循环系统在95℃下循环30 s,在55℃下循环30 s,在72℃下循环45 s,共进行32个循环;在72℃下进行10 min的延伸,每个样本3个重复。
同一样本的PCR产物混合后,通过琼脂糖凝胶检测PCR产物,利用AxyPrep DNA凝胶回收试剂盒纯化回收产物,并用QuantusTMFluorometer定量检测回收产物。使用NEXTflexTMDNA快速建库试剂盒进行建库,包括接头链接、筛选去除接头自连片段、PCR扩增富集文库模板、磁珠回收PCR产物、获得文库。利用Illumina公司的Miseq PE300平台进行测序。土壤丛枝菌根真菌群落多样性委托“美吉生物科技有限公司”检测。
1.4 土壤理化性质检测
使用pH计测定土壤pH值,利用重铬酸钾-浓硫酸氧化比色法测定土壤中有机质含量(Organic matter,OM),碱解扩散法测定土壤速效氮含量(Averlable nitrogen,AN),碳酸氢钠浸提-钼锑抗比色法测定土壤速效磷(Available phosphorus,AP),乙酸铵浸提-火焰光度计法测定速效钾含量(Available potassium,AK)[22-23]。
1.5 数据处理
采用SPSS 22.0(New York,USA)软件对不同植物类型数据进行单因素方差分析,比较检验煤矸石不同植物类型AM真菌土壤理化性质和群落多样性的差异,对Sobs指数、Chao1指数、Ace指数、Shannon指数、Simpson多样性指数进行分析,以上统计分析均在SPSS 22.0(New York,USA)软件中完成。用R软件(version2.15.3)分析和生成相对丰度柱形图、NMDS图和差异热图,分析不同植物类型AM真菌群落相对丰度,对土壤理化性质、多样性指数、丰富度指数等进行冗余分析(RDA),利用Gephi软件绘制网络关系图。
2 结果与分析
2.1 AM真菌群落稀释性曲线分析
基于97%的序列相似度水平上,共得到4个科植物28个根系样品的AM真菌稀释曲线。由图1可知,豆科和菊科的土壤真菌样品的稀释曲线都趋于平缓,OTU数量随探测深度的增加不再增加,说明样品OTU覆盖度已接近饱和,能够反映土壤中的真菌群落结构组成。藜科、禾本科土壤样品中丛枝菌根真菌OTU数目相对较多,藜科的稀释曲线仍有上升趋势,未达到饱和状态,表明如果继续增加探测深度,OTU数目可能还会上升。

图1 不同植物类型根际土壤AM真菌群落的稀释曲线Fig.1 Rarefaction curve of AMF community in rhizosphere soil of different vegetation types
2.2 根际土壤AMF群落结构组成分析
经检测禾本科、黎科、豆科和菊科植物的平均侵染率分别为:62%,38%,46%,50%。由根际土壤样品AMF属水平分析柱状图可知(图2A),共得到5个AMF类群属(≥不包括相对丰度小于0.5%的类群),球囊霉属Glomus-f-Glomeraceae相对丰度最高,球囊霉纲未分类属unclassified-c-Glomeromycetes为优势属。球囊霉纲未分类属在豆科中相对丰度值低于其它植物,仅达到8.6%,而盾巨孢囊霉属Scutellospora在豆科植物中的相对丰度高于其它处理。类球囊霉属Paraglomus在禾本科植物中丰度较高。
如图2B所示,共得到41个AM真菌菌种(不包括相对丰度小于0.5%的类群),AM真菌种水平丰度分别为:禾本科(26)>藜科(22)>菊科(16)>豆科(15),其中球囊霉纲未分类菌种unclassified-c-Glomeromycetes相对丰度最高,在禾本科、藜科和菊科中均达到50%以上,而在豆科中相对丰度较低(8.8%)。球囊霉属未分类菌种unclassified-g-Glomus-f-Glomeraceae和Glomus-Yamato08-A1-VTX00100分别是禾本科、藜科和菊科植物根际土壤AM真菌的次优势种和第3优势种。

图2 不同植物根际土壤AM真菌群落结构组成Fig.2 Composition of horizontal community structure of AMF in the rhizosphere soil of different vegetation types注:A,属水平;B,种水平Note:A,Genus level;B,Species level
豆科植物Glomus-lamellosu-VTX00193的相对丰度高于藜科与菊科。豆科中相对丰度较高的菌种包括球囊霉属未分类菌种unclassified-g-Glomus-f-Glomeraceae、Glomus-lamellosu-VTX00193和Glomus-sp-VTX00304,其中后2种在另外3科中比例极低。
2.3 根际土壤AMF群落物种组成差异比较
统计不同科植物根际土壤中共有和特有的OTU数量,选择相似水平97%的OTU样品表做出维恩图(图3)。4科植物共获得454个OTU,根际土壤AM真菌OTU数量表现为:禾本科(230)>藜科(172)>菊科(125)>豆科(121),各自独有的OTU数量分别是142个、75个、51个和63个。两两共有OTU数量比较,菊科与豆科、菊科与禾本科、藜科与豆科分别共有OTU为40个、48个、40个。其中禾本科与藜科同有OTU数量最多,为总OTU数量的16.3%,禾本科与豆科同有OTU数量最少,为总OTU数量的7.3%,说明禾本科与藜科土壤中AMF群落组成较相似,与豆科土壤中AMF群落组成差异较大。

图3 不同植物根际土壤AM真菌群落的OTU维恩图Fig.3 OTU Venn diagram of the AMF community in the rhizosphere soil of different vegetation types
2.4 不同科植物AM真菌多样性及丰富度
由不同植物根际土壤AM真菌多样性的比较结果可知(表1),禾本植物的平均Sobs指数(53.25)和Chao1指数(57.33)最高,显著高于豆科和菊科植物(P<0.05),说明禾本科植物根际土壤AM真菌数量最多。菊科的Ace指数低于其它3科植物,显著低于禾本科植物(P<0.05),根际AM真菌种数最低。豆科的平均Simpson指数(0.49)和藜科的Shannon指数(0.77)最低,表明物种多样性较低,但均与其它科植物差异不显著。4科植物的Shannon,Simpson指数没有显著差异,禾本科丰富度和多样性较高,豆科、菊科的丰富度较低。
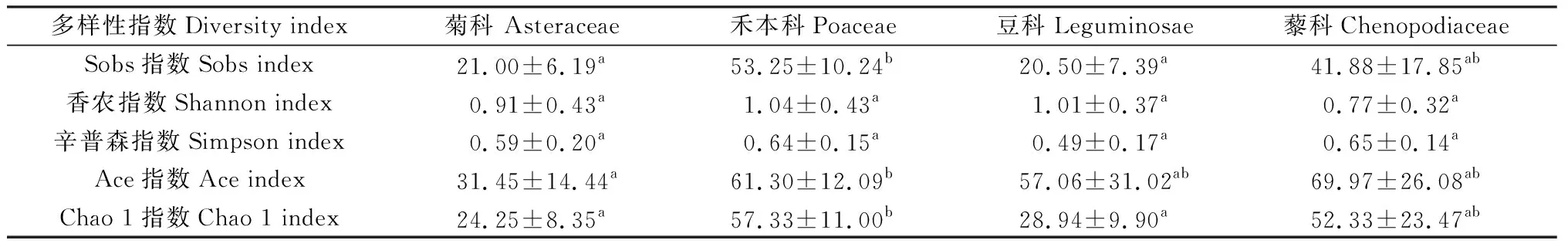
表1 不同植物类型AM真菌多样性及丰富度Table 1 Diversity and richness of arbuscular mycorrhizal fungi in the rhizosphere soil of different vegetation types
2.5 根际土壤AMF群落NMDS图分析
根据Bray-Curtis相似性系数,对不同植物根际土壤中的AM真菌群落数据进行多维尺度分析(NMDS),置换多元方差分析(PERMANOVA)表明豆科、菊科、禾本科和藜科植物之间的根际土样中AM真菌群落种类差异显著(P<0.05)(图4),由于禾本科土样各样点间的距离极为接近,说明禾本科土样中AMF群落种类的相似性系数高并且物种最为丰富。菊科、藜科的样点空间分布零散,其物种数与相似性系数均低于禾本科。

图4 不同植物的根际土壤AM真菌群落的NMDS图Fig.4 NMDS map of AMF community in the rhizosphere soil of different vegetation types注:不同颜色椭圆表示不同科植物根际AM真菌群落95%的置信区间,置换多元方差分析显示Stress=0.178,R=0.151,P=0.017Note:Different color ellipses represent 95% confidence intervals of AM fungal communities in rhizosphere of different plants families. The displacement multivariate analysis of variance shows Stress=0.178,R=0.151,P=0.017
2.6 土壤理化性质分析
由表2可知,煤矸石植物根际土壤偏碱性,同禾本科和菊科植物相比藜科植物显著降低了根际土壤pH值;禾本科植物根际土壤有机质和速效氮含量最高,显著高于其它植物(P<0.05),其有机质含量分别是豆科、菊科和藜科植物的5.52,3.72,2.7倍;不同植物根际土壤速效磷和速效钾含量差异显著(P<0.05),藜科植物二者含量最高,其速效钾含量分别是禾本科和菊科的2.13和1.87倍,差异显著(P<0.05),豆科速效磷含量显著低于禾本科和藜科植物(P<0.05)。

表2 不同植物类型土壤理化性质分析Table 2 Soil physical and chemical properties of different vegetation types

图5 不同植物AM真菌群落与土壤理化性质的RDA图分析Fig.5 RDA analysis of AM fungal communities of different plants and soil physical and chemical properties
2.7 RDA图分析
种水平RDA图分析结果表明,第一轴(RDA1)对AMF群落分布的方差的解释率为21.76%,植物根际土壤AMF群落与AN,pH值,AK相关密切,但差异不显著。第二轴(RDA2)对AMF群落分布的方差解释率为0.51%,主要影响因子为OM。两轴共同解释率为22.27%。
通过构建土壤理化性质与不同科植物AM真菌属水平的Heatmap图,发现类球囊霉属(Paraglomus)与土壤有机质含量极显著正相关(P<0.001),与土壤速效氮含量显著正相关(P<0.01),含量较高的未分类属真菌与土壤有机质含量显著正相关(P<0.01)(图6)。

图6 土壤理化性质与AM真菌优势属相关性分析Fig.6 Correlation analysis between soil physical and chemical properties and dominant genus of AM fungi注:*表示P<0.05,**表示P<0.01,***表示P<0.001,红色代表正相关,蓝色代表负相关Note:* means significant differences at the 0.05 level,** means significant differences at the 0.01 level,and ***means significant differences at the 0.001 level. Red is a positive correlation. Blue is a negative correlation
2.8 AM真菌群落种间共生网络关系图
通过构建种间共生网络关系图,比较不同植物根际AM真菌菌群间的网络相关性,反映AM真菌菌群的共存格局,探究煤矸石山恢复初期常见的植物类群与土壤菌根真菌群落的共生关系。不同节点代表不同物种,不同颜色代表该物种的种属,红色和绿色连线分别表示正负相关,粗细代表相关性大小,节点连线的多少代表该菌种与其它菌种联系的密切程度。
如图7所示,煤矸石山禾本科和黎科植物根际土壤菌根真菌种类、共生网络的边数量均高于豆科和菊科植物,二者AM真菌网络规模大于菊科和豆科植物,种间互作关系复杂。4科植物均以球囊霉属菌种占优势,禾本科和黎科根际AM真菌核心物种间正相关关系比例更高,禾本科植物菌根真菌菌种正相关关系130个,负相关21,以Unclassified-c-Glomeromycetes,Glomus-M0-G4-VTX00166,Glomus-perpusillum-VTX00 287,Glomus-group-B-Glomus-lamellosn-DVTX00193等27个物种为核心物种;黎科正相关关系152个,负相关32个,以Unclassified-c-Glomeromycetes,Glomus-Wirsel-OTU16-VTX 00156,Glomus-perpusillum-VTX00287等29个菌种为核心物种。豆科和菊科植物正相关分别是26,30个,负相关8,20个,核心物种分别为15和13个。
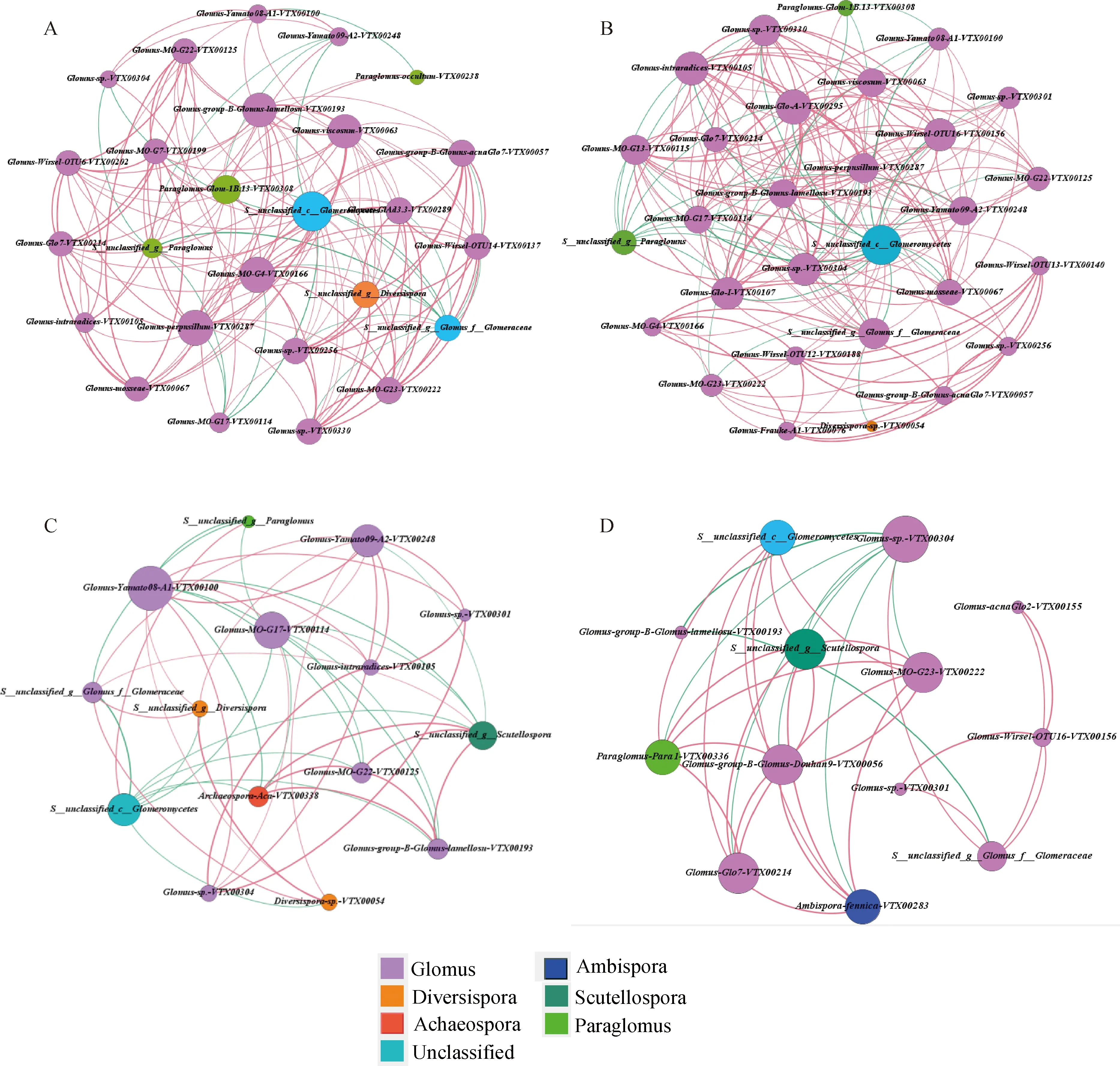
图7 AM真菌群落相关性网络分析Fig.7 Network analysis of the AM fungi community注:A,禾本科植物;B,黎科植物;C,豆科植物;D,菊科植物;边代表两节点间相关性显著(P<0.05)Note:A,Gramineae;B,Chenopodiaceae;C,leguminous;D,Asteraceae;The correlation between the two nodes represented by the edge was significant at the 0.05 level
3 讨论
真菌多样性与地上植被多样性间有很强的耦合性,除植被调查外,土壤真菌多样性是衡量矿区土壤恢复进程的重要生物指标[24]。本试验以煤矸石山植物根际土壤菌根真菌为研究对象,比较了不同科植物根际AM真菌群落种类和结构的差异,探究根际土壤AM真菌群落组成与不同植物类型的关系。尽管驱动AM真菌物种功能多样性的机制尚不清楚,有研究发现与非生物因素相比,植物群落对地下菌根真菌多样性具有重要的影响力[25],乔木和草本植物物种数量影响着AM真菌的丰度和多样性[26]。本试验结果表明不同植物根际土壤AM真菌菌群间差异较大,吴佳伟等[27]也得到了与本研究一致的结果。植物对与其共生的伙伴有一定的选择作用,有研究发现与豆科和禾本科植物共生的AM真菌菌群不同[28]。AM真菌菌群的功能贡献差异最有可能与植物特定的养分需求有关[29]。煤矿区寄主植物种类可能通过土壤性状的变化对AM真菌群落产生强烈的影响[30]。
煤矸石山复垦地土壤OTU数量受到植物优势类群的影响,调查发现禾本科和藜科OTU数量较多,豆科和菊科的OTU数较少。禾本科的Shannon指数和Chao1指数最高,多样性和丰富度最高。张海波等发现AM真菌物种丰富度、Shannon多样性指数受到土壤类型与植物种类交互作用的显著影响[31];在矸石山恢复初期,禾本科、菊科和藜科植物是先锋植物,而豆科植物随着表层基质理化性质的改良出现较晚[9],这可能是导致豆科植物根际AM真菌群落结构与另外3科植物有较大差异的原因。随着时间的推移,植物群落对AM真菌多样性的影响,可能是由于在采矿后生态系统发展过程中,植物群落演替引起的植物特定养分需求和寄主特异性的变化引起的[9]。不同人工恢复植被根际AM真菌群落组成不同,增加植物种类可以增加根系和土壤中AM真菌群落的多样性[32]。
本研究发现球囊霉属真菌在煤矸石山不同植物根际土壤AM真菌菌群中占据优势地位,这可能是由于球囊霉属真菌养分吸收能力强、适应性强、繁殖快、且与草本植物之间能形成较强的共生关系,使其在植物根系和土壤中占优势[33-35]。其次是球囊霉纲未分类属丰度较高,该属物种在其它生境中较少检测到,疑似为矿区特有菌根真菌类群。类球囊霉属常出现在煤矸石山恢复后期,而多样囊霉属(Diversispora)和盾孢囊霉属(Scutellospora)出现在恢复初期[26]。本试验中禾本科植物的类球囊霉属丰度高于其它科植物,在前期植物调查中发现,禾本科植物在煤矸石山恢复的初期和中期均是矸石山优势物种,说明禾本科植物能够与矸石山不同恢复阶段的AM真菌形成良好的共生关系,这也可能是其在煤矸石山恢复过程前期处于优势地位的重要原因。多样囊霉属在菊科植物根际土壤中有更高的丰度,有研究发现该属菌种能够提高植物在低磷土壤中的适应能力,该属真菌可能提高了菊科植物在煤矸石山恢复早期低磷土壤中的生存能力[11]。Allen等研究发现原囊霉属(Archaeospora),多样囊霉属和类球囊霉属随着矸石山恢复时间的增加,数量变化较大,可能是由于这些物种在功能上与生态过程更相关,而对与其共生的植物资源的需求较低[35]。
禾本科植物根际土壤有机质和速效氮含量高于其他植物,藜科植物根际土壤pH值最低,而土壤速效钾含量显著高于其他植物。禾本科为须根系植物,根系发达,易于被AM真菌侵染,使其有较强的养分吸收能力,根际区域有较高的养分含量。藜科植物为非菌根植物,在煤矸石山采集的藜科植物根系中均有菌根侵染现象,并存在较高的丰度,说明在恶劣的矸石环境中,AM真菌与藜科植物形成了良好的共生关系,通过合作,双方均获得较好的收益。AM真菌能够增加生长在矿区等重金属污染胁迫土壤中植物的根系活力、生物量、根际土壤微生物菌群等,降低对植物的毒害作用[34]。研究发现不同植物根际AM真菌群落网络关系差异显著,且关系网中核心物种组成不同,但均以球囊霉属为主。禾本科和黎科植物网络连接密集程度更高且核心物种组成更丰富,黎科作为非菌根植物,可能通过形成密集的AM真菌网络结构,促进了其在矸石山恢复早期的生长。有研究发现,添加AM真菌改善退化土壤微生物群落关系网,尤其是真菌的网络结构,进而改良了土壤结构[36-37]。在煤矸石山土壤修复过程中,应充分考虑土壤类型及养分含量等因素,选择适宜的修复植物,发挥AM真菌的生态功能。
4 结论
4科植物共分离到球囊霉纲AM真菌5目7科7属 41种,禾本科和藜科植物的OTU数量较多。与禾本科植物共生的AM真菌群落多样性最高,具有较高的α多样性,且禾本科植物之间根际土壤AM真菌群落种类的相似性系数较高。藜科根际土壤AM真菌菌群组成较为单一,豆科植物根际OTU数量最低。不同科植物之间根际AM真菌群落差异显著。不同植物根际土壤AM真菌菌种生态网络关系差异显著,禾本科和黎科植物网络连接密集程度较高且核心物种组成更丰富。
