HCV 跨膜蛋白(P7)重组表达及化学发光法检测HCV 感染者血清中抗P7抗体的建立与评价①
2022-08-30戴玉柱张英杰蚌埠医学院检验医学院蚌埠233000
吴 婕 戴玉柱 张英杰 成 军 (蚌埠医学院检验医学院,蚌埠 233000)
丙型肝炎病毒(hepatitis C virus,HCV)是引起丙型肝炎的病原体,可导致肝脏慢性炎症坏死和纤维化,部分患者可发展为肝硬化甚至肝细胞癌(hepatocellular carcinoma,HCC)[1]。HCV 的核衣壳蛋白(Core)、包膜蛋白(E1、E2)及跨膜蛋白(P7)是构成HCV 外壳蛋白骨架的主要部分,其中P7 是由HCV 基因组2 580~2 768 核苷酸编码63 个氨基酸残基组成的小疏水性蛋白,其编码基因位于结构蛋白和非结构蛋白之间,在细胞体内表达后整合于内质网膜,形成六聚体的阳离子通道,以利于成熟的病毒颗粒释放,对HCV 病毒颗粒释放有一定促进作用,与HCV 病毒颗粒合成、HCV 感染的机制密切相关[2]。为了解 P7 蛋白在 HCV 感染者体内的免疫应答情况及应答产物抗P7(anti-P7)抗体及循环免疫复合物(P7-IC)与HCV 不同基因型、不同临床分期、抗病毒治疗前后的相关性,本文重组表达P7蛋白和建立检测HCV 感染者血清中抗P7 抗体的方法,并进行应用评价。
1 材料与方法
1.1 材料
1.1.1 重组表达P7 蛋白的相关材料 含HCV1b基因型P7 核酸序列(Accession No:AJ238800)的质粒PUC-P7(杭州擎科生物技术有限公司合成);大肠杆菌感受态细胞BL21(DE3,本实验室保存);限制性内切酶Bam HⅠ、HindⅢ(美国NEB 公司);KODPLUS 系列高保真性聚合酶(日本ToYoBo 生物公司);T4 DNA连接酶(上海生工生物工程股份有限公司);谷胱甘肽S 转移酶(glutathione S-transferases,GST 蛋白,100 µg,北京义翘神州科技股份有限公司);D2000 DNA Marker(100~2 000 bp)、D5000 DNA Marker(100~5 000 bp,莫纳生物科技有限公司);蛋白Marker(14.4~116.0 kD,美国Thermo Scientific公司);Ni-NTA-agarose亲和层析柱(德国QIAGEN公司)。
1.1.2 检测血清中抗P7抗体的相关材料 微孔板Nunc(美国Thermo Fisher 公司);包被液(pH=7.4 的0.02 mol/L 磷酸缓冲液)、封闭液(含5%牛血清白蛋白、1%蔗糖、4%明胶、0.2%Proclin 300 防腐剂、pH=7.4 的0.01 mol/L 磷酸缓冲盐溶液)、洗液(含0.5% 吐温-20、0.2%Proclin 300 防腐剂、pH=7.4 的0.01 mol/L 磷酸缓冲盐溶液)、样本稀释液(含20%牛血清、pH=7.4 的0.01 mol/L 磷酸缓冲盐溶液)、底物液 B(含 0.3 g/L 过氧化脲、pH=7.4 的 0.2 mol/L 磷酸缓冲液)、底物液A(含0.8 g/L 鲁米诺、0.008 g/L邻苯基苯酚、0.025 g/L 4-咪唑苯酚、pH=9.0 的0.1 mol/L 碳酸缓冲液)、酶标记抗体稀释液(含5%牛血清白蛋白、0.5%酶稳定剂、0.1%吐温-20、5µg/ml抗鼠抗体阻断剂、1µg/L 红色色素、0.2%Proclin 300防腐剂、pH=7.4 的0.01 mol/L 磷酸缓冲盐溶液)、酶标志物工作液(酶标记抗体稀释液对1 mg/ml辣根过氧化物酶标记羊抗人IgG 标记物原液稀释所得,原液购自杭州隆基生物科技有限公司)、阴性、阳性对照分别为热灭活的非HCV 感染者(抗P7 抗体阴性)和HCV 感染者(抗P7 抗体阳性)混合血清或血浆(含0.2%ProClin 300防腐剂),且人类免疫缺陷病毒抗体、梅毒螺旋体抗体、乙型肝炎病毒表面抗原测试呈阴性,上述所有化学试剂、药品均购自上海阿拉丁生化科技股份有限公司。
1.1.3 主要仪器 JY92-Ⅱ超声波细胞粉碎机(宁波新芝生物科技股份有限公司);Mini-Protean Tetra电泳仪(美国伯乐公司);Tanon 3500 全自动数码凝胶图像分析系统(上海天能科技有限公司);TZDCL-200S 化学发光免疫分析仪(厦门天中达生物科技有限公司)。
1.2 方法
1.2.1 收集血清 随机采集2019 年8 月至2020 年10 月于联勤保障部队第903 医院就诊的门诊、住院HCV 感染者45 例(厦门新创公司试剂筛查抗HCV抗体阳性,研究组)和同期在联勤保障部队第903医院健康体检中心体检的健康体检者50 例(抗HCV抗体阴性,对照组)静脉血,收集血清,或用EDTA 抗凝收集血浆,1 周内进行检测的血清或血浆样本可于2~8 ℃存放,如需长时间存放置于−20 ℃保存,避免反复冻融和交叉污染。
1.2.2 HCV 全长 P7 的 PCR 扩 增 P7 基因 引 物序列(P7 F:5'-ATCGGATCTGGTTCCGCGTGGATCCACCCTAGAGAACCTGGTGGTCC-3',P7 R:5'-TTAGT‑GGTGGTGGTGGTGGTGGGCGTATGCTTGTGGTGGTAA-3',P7 R1:5'-AGTCAGTCACGATGAATTAAGCTTTTAGTGGTGGTGGTGGTGGTG-3'),引物中分别引入Bam HⅠ和HindⅢ酶切位点(斜体部分),在反向引物P7 R1 中引入6 个His(组氨酸)及终止密码子TAA(黑体部分)。以合成的PUC-P7 质粒为模板,以P7 F和P7 R为引物进行第一轮PCR扩增,再以第一轮扩增的PCR 产物为模板,以P7 F 和P7 R1 为引物进行第二轮扩增。两轮PCR 扩增参数均为94 ℃2 min 预变性,94 ℃ 15 s、53 ℃ 30 s、68 ℃ 30 s,共30个循环,72 ℃ 7 min延伸。
1.2.3 PCR 产物鉴定与重组质粒pGEx-KG-P7 构建 采用限制性内切酶Bam HⅠ和HindⅢ酶切PCR 产物和表达载体pGEx-KG,酶切体系为50 µl:PCR 产物/pGEX-KG 43 µl,Bam HⅠ 1 µl,HindⅢ1µl,酶切缓冲液NE Buffer 2.1 5µ(l含1 mol/L NaCl、100 mmol/L MgCl2、10 mmol/L DTT、pH=7.9的0.5 mol/L Tris-HCl缓冲盐溶液);混匀后37 ℃水浴消化3~4 h,酶切完成后,琼脂糖凝胶回收所需目的片段和载体片段;回收结束取出PCR 管,加入上样缓冲液6×Loading Buffer 9µ(l含0.05%溴酚蓝、0.05%二甲苯腈蓝FF、36%甘油、30 mmol/L EDTA,用2 mol/L NaOH 调整pH=7.0),混匀,上样于1.0%琼脂糖凝胶进行电泳(150 V,8 min),电泳完毕后将凝胶置于凝胶成像系统中观察PCR 扩增片段大小是否约为189 bp。切下含目的片段凝胶,转至2 个新的无菌1.5 ml离心管,将凝胶块切碎,采用AXYGEN胶回收试剂盒进行DNA片段回收。限制性内切酶Bam HⅠ和HindⅢ酶切后的目的片段和表达载体pGEX-KG用T4 DNA 连接酶连接(16 ℃,8~12 h),送杭州擎科生物技术有限公司测序,与P7目的片段序列比较是否一致。
1.2.4 P7 蛋白的诱导表达 将质粒P703 转化至大肠杆菌感受态细胞BL21(DE3),在含 100 mg/L 氨苄青霉素的2×酵母膏蛋白胨琼脂培养基中37 ℃培养3~4 h,OD600为1.0~2.0时添加1 mmol/L异丙基硫代半乳糖苷诱导培养3 h。
1.2.5 P7 蛋白提取和纯化 离心收集菌体,重悬于缓冲液A(含0.2 mol/L NaCl、pH=8.0的50 mmol/L Tris-HCl 缓冲盐溶液)中超声波破碎;离心后的包涵体沉淀采用缓冲液B(含0.15 mol/L NaCl、1%Triton X-100、pH=8.0 的 50 mmol/L Tris-HCl 缓冲盐溶液)洗涤1 次;洗涤离心的沉淀采用缓冲液C(含0.5 mol/L NaCl、8 mol/L 尿 素 、10 mmol/L 咪 唑 、pH=8.0 的 50 mmol/L Tris-HCl 缓冲盐溶液)重悬溶解后经Ni-NTA-agarose 亲和层析柱纯化,SDS-PAGE电泳,收集目的蛋白。
1.2.6 P7 蛋白复性 将1.2.5 收集的纯化蛋白处理后透析复性,纯化蛋白标定为1.0 mg/ml,添加1 mmol/L 二硫苏糖醇(DTT)室温反应30 min;加入0.1%SDS 室温反应15 min,反应结束后装入含透析缓冲液的透析袋按1∶100 进行透析,透析缓冲液为pH=7.5的0.01 mol/L磷酸缓冲液。
1.2.7 抗P7蛋白抗体和GST 蛋白抗体检测微孔板制备 以间接法原理制备微孔板,重组HCV 跨膜蛋白P7 抗原最适包被浓度采用方阵(棋盘)滴定法选择,将重组HCV 跨膜蛋白P7 抗原采用包被液稀释至最适工作浓度(GST 蛋白相同浓度),将稀释后的HCV 跨膜蛋白P7 抗原 100 µl 加入微孔板(2~8 ℃,20~24 h),300 µl/孔加入洗液洗去未吸附到板上的蛋白,反复洗 3 遍,拍干;200 µl/孔加入封闭液(2~8 ℃,20~24 h);拍干贴上封板膜,放入密封袋,加入干燥剂2~8 ℃保存待用。
1.2.8 最适酶标志物工作液制备 采用酶标记抗体稀释液对1 mg/ml 辣根过氧化物酶标记的羊抗人IgG 标志物原液进行稀释,方阵(棋盘)滴定法选择最适酶标志物工作液。
1.2.9 血清中抗P7抗体和抗GST蛋白抗体检测①加样:将包被的微孔板固定于板架,每次检验设阴性对照2 孔、阳性对照1 孔,分别加入阴、阳性对照各100 µl,另设空白对照孔1 孔,不加任何样本,其余孔加入样本稀释液100µl,再平行加入待测样本各10 µl 于抗P7 抗体和抗GST 蛋白抗体微孔板,盖上封板膜振荡混匀,(37±1)℃孵育30 min,洗涤除去未结合组分;②加酶标志物工作液:除空白对照孔外,其余孔内加入100µl酶标志物工作液(两种微孔板相同的酶标记工作液);③孵育:盖上封板膜振荡混匀,(37±1)℃孵育30 min;④洗涤:弃孔内液体,将洗液注满各孔,静置时间不超过60 s,弃孔内洗液,重复洗5 次后拍干;⑤显色:每孔依次加入底物液B、底物液A 各50µl,振荡混匀,室温避光放置15 min;⑥检测:TZD-CL-200S 化学发光免疫分析仪测量各孔相对发光强度值(relative luminous intensity value,RLIV),计算各孔RLIR=样本RLIV/阴性对照RLIV均值。
1.2.10 结果判断 ①当抗P7 抗体微孔板中样本RLIV 阴性对照 RLIV 均值≥2.1,且抗 GST 抗体微孔板中样本RLIV 阴性对照RLIV 均值<2.1 时,为阳性;当抗P7 抗体微孔板中样本RLIV 阴性对照RLIV均值≥2.1,且抗GST 抗体微孔板中样本RLIV/阴性对照RLIV 均值≥2.1 时(患者体内存在抗GST 抗体),或当抗P7 抗体微孔板中样本RLIV 阴性对照RLIV 均值<2.1,且抗GST 抗体微孔板中样本RLIV阴性对照RLIV 均值<2.1 时,则为阴性;②质量控制:空白值应<30 000 RLIV,各阴性对照值应≤115 000 RLIV,且2 个阴性对照孔读数与阴性对照均值差异≤10%,各阳性对照值应>231 500 RLIV,否则实验无效,需重复检验。
1.2.11 抗HCV 跨膜蛋白P7 抗体检测试剂盒方法学指标评价[3-4]①精密度试验,批内不精密度:取已筛查到的高、低浓度样本,分别重复检测20 次(孔),计算RLIR 均值和SD,计算批内CV%(<10%为合格);批间不精密度:取已筛查到的高、低浓度样本,每天上午、下午各检测1 次,共进行10 d 20 批检测,计算RLIR 均值和SD,计算批间CV%(<15%为合格);②空白限和检出限,空白限:选择5份未感染HCV 受检者血清,每天测2 批,共检测6 d,记录RLIR 值,共得到60 个结果;按Ⅰ类错误(α=0.05),即LoB有5%可能性含有待测物;采用非参数检验将空白样品的结果由小到大排序,第95百分位数值即为空白限LoB;检出限:选择期望浓度为1~5 倍LoB的血清标本5 份作为低浓度样本,每天检测2 次,连续测定6 d,采用非参数分析法计算LoD;5份低浓度样本连续12 次测定,结果呈非正态分布,使用非参数程序估计LOD,即 LoD=LOB+Ds. β,Ds. β 为低浓度样品测定值中位数(M)和第5 个百分位数值的差值;③线性评价及分析测量范围(AMR)[5]:取未感染HCV 受检者血清(低值L:1.252 RLIR)和HCV 感染者anti-P7 抗体血清(高值H:18.774 RLIR),按5L、4L+1H、3L+2H、2L+3H、1L+4H、5H 比例配制6 份样本,每份标本检测2次取均值,以预期均值和实测均值分别为横坐标和纵坐标进行回归分析(r2>0.95);④准确度评价[6]:取浓度为 37.5 RLIR 的抗 P7 抗体血清(经U-Tube 蛋白超滤浓缩得到)分别按5%、10%加至抗P7 阴性血清,平行检测3 次,计算平均CV(90%~110%为合格);⑤干扰实验:将类风湿因子、乙型肝炎病毒表面抗体、乙型肝炎病毒e 抗体、梅毒螺旋体抗体、人类免疫缺陷病毒Ⅰ型和(或)Ⅱ型抗体阳性的血清标本与anti-P7 抗体阳性(9.332 RLIR)等量混合,同时以样本稀释液为对照,观察结果有无交叉反应;⑥稳定性观察:将同一批号的抗HCV跨膜蛋白P7抗体检测试剂盒(内含独立包装的已包被微孔板、样本稀释液、阴性对照、阳性对照、酶标记物工作液、底物液A、底物液B 及洗液)置于2~8 ℃保存,分别于0、3、6、9、12、15、18 个月检测同一份阳性对照血清,每次重复3次取均值,观察其稳定性(与初次比较<10%为合格);⑦实例应用:采用制备好的抗HCV 跨膜蛋白P7 抗体和抗GST 蛋白抗体检测试剂盒,分别对45 例HCV 感染者和50 例健康体检者的血清进行抗P7抗体检测,统计和比较两组人群抗P7抗体阳性率。
1.3 统计学处理 研究组与对照组抗P7抗体检测结果比较采用卡方检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 P7 基因扩增及表达载体pGEX-KG 构建 以合成的PUC-P7 质粒为模板,经PCR 扩增出含全长的P7基因(图1),酶切后电泳鉴定表明P7核酸片段插入大小约为189 bp(不含HIS),与预期大小相符(图 2),将 PCR 产物连接至 pGEX-KG 载体,测序正确(图3),得到质粒pGEX-KG-P7。

图1 两轮PCR扩增P7基因产物琼脂糖凝胶电泳鉴定结果Fig.1 Identification of two rounds of PCR amplified P7 gene products by agarose gel electrophoresis

图2 P7重组蛋白表达质粒酶切鉴定结果Fig.2 Identification of P7 recombinant protein expression plasmid by restriction enzyme digestion
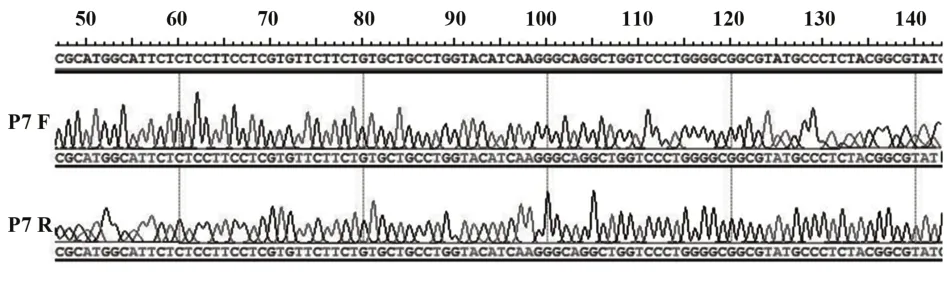
图3 连接到pGEX-KG载体上的P7基因测序图Fig.3 Sequencing map of P7 gene linked to pGEX-KG vector
2.2 P7 基因在大肠杆菌感受态细胞BL21(DE3)中的表达、纯化及复性 将质粒pGEX-KG-P7 转染至大肠杆菌感受态细胞BL21(DE3),诱导表达产生分子量为34 kD 的GST融合蛋白(图4),呈高表达。菌体经超声波破碎后,SDS-PAGE 检测发现,表达蛋白在沉淀中形成包涵体。通过包涵体裂解及Ni-NTA-agarose 亲和层析柱层析后透析复性,得到稳定的蛋白。
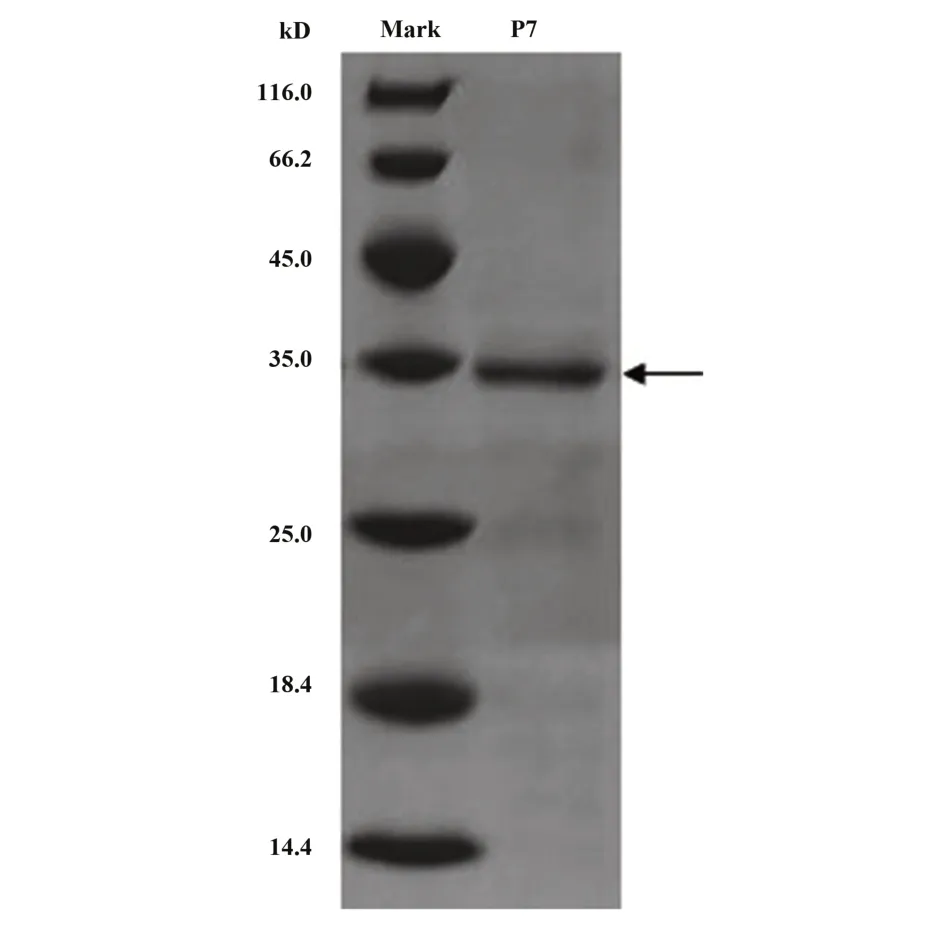
图4 诱导表达的P7融合蛋白电泳图(34 kD)Fig.4 Electrophoretogram of induced expression P7 fusion protein(34 kD)
2.3 重组HCV 跨膜蛋白P7 抗原最适包被浓度及酶标志物工作液选择 采用方阵(棋盘)滴定法选择重组HCV 跨膜蛋白P7 抗原最适包被浓度及酶标志物工作液分别为0.5、0.05 µg/ml,最适加样量均为100µl(表1)。
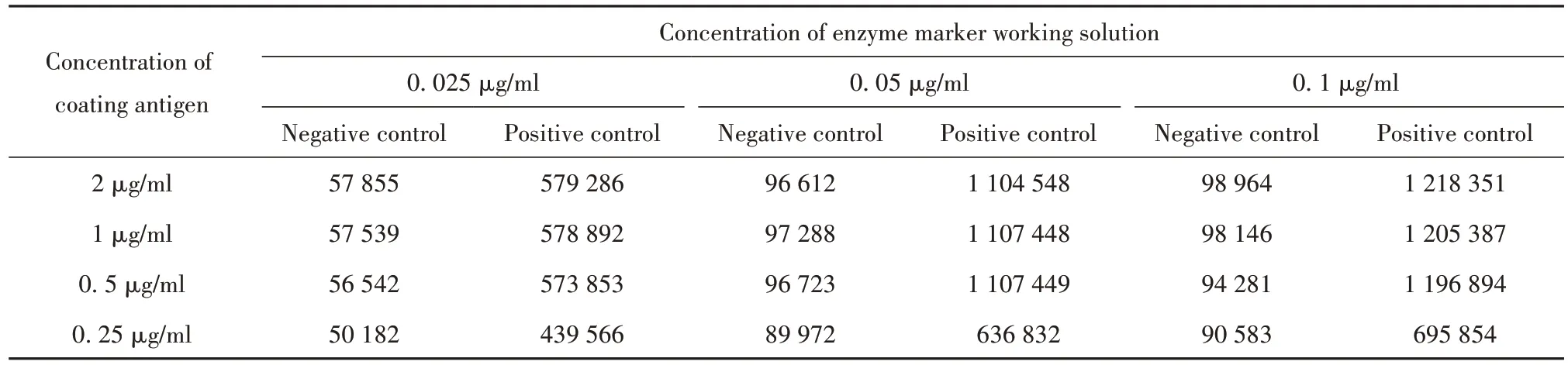
表1 方阵滴定法筛选最优抗原包被与酶标志物浓度(RLIV)Tab.1 Screening the optimal concentration of antigen coating and enzyme marker by square array titration(RLIV)
2.4 试剂盒方法学指标评价 ①精密度试验:批内CV%<10%,批间CV%<15%(表2),精密度较好;②空白限和检出限分别为1.56 RLIR、5.99 RLIR;③线性回归方程为y=1.099 1x-0.341 2(图5),回归系数为0.97~1.03,r≥0.975(r2≥0.95),AMR为1.252~18.774 RLIR;④准确度评价:平均回收率为97.8%;⑤干扰试验:类风湿因子、乙型肝炎病毒表面抗体、乙型肝炎病毒e抗体、梅毒螺旋体抗体、人类免疫缺陷病毒Ⅰ型和(或)Ⅱ型抗体阳性的血清标本对本试验无交叉反应;⑥稳定性结果:15 个月内试剂盒结果稳定;⑦实例应用:对随机收集的45 例HCV 感染者血清和50 例健康体检者血清进行抗跨膜蛋白P7 抗体检测,抗P7 蛋白抗体阳性率分别为20%(9/45)和0,而抗GST抗体阳性率为0(表3)。

表2 精密度实验统计结果(n=20)Tab.2 Statistical results of precision experiment(n=20)

表3 HCV感染者抗P7抗体检测结果(n)Tab.3 Detection results of anti-P7 antibody in HCV infected patients(n)
3 讨论
丙型肝炎主要由HCV 经血液(输血、针刺、毒品)、性、母婴及其他途径传播,呈全球性流行,未来10 余年内,HCV 感染相关死亡率(肝衰竭及肝细胞癌导致的死亡)仍将继续提高,危害患者健康和生命,已成为较严重的社会和公共卫生问题[1]。在慢性丙型肝炎感染中,宿主免疫因子及HCV 蛋白成分促进病毒持久性和免疫系统失调对丙型肝炎的免疫发病机制具有重要影响,因此了解这些蛋白成分及宿主产生的抗体有助于进一步研究丙型肝炎致病机制[7]。目前国内外对抗P7 抗体检测的化学发光免疫分析试剂盒及相关技术研究尚属空白,国外学者采用重组Core、E1、E2、NS2、NS3、NS4A、NS4B、NS5A、NS5B 蛋白建立免疫印迹法检测HCV 感染者血清相应蛋白抗体,结果表明:HCV 感染者中不同蛋白抗体阳性率存在差异,本课题组分析可能与HCV 感染者不同病程进展、不同基因型、DAA 治疗前后及血清中存在循环免疫复合物有关[8]。由于免疫印迹法灵敏度不高,常规用于临床诊断丙型肝炎的试剂盒均采用HCV 核衣壳区重组蛋白C-22、非结构蛋白NS3区重组蛋白C-200抗原、非结构蛋白NS4区重组蛋白C-200 和NS5 等作为混合包被抗原的第4 代试剂检测抗体,检测方法主要有ELISA、胶体金法、化学发光方法等,但这些试剂盒仅能检测HCV 感染者血清中的混合抗体,且不含抗P7 抗体,也无法区分是何种蛋白成分的抗体,无法全面揭示单个HCV 蛋白成分在HCV 感染者病情监测、预后评估和流行病学研究等方面的临床意义[9]。
本研究制备的化学发光法检测HCV 感染者血清抗P7 抗体试剂盒中的微孔板,包被了重组的GST融合P7 蛋白,基于文献[10-11],P7 蛋白片段较小,直接重组表达无法实现,仅融合P7 蛋白可成功表达;另外GST 对P7 蛋白的空间结构无影响(同样形成六聚体),因此,本研究选择GST 和HIS 双标签融合表达P7蛋白。采用血清抗P7抗体试剂盒对45例HCV 感染者血清进行检测,有9 例抗P7 抗体呈阳性(抗GST 抗体阴性),表明HCV 感染者体内存在一定比例的抗P7抗体(表3),提示跨膜蛋白P7存在免疫应答现象,这些研究结果为进一步揭示跨膜蛋白P7刺激机体产生抗体(anti-P7)和循环免疫复合物(P7-IC),以及在HCV 感染者不同基因型及亚型、不同临床分期(慢性、肝硬化、肝癌)、抗病毒治疗前后是否存在差异提供了技术手段。因此,建立检测HCV 感染者血清中抗P7 抗体或P7 循环免疫复合物中相应抗体的高灵敏度检测方法用于HCV 感染者治疗、病情监测、预后评估和流行病学研究具有重要意义,为评价P7 作为一种新型疫苗靶向诱导表达病毒抗原的肝细胞多功能CD4+和CD8+T 细胞效果或为中和表位疫苗的研究提供了客观验证指标[12-13]。
本研究建立的化学发光免疫分析法检测HCV感染者血清中抗P7抗体基于ELISA 间接法原理:微孔内预先包被重组P7抗原,受检标本血清中待测抗P7 抗体与固相载体表面的相应抗原结合,通过洗涤使固相载体上形成的抗原抗体复合物与液体中的其他物质分开,再加入辣根过氧化物酶标二抗结合于固相载体,最后加入反应底物鲁米诺,鲁米诺在碱性环境下被辣根过氧化物酶氧化而处于激发态,当从激发态回到基态时,辐射出最大发射波长为425 nm 的光,酶促发光产生的光信号通过光电倍增管进行信号转换后得到相应信号值,以RLIR 表示,待测抗P7 抗体浓度与化学发光强度在一定条件下呈线性关系。另外,本研究采用两种化学发光增强剂(邻苯基苯酚和4-咪唑苯酚)发挥协同增强效应,显著降低本底信号及使鲁米诺发光信号在较长时间内保持稳定,间接放大了免疫应答结果,使测定方法具有较高的敏感度和稳定性[14]。
为得到有效浓度的P7抗体阳性对照血清,本研究收集HCV 感染者混合血清或血浆(人类免疫缺陷病毒抗体、梅毒螺旋体抗体、乙型肝炎病毒表面抗原测试呈阴性),并对其进行热灭活,由于抗P7抗体在HCV 感染者中阳性率仅为20%左右,故采用U-Tube 蛋白超滤浓缩(30 kD)管浓缩 IgG 抗体(50 ml 浓缩至10 ml),浓缩后的 HCV 感染者混合血清或血浆中加入0.2%ProClin 300防腐剂,以提高特异P7抗体检出率。
本研究对HCV 感染者血清抗P7 抗体的化学发光免疫分析法进行了方法学评价,结果表明:各项指标符合方法学要求,该试剂盒可用于HCV 感染者筛查诊断、病情监测、预后评估、疾病机制和流行病学研究。
