黄河三角洲盐沼湿地蟹类对芦苇种群动态的下行控制作用及空间变异
2022-08-30徐长林任君临
徐长林,任君临,贺 强
(1.复旦大学 生物多样性与生态工程教育部重点实验室,上海 200438;2.复旦大学 上海长江河口湿地生态系统国家野外科学观测研究站,上海 200438)
理解全球变化下滨海湿地植被动态及其生物和非生物驱动因素是滨海湿地生态学及保护修复中亟需深入理解的基础科学问题[1-3]。生物和非生物因素在调节盐沼植物种群动态时,两者的相对重要性会受到环境胁迫和自身性状的影响[4]。早期研究主要关注盐度、水分等上行因子[5],或通过研究植物种间相互作用关系以理解植物种群的动态变化[6-8]。相比于上行因子(bottom-up force)和植物种间关系对植被动态影响的研究,下行因子(top-down force)对植被动态影响的研究则相对较少。下行因子通常是指高营养级生物通过取食等行为对低营养级生物产生调控作用的因子[9-10]。尽管有研究证明动物等消费者对滨海湿地植物种群动态也具有较强的下行控制作用[11],但动物对植物种群动态影响的时空变异及驱动机制仍不明确。
盐沼是滨海湿地的主要类型之一,为人类社会提供多重关键生态系统服务[12]。作为盐沼湿地生态系统的生产者,植被是盐沼湿地生态系统功能运转的基石,支撑着盐沼湿地的多重生态系统服务[13-14]。此外,盐沼湿地通常具有强烈的环境胁迫梯度,且其植被呈现带状分布,因此被生态学家认为是研究植被动态及其调控机制的理想系统[1,12]。早期观点一般认为,盐沼湿地植被动态主要受土壤盐分、水分等上行因子的调控[5,15]。然而,本世纪以来,日益丰富的研究表明,蟹类、螺类等植食性动物对盐沼湿地植物种群动态也具有重要的下行控制作用[6,16]。
在许多盐沼湿地中,草食动物等消费者的数量十分丰富,并能够通过取食植物组织对植物种群和群落动态产生下行控制作用[17-18]。这一观点已在国内外研究中得到广泛证实。例如,开展于北美等地区的研究发现,紫色相手蟹(Sesarmareticulatum)的取食作用可大幅降低盐沼湿地植物的密度和生物量,从而导致盐沼植被退化[16]。有关我国盐沼湿地中下行控制的研究近年来也逐渐增加。例如,Li等[19]通过野外实验表明蟹类对互花米草(Spartinaalterniflora)幼苗具有显著的抑制效应;He等[20]研究发现,干旱发生时,天津厚蟹(Helicetientsinensis)对盐地碱蓬(Suaedasalsa)的取食会加剧干旱触发的盐沼植被退化;张俪文等[21]通过野外调查揭示了天津厚蟹对芦苇(Phragmitesaustralis)的重度取食会显著降低芦苇幼苗的叶片数量。虽然这些研究都证实了下行因子是影响盐沼湿地植物的重要因素,但有关下行因子对盐沼湿地植物影响的空间变异及其驱动机制的研究仍较少。
黄河三角洲湿地是中国暖温带面积最大的新生盐沼湿地。芦苇是黄河三角洲湿地优势土著植物之一。在过去的40多年间,由于围垦等人类活动干扰,黄河三角洲自然芦苇湿地面积减少了近23%[22]。目前开展于黄河三角洲湿地芦苇退化的研究多关注水位、盐度等上行因子对芦苇种群动态的影响[23-24],而有关植食动物等下行因子对芦苇种群动态影响的研究则相对较少。天津厚蟹是黄河三角洲盐沼湿地中多度最高的植食动物之一[21]。本研究以黄河三角洲盐沼湿地芦苇和天津厚蟹为研究对象,在3个典型盐沼湿地中,通过开展野外植食性天津厚蟹去除实验并定期监测,以研究蟹类植食对芦苇种群动态的下行控制作用,并探究下行控制作用在不同盐沼湿地中的变异及机制。
1 材料及方法
1.1 研究区概况
研究区位于山东省东营市黄河三角洲国家级自然保护区内(37°35′N~38°12′N,118°33′E~119°21′E)。研究区年均降水量约为530~630 mm,年均蒸发量约为1 962~2 100 mm。降水多集中于植物生长活跃期(6~9月),但由于降雨年内分配不均,干旱、洪涝等极端气候灾害频发[23]。研究区潮汐属于不规则半日潮。黄河口为弱潮型河口,潮汐引起的水动力作用较弱,但潮汐会强烈影响土壤盐度和含水量[24]。本研究选择了3个典型的盐沼湿地:S1(37°46′N,119°10′E)、S2(37°45′N,119°12′E)、S3(37°47′N,119°16′E)(图1)。盐沼湿地S1一般不受潮汐影响,降雨是其主要淡水来源;盐沼湿地S2靠近与黄河河道连通的一条潮沟,且具有更高的潮汐频率;盐沼湿地S3同时受黄河淡水和潮汐的影响。在3个盐沼湿地中,芦苇均呈斑块状分布。由于干旱、台风的影响,盐地碱蓬在3个盐沼湿地中均退化严重,目前已非常稀少。在3个盐沼湿地中,天津厚蟹均是数量最为丰富的大型底栖动物,且野外观察并未发现其他植食性蟹类。天津厚蟹以植食性为主,强烈采食芦苇、盐地碱蓬等盐沼湿地植物[20-21]。
图1 黄河口盐沼湿地的实验地点Fig.1 Location of study sites in the Yellow River Delta salt marshes
1.2 野外蟹类去除实验
本研究于2018年6月初分别在盐沼湿地S1、S2、S3中选择了4、4、5个芦苇斑块(面积>10 m2)布设了8、8、14组成对的1 m×1 m的样方。盐沼湿地S1和S2中每个斑块有2组成对样方;S3依据于芦苇斑块面积大小,分别于每个斑块中设置2、3、4、3、2组成对样方。蟹类去除的样方是通过在样方四角埋下木桩,围上尼龙网(7 mm网眼),将尼龙网埋藏于土下30 cm处,并保持尼龙网的地上部分高出地面1 m。为了进一步去除蟹类,选择样方对角线的位置埋下2根PVC管(10 cm直径,20 cm深)作为陷阱,定期清除掉落于陷阱中的蟹类。对照组是在四角都埋下木桩,但不做任何围网处理。前期实验表明,用于去除蟹类的尼龙网本身并不影响芦苇的生长[19]。因此,本研究未布设程序对照处理。为研究蟹类对芦苇种群动态的调节作用,分别于2018/2019年生长季初/末对样方内所有芦苇存活植株进行计数(包括繁殖体和成体植株)。野外观察和前期研究表明,蟹类对芦苇繁殖体及成年植株的叶片均具有取食作用[21]。
本研究还于2019年生长季末监测了样方中的蟹洞密度。天津厚蟹是3个盐沼湿地中多度最高的蟹类,故利用蟹洞密度表征天津厚蟹的多度[25]。使用环刀采集土壤样品(5 cm深×5.05 cm直径)。鲜土样称重后在烘箱中60℃烘至恒重再称量,利用前后重量差除以恒重干土质量以计算土壤含水率。将干土粉末和去离子水按照1∶5混合,充分震荡后静置,并利用电导仪(EC3840,Jenco Electronics,USA)测量土壤盐度。盐沼湿地土壤含水量往往与潮汐等淹水频率正相关[24],可用于表征湿地淹水状况。此外,前期研究表明,土壤养分并不是调控黄河三角洲地区植物群落分布的关键环境因子[26],故本研究未测定土壤养分。
1.3 数据处理与分析
利用混合效应模型分析3个盐沼湿地中芦苇密度随时间和蟹类去除处理的变化,固定因素设置为时间和蟹类去除处理,随机因素设置为样方编号嵌套于对应的植被斑块编号。所有模型均满足残差正态检验(Shapiro.test)(P>0.05)。而后,利用效应量来衡量蟹类对芦苇密度的下行控制作用强度。效应量依据以下公式计算:lnRR=ln(XC/XE),其中:XC表示对照组芦苇密度;XE表示蟹类去除处理组芦苇密度。由于效应量不满足正态分布,且无法经过对数等常规转换满足正态分布,故效应量间的比较是通过非参数分析(Kruskal-Wallis test)完成。
利用结构方程模型(piecewiseSEM包)分析蟹类对芦苇密度的调节强度在不同盐沼中的变异机制,将土壤含水率设置为外生变量,将土壤盐度、蟹洞密度、芦苇密度等设置为内生变量。利用土壤含水率作为土壤盐度和蟹洞密度的解释变量,利用土壤含水率、盐度和蟹洞密度作为芦苇密度的解释变量。所有的统计分析均在3.6.0版本的R中完成。
2 结 果
2.1 天津厚蟹对芦苇密度的下行控制作用
在盐沼湿地S1中,蟹类对芦苇密度的影响不随调查时间变化(P=0.32),经2个生长季后,对照组芦苇密度有轻微下降(P=0.84),而蟹类去除处理组芦苇密度并未减少(图2(a))。在盐沼湿地S2中,蟹类对芦苇密度的影响受调查时间的强烈影响(P<0.000 1);经2个生长季后,对照组芦苇密度近乎保持不变,而蟹类去除组芦苇密度显著增长(P<0.000 1,图2(b))。在盐沼湿地S3中,蟹类对芦苇密度产生了显著影响(P=0.000 4),但其效应不受调查时间的影响(P=0.12);经2个生长季后,对照组和蟹类去除组的芦苇密度都显著增加(P<0.000 1,图2(c))。
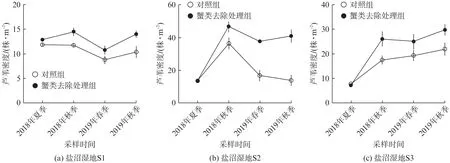
图2 盐沼湿地中蟹类对芦苇密度的影响随调查时间的变化Fig.2 Effects of crabs on the density of Phragmites australis among different salt marshes over time
2.2 不同盐沼湿地间的变异机制
经过2个生长季后,在盐沼湿地S1中,蟹类对芦苇密度的变化量(Δ芦苇密度)并未造成显著影响(P=0.53),而在盐沼湿地S2和S3中,蟹类的存在均造成了Δ芦苇密度显著减少(S2:P<0.000 1;S3:P=0.003 1;图3(a),见第420页)。效应量分析结果表明,蟹类对芦苇密度的影响在不同盐沼湿地间存在显著差异(χ2=7.41,df=2,P=0.025);蟹类对盐沼湿地S2中芦苇密度的抑制作用显著强于盐沼湿地S1和S3(图3(b),见第420页)。
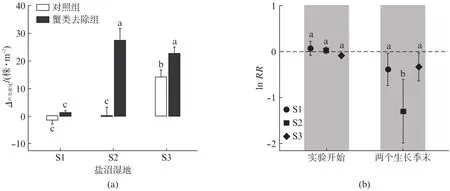
图3 蟹类对生长季内芦苇密度变化量的影响Fig.3 Effects of crabs on the change of Phragmites australis density during growing season
土壤盐度、含水率和蟹洞密度在3个盐沼湿地间均存在显著差异(表1,见第420页)。盐沼湿地S1的土壤盐度最高,分别是S3和S2的5、2.5倍;S3的土壤盐度最低,仅为S2的48.6%。相反,盐沼湿地S1的土壤含水率最低,不足S2和S3的50%;S3的含水率最高,且显著高于S2。对于蟹洞密度而言,盐沼湿地S1中平均为0.63个,S2和S3中平均分别为18.9、16.1个;盐沼湿地S2的蟹洞密度显著高于S3的。

表1 3个盐沼湿地土壤盐度、土壤含水率及蟹洞密度Tab.1 Soil salinity,soil water content,and crab burrow density among the three studied salt marshes
结构方程模型分析(图4(b))表明,芦苇密度主要受土壤盐度和蟹洞密度的直接影响(土壤盐度:β=-0.74;P=0.000 8。蟹洞密度:β=-0.43;P=0.000 6);相比于土壤盐度,蟹类对芦苇密度的作用强度较弱,其效应约为土壤盐度对芦苇密度作用强度的58%。土壤含水率对芦苇密度的直接作用不显著(β=0.12;P=0.54),但其与蟹洞密度正相关(β=0.35;P=0.000 3),与土壤盐度负相关(β=-0.85;P<0.000 1)。此外,土壤盐度对蟹洞密度不存在显著影响。

图4 上行因子和下行因子对芦苇密度影响的结构方程模型分析Fig.4 Structural equation models showing the effects of bottom-up force and top-down force on Phragmites australis density
3 讨 论
本研究表明,天津厚蟹是影响黄河三角洲盐沼湿地芦苇种群动态的重要下行因子之一,且其在3个盐沼湿地中均对芦苇的密度具有显著的影响(图2)。黄河三角洲盐沼湿地植食性蟹类对芦苇密度具有关键的抑制作用。一方面,这与开展于全球其他盐沼生态系统中的下行控制研究结果一致,即植食动物对植物种群动态具有显著的下行控制作用[11,16-17];另一方面,拓展了以往关注盐度、水分等上行因子对黄河三角洲盐沼湿地芦苇种群动态的研究方向[23-24,26-27]。尽管也有研究表明该盐沼湿地中植食性蟹类是调控植物种群动态的重要因素,但其主要关注盐地碱蓬等一年生草本植物[28]。蟹类等下行因子对多年生芦苇种群动态的影响还少有研究[29]。特别是,蟹类等下行因子在调控芦苇种群动态时的空间变异及驱动因素仍不明确,本研究填补了这一知识空缺。虽然蟹类相对于大型草食动物而言体型较小,但高密度的蟹类聚集也会造成芦苇种群大幅度衰退,因此其对盐沼湿地植被动态的下行控制作用不可忽视。也有研究表明,蟹类能够通过挖穴等改变微生境、涵养水源,这种生态系统工程式效应在某些环境条件下可促进盐地碱蓬的定植和生长[30-31]。本研究包括了水盐等环境条件迥异的3个盐沼湿地,且持续了两个植物生长季,但均未发现蟹类对芦苇密度具有净正效应。这说明,蟹类对黄河三角洲盐沼湿地芦苇种群动态的作用以负效应为主。
本研究的另一个重要发现是,植食性蟹类对芦苇密度的调控强度在3个盐沼中显著不同(图3)。结构方程模型分析表明,3个盐沼中土壤含水量的差异是造成蟹类对芦苇种群密度影响不同的重要驱动因子(图4)。在盐沼湿地中,土壤含水量的差异往往是潮汐等淹水频次的表征。在盐沼湿地S1中,由于土壤含水率低使得土壤硬度较高,蟹类难以挖洞使得其密度很低,从而造成在两个生长季后蟹类对芦苇密度变化的影响不显著[32]。在盐沼湿地S2中,蟹类显著减少了芦苇种群密度,且效应在3个盐沼湿地中最强。该盐沼湿地中土壤含水量高于S1,低于S3,但蟹类的密度最高。野外观察发现,该盐沼湿地中芦苇叶片被啃食的数量(平均值±标准误:12.13±1.41个/株)显著高于S1(1.75±0.68个/株)和S3(4.79±0.45个/株),故蟹类的高密度聚集是造成盐沼湿地S2中芦苇种群密度下降的主要原因[33]。在盐沼湿地S3中,蟹类对芦苇密度也具有抑制作用,但其作用强度弱于盐沼湿地S2;一方面可能是由于盐沼湿地S3中蟹类密度低于S2,另一方面可能是由于良好的水盐条件能够补偿蟹类在生长季对芦苇密度的抑制作用[34]。实际上,在其他生态系统中,下行因子对植被动态变化的调控作用也往往存在空间变异。例如,森林中的植食性哺乳动物对植物幼苗的抑制作用可随降雨量的变化而变化[35]。尽管本研究表明土壤含水量是影响蟹类对芦苇种群密度控制作用的重要环境因子,但仍需通过控制实验作进一步验证;同样,潮汐对蟹类下行效应的影响也需开展进一步的控制实验研究。此外,天津厚蟹的体型大小是否影响其对植物种群动态的下行调控作用也仍需进一步研究。
盐沼湿地具有蟹类等植食动物多度高、水盐胁迫变异大等特点,这使该生态系统中植被动态往往受到多重生物和非生物因素的调节[1,12]。本研究强调了蟹类等下行因子在影响芦苇种群动态中的重要性。本研究的主要科学发现对于盐沼湿地的恢复也具有借鉴意义,说明在对盐沼湿地植被进行保护修复时也需关注蟹类等的下行控制作用。这一观点在其他地区盐沼的恢复研究中也正在得到日益丰富的佐证。例如,开展于美国东南部盐沼的研究表明,玉蜀螺(Littorariairrorata)和紫色相手蟹等会抑制干旱后退化盐沼植被的恢复[33];在我国长江口崇明东滩去除入侵植物互花米草(Spartinaalterniflora)后盐沼恢复过程中,蟹类是阻碍其本土植物海三棱藨草(Scirpusmariqueter)恢复的重要影响因子[36]。进一步深入理解动物植食等下行因子的作用及变异机制有助于保护和修复退化盐沼及其生态系统功能。
