分泌PD-1单链抗体的MesoCAR-T细胞治疗非小细胞肺癌的体内外研究
2022-08-30杨金龙陆盼盼王亚楠杨辛毅姜正涛潘晗雨沈晓婷粱智铭朱焕章
赵 琳,王 菁,杨金龙,陆盼盼,王亚楠,杨辛毅,姜正涛,潘晗雨,沈晓婷,粱智铭,朱焕章
(1.复旦大学 生命科学学院,上海 200438;2.复旦大学遗传工程国家重点实验室,上海 200438)
根据2020年全球癌症统计报告最新数据显示,肺癌在36种常见癌症中死亡率高居第一,发病率高居第二[1],5年总生存率仅为21%[2]。非小细胞肺癌(Non-Small-Cell Lung Cancer,NSCLC)是肺癌的主要类型,占肺癌病例的76%[3]。对于NSCLC的治疗手段,其中包括手术、化疗和放疗,都未能达到预期的效果,因此亟需更有效的治疗方法。近年来,免疫检查点阻断已成为包括NSCLC等许多实体瘤的常规治疗方法[4]。越来越多的证据表明,免疫检查点抑制剂(Immune Checkpoint Inhibitor,ICI)治疗NSCLC是一种很有前景的选择[5]。目前,美国食品和药物管理局(FDA)批准的3种癌症ICI药物用于治疗NSCLC,其平均客观反应率为20%[6]。这些药物最初用于二线NSCLC转移瘤治疗方案[7-9]。现在其作用已扩展到一线转移瘤的治疗方案[10]。在肿瘤免疫治疗中,与免疫检查点疗法一起迅速发展的另一种疗法是嵌合抗原受体T细胞(Chimeric Antigen Receptor T cell,CAR-T)疗法。除了奇迹般地从急性白血病中幸存下来的Emily,还有两名慢性白血病患者被CAR-T疗法治愈[11-12]。然而,CAR-T在具有更复杂肿瘤微环境(Tumor Microenvironment,TME)的实体肿瘤中前景并不乐观[13]。抗原刺激的T细胞的活化伴随着程序性细胞死亡蛋白-1(PD-1)表达的上调。而在炎性肿瘤环境中,肿瘤细胞也有PD-L1上调的反应机制,与PD-1结合导致免疫逃逸[14]。PD-1检查点阻断和CAR-T细胞疗法分别显示出很有前景的疗效,并已被FDA批准用于治疗血液病[15]。许多研究人员已经考虑将CAR-T细胞治疗与PD-1检查点阻断治疗相结合,试图攻克实体肿瘤。PD-1/PD-L1免疫检查点抑制剂与CART细胞结合的策略已被广泛应用[16-18]。然而,这种策略可能导致副作用,如全身毒性[18]。在一种更安全的方法中,CAR-T细胞靶向肿瘤细胞并分泌PD-1/PD-L1 scFv,这增强了PD-1/PD-L1 scFv的特异性和CAR-T细胞在TME中的持久性[19-20]。本研究为了缓解PD-1/PD-L1对CAR-T的抑制作用,设计构建了靶向间皮素(MSLN)并分泌PD-1 scFv E27的E27-MesoCAR-T细胞,并探究其抗肿瘤作用。
1 材料与方法
1.1 材料与动物
细胞系HEK293-17购自中国科学院细胞库。过表达萤光素酶和人间皮素的NSCLC细胞株A549-ML之前由本实验室构建并进行冻存[21]。通过慢病毒感染A549-ML细胞构建过表达PD-L1的细胞系A549-MPL。它们都培养于DMEM完全培养基中。
免疫缺陷雌性NSG小鼠购自上海南模生物公司,并在无特定病原体(Specific Pathogen-Free,SPF)条件下生存。所有动物体内实验皆通过动物伦理委员会的批准而进行。
1.2 CAR慢病毒载体构建
PD-1 scFv的序列借鉴了文献[22],将原有的小鼠Ig K分泌信号调整为人IgG分泌信号后由金唯智公司合成。MesoCAR的结构是由细胞外结构域(CD8 leader,anti-MSLN scFv P4和CD8 hinge)、CD8跨膜结构域和细胞内结构域(4-1BB共刺激结构域和CD3ζ)组成的,序列同样由金唯智公司合成。两部分用T2A连接子连接后,再克隆到慢病毒载体p TRPE中。
1.3 CAR-T细胞的制备
首先从长海医院采集健康献血者的血液样本,然后按照伦理和安全标准使用。采用密度梯度离心法纯化外周血单个核细胞(Peripheral Blood Mononuclear Cells,PBMCs),并通过Pan T细胞纯化试剂盒(MiltenyiBiotec)从PBMCs中分离得到CD3+T细胞,培养于含5%胎牛血清(Gibco)、人IL-2和IL-15(R&D)的X-VIVO15(Lonza)培养基中,用CD3/CD28偶联微珠(Thermo Fisher)激活。将CAR载体、p MD2.G和pSPAX2三质粒转染HEK293-17细胞制备慢病毒。CD3+T细胞活化48 h后,上述慢病毒感染过夜。感染后,T细胞体外培养扩增12天,通过流式细胞术检测CAR+T细胞比例。
1.4 CAR-T细胞毒性、细胞因子释放和增殖试验
CAR-T细胞和A549-MPL细胞效靶比NCAR-T/NA549-MPL分别为1∶1、5∶1和10∶1,共孵育6 h后,释放的乳酸脱氢酶(Lactate Dehydrogenase,LDH)含量作为检测CAR-T细胞特异性细胞毒性的指标。共培养24 h的上清通过酶联免疫吸附法(Enzyme-Linked Immunosorbent Assay,ELISA)定量细胞因子的释放。
在增殖实验中,经过长时间A549-MPL细胞的刺激后,CAR-T细胞以5×10/3孔的密度加入96孔板中。在48 h和72 h两个时间点,加入CCK-8溶液(Dojindo),孵育4 h后检测光密度(Optical density,OD)值。
1.5 流式细胞术
在本研究中,通过流式细胞术检测一些细胞表面分子的表达。具体操作为,与抗体共孵育15 min后,收集细胞并洗涤两次,然后用流式细胞仪(Beckman)收集细胞数据。
本研究中使用的抗体包括FITC标记的人间皮素蛋白(Acro BioSystems)、PE标记的小鼠抗人CD279单克隆抗体(BD)、PE标记的小鼠抗人CD274单克隆抗体(BD)、生物素标记的抗人间皮素单克隆抗体(Bio Legend)、APC标记的链霉亲和素(BD)等流式抗体。
1.6 Western blot
质粒转染HEK293-17细胞后,收集1×106细胞并离心。分离细胞沉淀和上清,分别作为E27表达和分泌的Western blot检测样品。上清液和全细胞裂解液加载到SDS-聚丙烯酰胺凝胶上电泳分离,然后转移到PVDF膜上。E27条带通过兔抗HA一抗(CST)和羊抗兔IgG二抗(TransGen)标记。β-actin条带通过小鼠抗人β-actin一抗(TransGen)和山羊抗小鼠IgG二抗(TransGen)标记。
1.7 NSCLC CDX小鼠模型的建立及CAR-T细胞的体内抗肿瘤活性探究
采用A549-MPL细胞建立NSCLC CDX小鼠模型。按照5×10/6鼠的量计算所需A549-MPL细胞总数,用PBS进行3~4次清洗,最终用PBS按照5×10/6(100μL·鼠)的细胞密度重悬,注射到6周的雌性NSG小鼠皮下。7天后,腹腔注射麻醉剂(1%戊巴比妥钠的使用剂量为50 mg/kg),待5~10 min后麻醉剂起效,尾静脉输入体内用Luciferase底物(Promega);3 min后用化学发光成像系统(IndiGO)拍照,曝光时间120 s,将图像背景值调为6 500 cps,观察每只小鼠的成瘤情况。小鼠随机分为Mock组、MesoCAR组和E27-MesoCAR组(n=5)。每7天进行一次活体成像,监测小鼠肿瘤的生长情况。
1.8 肿瘤的称重和抑瘤率的计算
从死亡的对照组和实验小鼠身上取出肿瘤组织,并用电子天平称重。肿瘤抑制率η=(m对照组-m实验组)/m对照组×100%,其中m对照组为对照组肿瘤平均重量,m实验组为实验组肿瘤平均重量。
1.9 免疫组化(Immunohistochemistry,IHC)
小鼠皮下剥离的完整肿瘤组织块,切取中间截面制作石蜡切片,进行免疫组化染色,详细方法见参考文献[21]的材料方法部分。
2 结 果
2.1 过表达PD-L1肺癌细胞系的构建
以本实验室构建好的过表达间皮素的A549-ML细胞系为对象,设计并构建含PD-L1(CD274)和筛选标记的慢病毒载体(图1(a)),制备病毒并感染上述MSLN+的A549-ML细胞,用潮霉素筛选一段时间,待细胞可以在较高浓度潮霉素培养条件下稳定生长,流式细胞仪检测其PD-L1的表达情况,撤掉潮霉素,大规模扩增冻存,获得A549-MSLN-PD-L1(A549-MPL)细胞系。结果表明MSLN和PD-L1表达都在90%以上(图1(b)、图1(c)),可以作为靶细胞用于下游实验。并且在底物存在的情况下,A549-MPL可以催化底物产生化学发光(图1(d)),使实时报告动物体内肿瘤生长情况成为可能。

图1 过表达PD-L1肺癌细胞系的构建Fig.1 Construction of PD-L1-overexpressed NSCLC cell line
2.2 分泌型PD-1单链抗体E27的设计、构建以及验证
我们从免疫原性、分泌效率方面对分泌信号进行优化,分别选择了鼠IgKSS、人IL-2SS和人IgGSS 3种常用的分泌信号串联在PD-1单链抗体E27和HA标签的前面,构建到慢病毒载体骨架p TRPE上(图2(a),见第408页)。3种分泌信号的序列从NCBI官网获得,分别为:(1)Ig KSS(ATGGAGACAGACACACTCCTGCTATGGGTACTGCTGCTCTGGGTTCCAGGTTCCACTGGTGAC);(2)IL-2SS(ATGTACAGGATGCAACTCCTGTCTTGCATTGCACTAAGTCTTGCACTTGTCACAAACAGT);(3)IgGSS:ATGGGCTGGAGCTGCATCATCCTGTTCCTGGTGGCAACCGCAACCGGAGTGCACAGC。
经过EcoRV单酶切位点酶切和NcoⅠ三酶切位点酶切验证载体并进一步测序,将序列正确的重组质粒标记为IgGSS-E27、IL-2SS-E27和Ig KSS-E27,并进行保种。
将3种质粒分别瞬转HEK293-17细胞,收集48 h胞内总蛋白和培养基上清,通过抗HA标签的抗体进行Western blot检测E27的表达和分泌(图2(b));并且在转染质粒质量、细胞起始数量、培养体系相同和上样量相同的情况下,可通过条带显色情况判断3种分泌信号的分泌效率。由图可以看出,3种分泌信号都可以成功地表达并分泌E27,根据条带OD值可以分辨出IgGSS-E27载体的分泌效率稍有优势,且是人源序列,不会引起潜在的免疫反应,因此我们选择IgGSS-E27序列进行下游载体的构建。

图2 分泌型PD-1单链抗体E27的慢病毒载体示意图和E27的分泌Fig.2 Schematic diagram of E27 lentiviral vector and secretion of E27
2.3 E27-MesoCAR慢病毒载体的构建与慢病毒制备
首先构建MesoCAR,将CD8 leader、P4 scFv、CD8 hinge、CD8TM、4-1BB以及CD3ζ克隆到p TRPEGFP-T2A-m RFP上(图3(a))。然后根据前期的优化构建带有分泌型PD-1单链抗体元件的新型MesoCAR,将MesoCAR序列用T2A重组到Ig GSS-E27上,即p TRPE-MesoCAR-T2A-E27,简称为E27-MesoCAR(图3(b))。以MesoCAR和E27-MesoCAR质粒作为目的载体,利用三质粒慢病毒包装体系制备慢病毒,抽提病毒基因组,在WPRE区域设计引物,qPCR检测病毒单位体积的颗粒数。
用已知浓度的MesoCAR大提质粒作为标准品拟定标准曲线(图3(c)),MesoCAR病毒的循环数阈值(Cycle Threshold,CT)为22,E27-MesoCAR病毒的CT值为22.92,代入回归方程Y=-3.19X+37.08(R2=0.999 9),将得到的单位体积所含有的病毒颗粒数(N病毒)换算为滴度,分别为5.01×107/m L和2.75×107/m L。

图3 CAR慢病毒载体示意图及病毒滴度检测Fig.3 Schematic diagram of CAR lentiviral vector and detection of virus titer
2.4 E27-MesoCAR-T细胞的制备及E27的表达
从血站获取的健康人外周血中分离出外周血单个核细胞后,分选得到CD3+T细胞,CD3/CD28 Beads活化48 h后,用制备好的慢病毒感染T细胞(感染复数为15),制备CAR-T效应细胞。将慢病毒感染并培养扩增12 d后的CAR-T细胞作为检测对象,对其CAR受体的表达以及E27的分泌情况进行了测定。以人源间皮素重组蛋白作为抗体标记CAR阳性T细胞,流式细胞仪检测结果显示MesoCAR和E27-MesoCAR阳性率都在50%以上(图4(a))。以收集细胞培养基离心后得到的上清为样品,免疫印迹结果表明E27在原代T细胞中也能够成功地表达并且分泌到胞外(图4(b))。

图4 CAR-T细胞的CAR阳性率以及E27的表达Fig.4 Proportion of CAR-T cells and expression of E27
2.5 E27-MesoCAR-T细胞的体外杀伤功能及细胞因子分泌
在scFv识别到肿瘤相关抗原后,CAR-T细胞将分泌细胞因子并脱颗粒。将Mock T、MesoCAR-T和E27-MesoCAR-T细胞与A549-MPL细胞共孵育,以CD107α、激活表面分子标志物CD25/CD69以及IL-2、TNF-α和IFN-γ等细胞因子作为指标,验证其体外杀伤功能。再通过共孵育前后肿瘤细胞含量的变化以及实验组和对照组之间死细胞释放的LDH含量的比较,观察CAR-T细胞杀伤效率。使CAR-T∶A549-MPL=2∶1,混合均匀并共同培养,24 h后收集混合细胞并分为3份分别进行CD25/CD69、CD107α表达以及两种细胞组成比例变化的流式细胞仪检测。实验结果(图5,见第410页)显示,实验组CD25表达上调(图5(a)),说明CART细胞被特异性激活。实验组特异性表达CD107α(图5(b)),说明CAR-T细胞进行了脱颗粒。图5(c)流式细胞仪结果显示,实验组肿瘤细胞比例降低、T细胞比例升高,说明CAR-T细胞特异性杀死了肿瘤细胞。
按照1∶1、5∶1和10∶1的比例,将CAR-T细胞和A549-MPL细胞共孵育。6 h后吸取50μL上清,检测释放的LDH与显色试剂作用下的吸光值。结果如图5(d)所示,随着效靶比例的逐渐增加,CAR-T细胞裂解肿瘤细胞越来越充分,最高可达到60%,MesoCAR与Mock以及E27-MesoCAR与Mock之间都存在显著性差异(P<0.01)。以效靶比为10∶1共孵育,24 h培养后收集细胞培养液检测IL-2、TNF-α和IFN-γ3种细胞因子释放,图5(e)的ELISA结果显示CAR-T细胞培养基所含3种细胞因子的浓度从300~6 000 pg/m L不等,但均显著高于对照组(P<0.01),说明CAR-T细胞可以针对肿瘤细胞特异性大量分泌IL-2、TNF-α和IFN-γ等细胞因子。

图5 CAR-T细胞在体外对A549-MPL的特异性杀伤Fig.5 Specific lysis of CAR-T cells against A549-MPL in vitro
2.6 分泌型PD-1单链抗体E27增强CAR-T细胞增殖活性
CAR-T细胞在肿瘤表面抗原的反复刺激下会呈现出耗竭的状态,主要表现为PD-1等免疫检查点分子表达上调,T细胞活性与增殖能力下降,导致CAR-T细胞逐渐失去杀伤肿瘤细胞的能力。为了模拟浸润瘤体的CAR-T细胞反复被抗原刺激的状态,将CAR-T和A549-MPL细胞共孵育,在48 h和72 h两个时间点用CCK-8试剂盒检测MesoCAR-T和E27-MesoCAR-T细胞的活力和增殖能力。第0天时,取等量CAR-T细胞,一组不做处理单独培养即A549-MPL(-)组,一组与A549-MPL细胞共培养即A549-MPL(+)组。MesoCAR-T细胞在48 h时,共同孵育组T细胞数量略微领先于未处理组,但在72 h时共同孵育组T细胞数量已经落后于未处理组(图6(a)左)。E27-MesoCAR-T细胞在48 h和72 h时,共同孵育组T细胞数量明显多于未处理组(图6(b)左),猜测是在肿瘤相关抗原刺激下CAR-T细胞扩增效率提高。我们又比较了两个时间点OD值的改变倍数,相较于MesoCAR-T细胞,A549-MPL(-)组和A549-MPL(+)组之间存在显著性差异(图6(a)右),E27-MesoCAR-T细胞两组之间无明显差异(图6(b)右),表明在PD-L1+的A549-MPL反复刺激下,MesoCAR-T细胞增殖受到明显抑制(P<0.01),而E27-MesoCAR-T细胞分泌的E27缓解了这种抑制。流式细胞仪检测经过肿瘤细胞共孵育后的CAR-T细胞表面PD-1表达(图6(c))和凋亡(图6(d))情况,MesoCAR组44.0%的T细胞检测到PD-1的表达,且34.4%的细胞处于早期凋亡状态;E27-MesoCAR组检测到不足8.5%的PD-1表达和细胞凋亡。
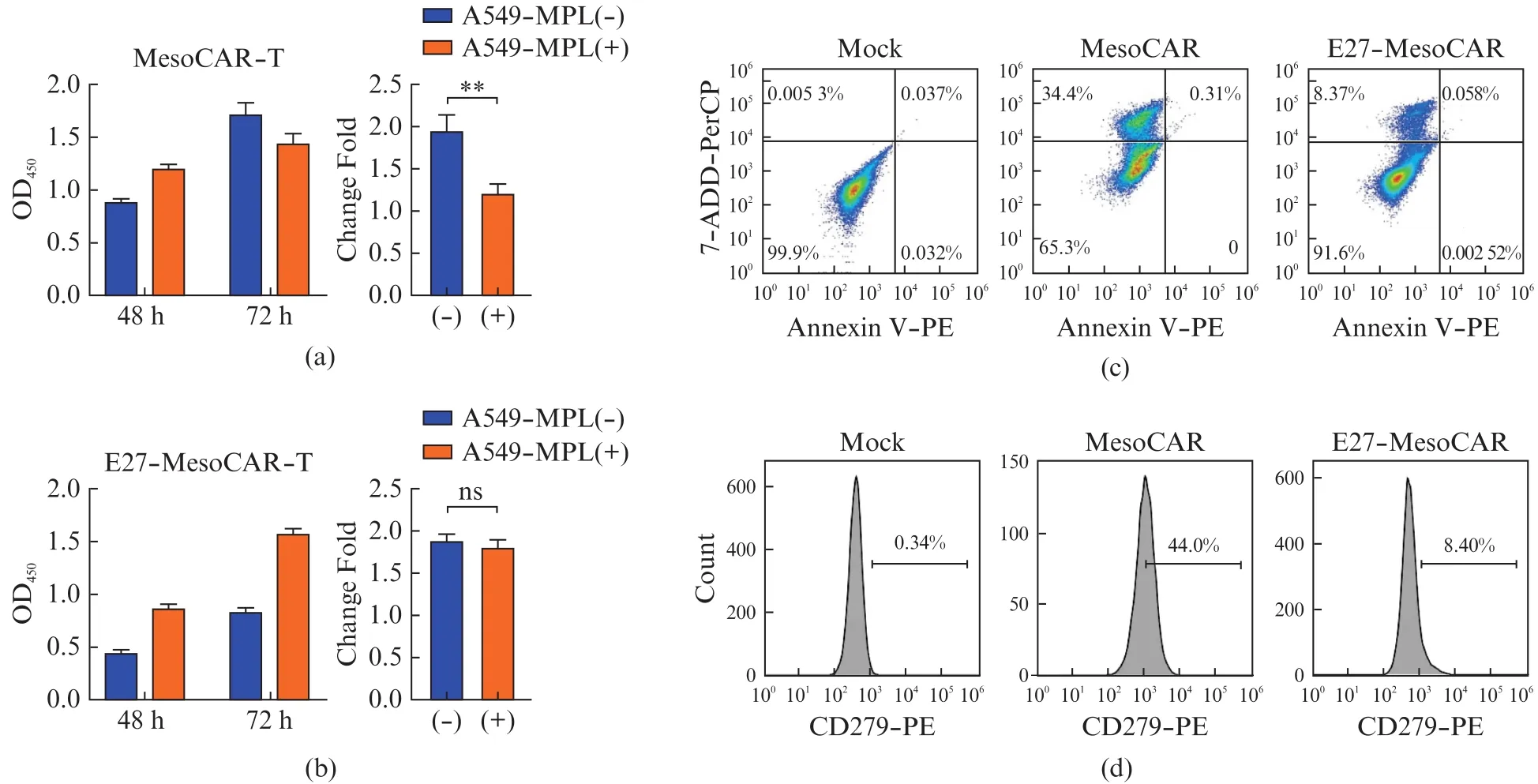
图6 E27可以增加MesoCAR-T经过抗原反复刺激后的增殖能力Fig.6 E27 enhances the proliferation of MesoCAR-T cells after repetitive antigen stimulation
2.7 NSG小鼠体内E27-MesoCAR-T细胞的抗肿瘤作用
2.7.1 E27-MesoCAR-T细胞的抗肿瘤作用
基于观察到的在体外E27的分泌对于MesoCAR-T细胞耗竭的阻断作用,我们继续在人非小细胞肺癌细胞系A549-MPL的动物模型中评估E27-MesoCAR-T细胞的优越性。首先于第0天在每只NSG小鼠皮下种植5×106个A549-MPL细胞,第7天通过尾静脉静脉注射第一轮对照组、MesoCAR-T组和E27-MesoCAR-T组细胞,每组5只小鼠,每只每轮注射1×107个细胞;第14天通过尾静脉注射第2轮细胞。尾静脉注射萤光素酶底物,每周检测一次A549-MPL细胞系的化学发光,通过活体成像监控小鼠肿瘤生长情况(图7(a),见第412页)。结果如图7(b)(见第 412页)所示,在第28天E27-MesoCAR组有1只小鼠活体成像未检测到荧光,1只小鼠荧光值仍处于24 000 cps以下,而实验组和对照组的其他小鼠荧光值均过曝(最大荧光值超过65 535 cps),对照组甚至出现因为肿瘤过大肿瘤局部坏死的情况(Mock组左数第2只小鼠背部呈现黑色的位置);我们利用Image J软件统计了荧光面积,结果显示E27-MesoCAR组和MesoCAR组与对照组肿瘤大小存在明显差异(P<0.01),同时E27-MesoCAR组和MesoCAR组肿瘤大小也存在差异(P<0.05)(图7(c),见第412页)。第33天,待各组小鼠死后解剖取出皮下肿瘤,肿瘤实物图如图7(d)(见第 412页)所示;称量肿瘤重量,可以观察到MesoCAR组和E27-MesoCAR组肿瘤重量较Mock组显著性缩小(P<0.01),抑瘤率分别为89.1%和97.4%(图7(e),见第412页)。

图7 体内E27-MesoCAR-T细胞的抗肿瘤作用Fig.7 Antitumor effect of E27-MesoCAR-T cells in vivo
2.7.2 PD-1阻断型单链抗体E27增强MesoCAR-T细胞体内的增殖和持久性
为了观察T细胞在体内的增殖情况,在第31天,通过小鼠眼眶静脉采血,流式细胞仪检测外周血中人CD3+T细胞的含量。结果显示,E27-MesoCAR组小鼠外周血中人CD3+T细胞含量为27.3%,显著性高于其他两组(P<0.01)(图8(a))。随机选择1只Mock组、1只MesoCAR组和1只E27-MesoCAR组小鼠皮下剥离的肿瘤组织,进行ICH染色,染色指标为人CD3,选择代表性视野分别放大10倍和40倍观察(图8(b))。随机选择3个40×视野,计数肿瘤组织内部T细胞的数量(图8(c))。结果显示,E27-MesoCAR组肿瘤组织内T细胞数量显著性多于MesoCAR组(P<0.01),与E27抗体在体外可以阻断肿瘤细胞长时间接触导致的T细胞耗竭,增强其增殖能力以及持久性的结果相一致。
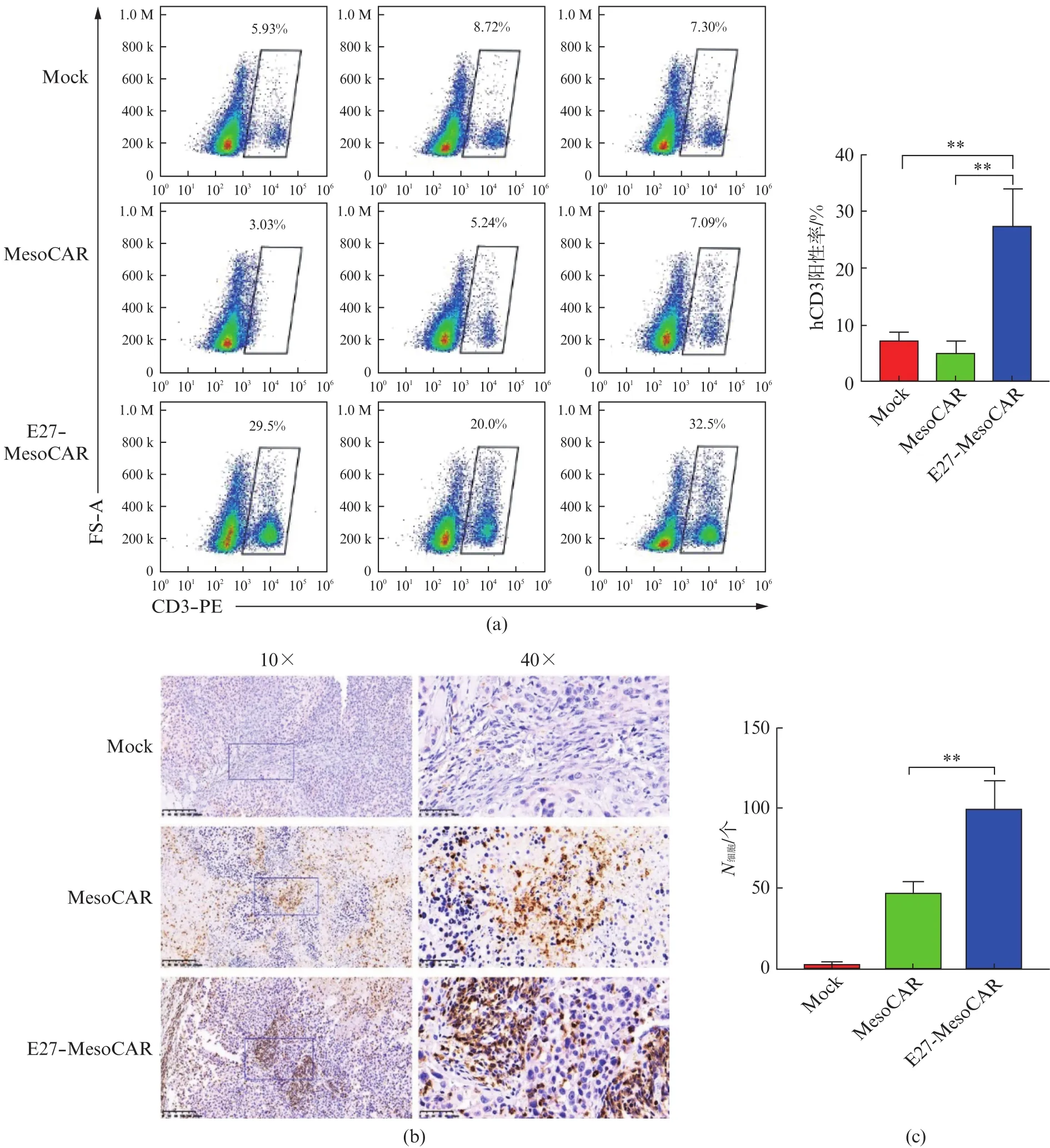
图8 PD-1单链抗体E27增强MesoCAR-T细胞体内的增殖和持久性Fig.8 E27 enhances the proliferation and persistence of MesoCAR-T cells in vivo
3 讨 论
本文针对TME导致的免疫抑制问题,提出了联合PD-1阻断和CAR-T细胞治疗的解决思路,对安全性和有效性做出了优化。
首先,在分泌型PD-1单抗联用MesoCAR-T细胞治疗非小细胞肺癌方面完成了全部序列人源化的设计。CAR-T临床试验的主要安全性问题为脱靶毒性和细胞因子风暴,但NSG小鼠由于较为严重的免疫缺陷以及与人种属差异的存在,对于CAR-T安全性的准确评估并不是合适的模型,相比较而言临床数据更具有参考价值和意义。间皮素在肺癌患者中的表达频率为60%~65%[23],已经在美国临床试验网站注册的23项试验中有12项的适应症包含肺癌[24]。并且已经公开的相关数据和结果显示,除了由于鼠免疫原性的间皮素单链抗体引起的急性过敏反应[25]和宿主对抗体以及T细胞的免疫反应导致回输的CAR-T持续时间较短疗效不佳[26]之外,未出现细胞因子释放综合征或神经毒性等症状,因此我们认为间皮素是CAR-T治疗肺癌患者的一个安全有效的靶点。我们通过查阅大量文献和专利,从序列种属来源和PD-1阻断方式角度优化CAR载体。靶向间皮素的人源化单链抗体序列,这里我们参考了专利WO2013063419A1中的P4单抗序列,其构成的抗间皮素CAR-T细胞在小鼠实验中疗效显著[27]。现阶段PD-1免疫检查点疗法和CAR-T疗法的联合治疗临床试验共有17例,其中适应症为实体瘤的有11例[28]。联合方式主要有3种:PD-1阻断剂药物、CAR-T细胞PD-1表达的干扰和CAR-T细胞分泌PD-1抗体。考虑到分泌型抗体具有更强的靶向性可以避免系统给药带来的副作用,相较于单纯的部分回输T细胞PD-1表达干扰,分泌型抗体在自分泌封闭自身T细胞的同时也可以通过旁分泌的方式封闭肿瘤区域的其他免疫细胞,我们参考了专利US20180127502A1中的E27单抗序列,该单抗与抗原结合能力较强且在上清液中稳定性极高[29],并且在保证分泌效率的情况下我们将分泌信号序列从原来的鼠源替换成了人源IgGSS序列。
其次,证明了在免疫抑制性的实体瘤微环境中,通过增强CAR-T细胞的增殖活性和抗凋亡能力,E27-MesoCAR-T在体内外得到了更好的抗肿瘤效果,Hu等[30]在敲除PD-1以增强靶向间皮素CAR-T效应功能的研究过程中也得到了相同的结论。
而在阻断PD-1抗体的结构设计上,本文选择了以scFv的形式分泌到胞外。考虑到scFv的稳定性较差、亲和力较弱等特征,一种通过增加抗体结合价并引入Fc片段的结构设计能否带来更显著的治疗优势值得进一步验证,如IgG4型单克隆抗体结构[31]。另一方面,在肺癌小鼠模型的建立中依然存在改进完善的空间。本文选择了高表达MSLN和PD-L1非小细胞肺癌A549细胞系作为靶细胞,在NSG小鼠背部皮下进行了移植。由于移植位置不属于重要组织器官,也不影响小鼠正常活动,所以即使瘤体最大长度达到1.5 cm小鼠也不会因为荷瘤负担过大而死,但达到动物实验伦理的处死规定,因此不能采集到生存曲线的数据,肺部原位移植不失为一个更为合理的小鼠模型[20]。而对于不同的患者肿瘤样本来说,MSLN和PD-L1的阳性率都达到90%以上的情况是极少数的,在我们构建的细胞模型中分泌型PD-1单抗的MesoCAR-T细胞展现出显著的治疗优势,但在患者体内能否维持,还需要通过病人来源肿瘤异种移植的小鼠进一步探讨。
