有氧运动对高脂膳食小鼠心肌损伤中Nrf2/GPX4/Ferroptosis通路的作用*
2022-08-29王海涛杨雯茜刘玉倩
王海涛, 杨雯茜, 刘玉倩△
(1. 岭南师范学院运动与健康研究所, 广东 湛江 524048; 2. 岭南师范学院体育科学学院, 广东 湛江 524048;3. 华南师范大学体育科学学院, 广东 广州 510631)
铁在氧的转运和储存及线粒体有氧氧化中发挥重要作用,机体铁代谢和氧稳态相互关联。心脏是机体耗氧量较大的器官,线粒体大约占心肌细胞体积的30%。因此,维持线粒体结构与功能正常和机体铁的动态平衡是保持心功能正常的基础。最近研究表明过量铁引发的铁死亡(ferroptosis)与心脏功能障碍密切相关。Ferroptosis是一种铁依赖性的新型细胞死亡方式,通过细胞膜脂质过氧化损伤杀伤细胞[1]。游离铁在线粒体中积累,通过Fenton反应,导致活性氧(ROS)的产生和脂质过氧化损伤。而通过线粒体靶向抗氧化剂可改善心肌病症状,进一步表明过量铁引发的线粒体氧化损伤是心脏病的主要机制,有效预防心肌细胞ferroptosis是防治心脏疾病的重要靶点[2]。Ferroptosis导致心功能障碍、线粒体结构异常和线粒体动力学受损,其调控机制有待深入研究[3]。谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)可有效抑制ferroptosis,保护线粒体和心肌细胞免受过氧化损伤[4,5]。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2, Nrf2)可转位入核激活GPX4表达[6]。前期实验证明运动可促进Nrf2表达[7]。在临床实践中充分证实通过有氧运动可改善心肌功能[8]。但运动对Nrf2/GPX4/Ferroptosis的影响尚缺少相关研究。由于糖尿病性心脏病发病率高,且是糖尿病患者致死的主要原因之一[9]。实验通过高脂喂养小鼠造成2型糖尿病(type 2 diabetes mellitus,T2DM)动物模型,在高脂膳食同时进行有氧运动,探讨运动在改善高脂膳食诱发的心脏过氧化损伤中Nrf2/GPX4/Ferroptosis通路的作用机制,为运动在预防心肌损伤的临床应用提供实验证据。
1 材料与方法
1.1 实验动物及分组
40只5周龄SPF 级C57BL/6雄性小鼠 (广东省医学实验动物中心,许可证号:SCXK(粤)2018-0002),体重(18±2)g,SPF级动物房内饲养和运动干预。自然光照,自由饮水,饲养温度20℃~25℃,湿度50%~70%。基础饲料购自广东省医学实验动物中心。随机分为安静对照组(normal control group,NC,每日基础饲料喂养AIN-93G,不运动)、跑台运动组(normal treadmill exercise, NE,基础饲料AIN-93G,)、安静高脂组(high-fat diet control group, HC, 60% Kcal SPF级高脂模型饲料,南通特洛菲,自由进食)和高脂+跑台运动组(high-fat diet and received the increasing load running on the treadmill, HE,高脂与跑台运动同时开始),每组10只。小鼠跑台(广州飞迪生物科技有限公司)进行跑台运动干预。适应期1周,每周3 d,10~20 min/d,坡度为0,10~13 m/min。正式运动训练为期14周,采用中等强度(75%左右最大摄氧量)跑台运动干预。每周5 d,60 min/d,坡度为0,第1~2周速度为13 m/min,每两周速度递增1 m/min,第13~14周19 m/min[10]。所有动物运动干预前均无跑台运动史。末次运动后12 h取材,摘眼球取血,取左心室心肌,投入0.4% 多聚甲醛以备组织学观察。其余心脏部分用0.9% NaCl清洗后滤纸吸去水分,投入液氮, -80℃储存。
1.2 试剂盒和抗体
试剂盒:小鼠血清胰岛素ELISA试剂盒(insulin,FINS,CUSABIO),心肌线粒体分离试剂盒(Beyotime),浆蛋白和核蛋白提取试剂盒(Beyotime),8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanosine,8-OHdG)和4-羟基壬烯醛(4-hydroxynonenal,4-HNE)ELISA试剂盒(上海生工),组织铁试剂盒(南京建成)。
抗体及来源:GPX4(Abcam,ab125066)、铁蛋白重链(ferritin heavy chain 1,FTH1,ABclonal, A1144)、葡萄糖转运蛋白1( glucose transporter 1,GLUT1,Abcam,ab115730)、Nrf2(Abcam,ab137550)、膜铁转运蛋白(Ferroportin1,FPN1,ABclonal,A14884)、 羊抗兔IgG/HRP(二抗,YJ0189艺佳生物)、羊抗小鼠IgG/HRP(二抗,YJ0188艺佳生物)、GAPDH 兔多克隆抗体(内参,YJ0200艺佳生物)。
1.3 仪器
罗氏血糖计,高速离心机(Eppendorf),超声细胞破碎仪(宁波唯诚超声波设备科技有限公司,USAC-1200),Synergy H4多功能酶标仪(Thermo scientific),Leica切片机(RM 2135),电泳和转膜系统(Bio-rad),Olympus显微镜。
1.4 血液糖代谢指标测定
纯化的小鼠抗-胰岛素抗体包被微孔板,将取材的血清点到96孔板中,将胰岛素标准品稀释成梯度,依次加入反应药品,Synergy H4多功能酶标仪450 nm读取OD值,根据标准品,做标准曲线和计算公式,计算胰岛素含量。胰岛素敏感指数(insulin sensitivity index,ISI)=ln[1/(FBG×FINS)]。
1.5 心肌线粒体提取和细胞核蛋白分离
采用差速离心法分离心肌线粒体。心肌匀浆后,600 g离心5 min。取上清液11 000 g 离心 10 min。沉淀即为分离的线粒体[11]。采用浆蛋白和核蛋白提取试剂盒提取细胞核蛋白:分别加入细胞浆蛋白抽提试剂A和B并剧烈震荡后,12 000 g离心5 min,取上清为浆蛋白。沉淀加入细胞核蛋白抽提试剂,剧烈震荡后,12 000 g离心10 min,得到核蛋白,分装待测。
1.6 心肌铁含量和氧化损伤标志物测试方法
取约80~100 mg心肌组织,加入9倍冷NaCl,通过机械均浆(每次10 s,4次)和冰水浴超声粉碎(400 A,每次5 s,6次)制作10%心肌匀浆,离心取上清,分装于离心管。按组织铁试剂盒操作,测OD值。心肌线粒体8-OhdG和4-HNE采用ELISA,6个的标准孔依次点入不同浓度的标准品,加样后37℃,孵育60 min,加终止液后,波长450 nm读取OD值
1.7 心肌组织切片HE染色
苏木精-伊红(HE)染色检测心肌组织病理改变:左心室心肌取约0.3 cm×0.5 cm×0.5 cm,投入4%多聚甲醛固定48 h。 经过梯度酒精脱水后用石蜡包埋,切至0.6 μm,复水后分别放入苏木素染5 min,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗。用伊红染细胞质:切片入伊红染液中染色2 min,梯度酒精脱水后封片,Olympus显微镜采集图像。
1.8 心肌蛋白免疫印迹
心组织匀浆后BCA法测定蛋白浓度。Western blot检测心肌相关蛋白表达。上样后转膜350 mA,1 h,5%的脱脂奶粉,加入一抗,GPX4、FTH1、GLUT1、Nrf2和FPN1抗体稀释度:1∶500,GAPDH稀释度为1∶1 500,孵育2 h。加入HRP标记的二抗,稀释度为1∶2 500,用ECL发光液孵育膜 5 min。富士感光胶片,压片2 min后显影 3 min,定影10 min。使用Image J软件分析各个条带的灰度值。
1.9 统计学处理
2 结果
2.1 有氧运动和高脂膳食对小鼠糖代谢状态的影响
与对照组相比,高脂组血液中FBG和FINS显著增加,ISI显著下降(P<0.01)。高脂运动组FBG和FINS显著低于高脂组(P<0.01),ISI显著升高(P<0.01,表1)。
Tab. 1 Effects of aerobic exercise and high-fat diet on the carbohydrate metabolism in mice n=10)
2.2 有氧运动和高脂膳食对小鼠心肌氧化应激的影响
与对照组相比,高脂组心肌抗氧化酶活性下降,T-AOC、T-SOD、Mn-SOD、GSH和 GSH/GSSG均显著低于对照组(P<0.01)。运动可显著增强氧化应激相关酶的活性,T-AOC、T-SOD和GSH均显著高于对照组(P<0.01)。与高脂组相比,高脂运动组T-AOC、T-SOD、GSH均显著增加(P<0.01),Mn-SOD和GSH/GSSG与高脂组相比有所增加(P<0.05,表2)。

Tab. 2 Effects of aerobic exercise and high-fat diet on the activities of anti-oxidative enzymes of myocardium in mice n=10)
高脂组心肌线粒体8-OHdG,心肌MDA、4-HNE显著高于对照组(P<0.01)。高脂组心肌非血红素铁含量显著高于对照组(P<0.01)。高脂运动组心肌线粒体8-OHdG,心肌MDA、4-HNE和心肌铁含量显著低于高脂组(P<0.01,表3)。
Tab. 3 Effects of aerobic exercise and high-fat diet on the oxidative sress indexes and non-heme iron of myocardium in mice n=10)
2.3 有氧运动和高脂膳食对小鼠心肌GPX4/ ferroptosis通路相关蛋白表达的影响
与对照组相比,高脂组小鼠心肌GPX4明显下降,铁释放蛋白FPN1和铁储存蛋白FTH1表达明显减少,细胞核内Nrf2减少(P<0.01),胞质内Nrf2显著升高(P<0.01)。与高脂组相比,高脂运动组FPN1、FTH1、GPX4、GLUT1和细胞核内Nrf2显著增加(P<0.01)。高脂运动组FPN1和细胞核内Nrf2显著低于运动组(P<0.01,图1、表4)。
Fig. 1 Effects of aerobic exercise and high-fat diet on the expressions of proteins involved in ferroptosis of myocardium in mice (n=10)
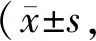
Tab. 4 Effects of aerobic exercise and high-fat diet on the expressions of proteins involved in ferroptosis of myocardium in mice n=10)
2.4 有氧运动和高脂膳食对小鼠心肌组织形态学的影响
HE染色结果显示,高脂组心肌细胞间隙增加,心肌纤维间隙有较多脂质集聚(如箭头所示),心肌细胞肥大。而高脂运动组脂质集聚较少。
3 讨论
组织学检测发现高脂组心肌细胞间隙有较多的脂质集聚,偶见毛细血管基底膜增厚,心肌细胞明显肥大,有心肌纤维化。这些组织学变化可影响心肌的顺应性,容易造成心肌功能障碍,其原因可能是过量铁引发的ferroptosis所致。而运动对心肌组织形态学有明显的改善作用。在高脂组心肌细胞出现了明显的过氧损伤,表现为MDA、4-HNE含量明显增加。4-HNE来源于组织中的不饱和脂肪酸过氧化,并通过线粒体参与多种疾病的发生发展。4-HNE累积引起器官损伤,导致糖尿病并发症,4-HNE可以作为糖尿病终末器官损害(如糖尿病心脏并发症)的生物标志物[12]。高脂组线粒体DNA损伤加剧,表现为高脂组线粒体8-OHdG极显著高于其他各组。在细胞核和线粒体DNA中,8-OHdG是ROS损伤的主要产物之一,通常被用作氧化应激的生物标志物。线粒体氧化损伤是铁超载引起心肌损伤的主要机制。在细胞过氧化损伤严重的前提下,高脂组的抗氧化酶未发挥应有的作用,导致心肌损伤加剧。而高脂运动组则通过提高机体抗氧化酶系统的活性,如T-AOC、T-SOD和GSH,减少机体的过氧化损伤,降低4-HNE、8-OHdG含量。心肌蛋白质组差异表达的结果表明有氧运动能增强大鼠心肌的抗氧化能力,这与本研究结果是一致的[13]。有氧运动组心肌细胞中GLUT1表达增加,促进了心肌细胞对血液中葡萄糖的摄取,有助于维持心肌正常能量供给。高脂膳食运动组小鼠的GLUT1明显增加,甚至高于对照组,说明运动引起机体对高脂膳食的适应,积极增加心肌细胞对血液葡萄糖的摄取,既满足运动中心肌对能量的需求,又在一定程度上降低血糖,增加胰岛素的敏感性。但由于高脂膳食时间较长,这种适应也是有限的,高脂运动组小鼠的血糖依然高于对照组。
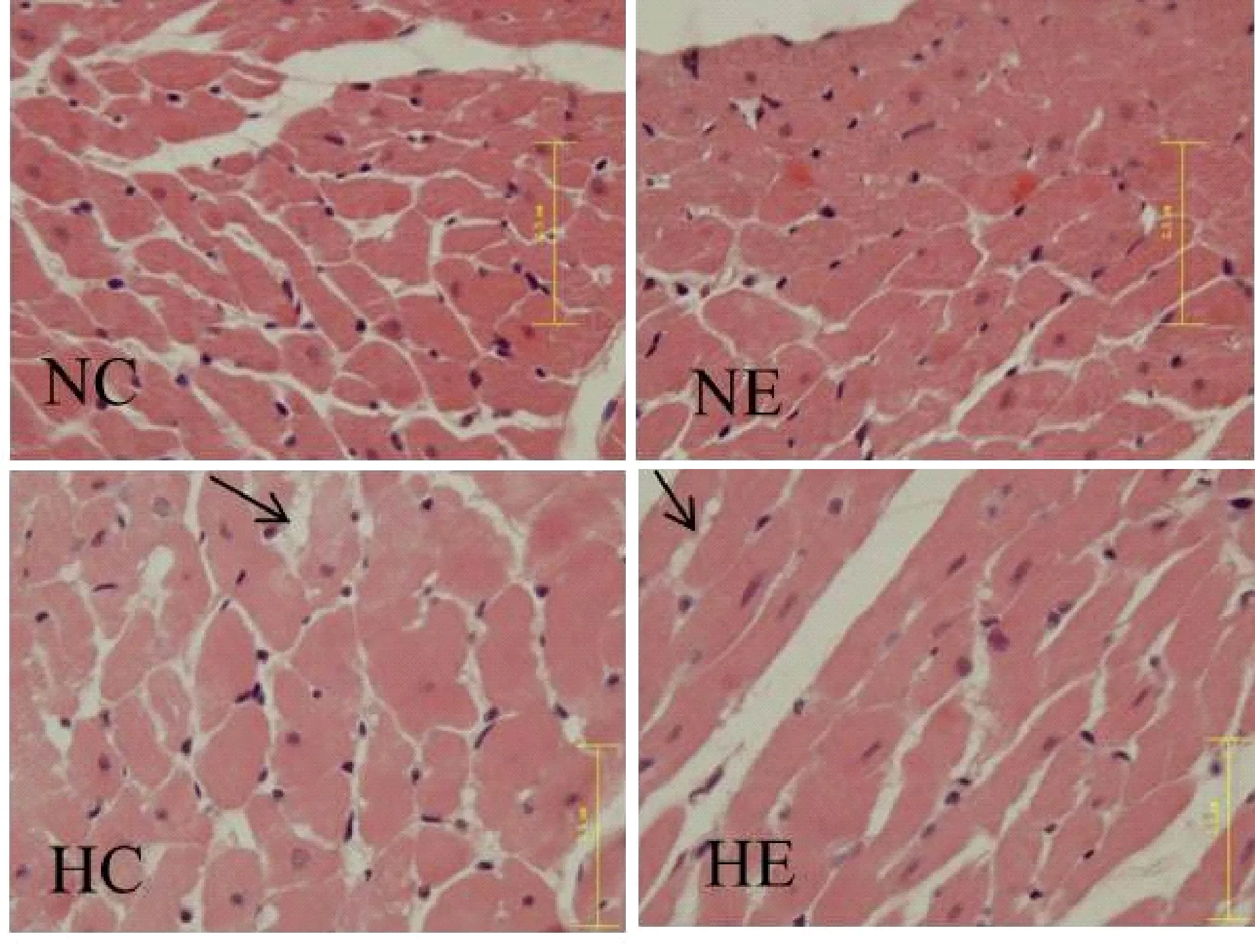
Fig. 2 Effects of aerobic exercise and high-fat diet on the myocardial histomorphology in mice (HE ×100)
铁广泛参与机体的许多生物过程,如氧的转运、脂质代谢、蛋白质合成、细胞呼吸和DNA合成。铁参与维持线粒体的正常结构与功能[14],从而维持心肌生理机能。而铁代谢紊乱引发的ferroptosis参与多种疾病的病理过程,包括T2DM、肥胖、非酒精性脂肪肝等疾病,加速动脉粥样硬化的发展,对心肌缺血/再灌注损伤、心肌梗死、心力衰竭、糖尿病心脏病的发病起到重要作用[15]。因此维持机体铁稳态对于保护心功能起到重要作用。FPN1是哺乳动物细胞膜上唯一的铁释放蛋白,负责将过多的铁释放进入血液循环系统。铁蛋白(ferritin)通过储存多余的细胞铁而在维持机体铁稳态中发挥着核心作用,心脏中分离的铁蛋白主要是H亚基,相对分子质量21KDa,也称为铁蛋白重链(FTH1),具有亚铁氧化酶活性。敲除FTH1小鼠心肌细胞氧化应激增加,高铁饮食后导致严重的心脏损伤和肥厚性心肌病,这说明FTH1在预防心脏ferroptosis和心力衰竭中发挥重要作用[16]。高脂运动组通过增加心肌FPN1表达,促进储存铁的释放,通过FTH1表达增强,减少心肌中的游离铁,起到保护作用。FPN1和FTH1的表达受到细胞核内Nrf2的调控,Nrf2可能作为连接铁代谢和氧化还原改变的中心[17]。有氧运动组和高脂运动组心肌细胞核的Nrf2表达均明显增加,说明运动对Nrf2转位入核起到重要的调控作用。增加的Nrf2促进FPN1和FTH1表达,减少心肌非血红素铁的含量,减轻高脂导致的心肌过氧化损伤。
Ferroptosis参与脂多糖(LPS)诱导的心脏损伤,并与心脏肥厚,糖尿病心肌病和阿霉素诱导的心脏毒性密切相关。通过ferroptosis的抑制剂:Ferrostatin-1可显著改善糖尿病心肌缺血/再灌注过程中心肌细胞的损伤,减少心肌梗死面积,这是通过激活抗氧化酶系统及GPX4实现的[18]。GPX4主要通过GSH依赖的方式特异性催化脂质过氧化物使其失去氧化活性,进而保护细胞免受ferroptosis威胁。高脂运动组心肌GPX4表达量显著高于高脂组,同时心肌GSH含量提高,为GPX4反应提供充足的底物,降低机体脂质过氧化反应。对心肌细胞选择性地增加GSH水平,可有效预防心脏ferroptosis[19]。该实验结果与本研究是一致的。而对缺血性心脏病和心肌细胞(H9c2)降低GPX4表达,则可增强ferroptosis[20]。高脂组心肌GPX4显著低于其他各组,线粒体8-OHdG显著增加,也说明高脂膳食引发心肌细胞ferroptosis。以ferroptosis为目标可作为预防心肌病的一种心脏保护策略。
综上所述,有氧运动可减轻小鼠心肌线粒体的DNA损伤,有助于减轻高脂膳食引发的心功能受损,增强小鼠心肌细胞质中Nrf2转位入细胞核,促进其下游的GPX4表达增强,抑制心肌细胞发生ferroptosis;同时,Nrf2还可促进FPN1释放铁和FTH1储存部分铁,降低心肌中游离铁含量,进一步保护心肌免于ferroptosis;通过运动抑制ferroptosis有望成为新的心脏保护靶点。
