细胞自噬在大鼠肺缺血/再灌注引发肝脏损伤中的作用*
2022-08-29王肖婷汤一冰林青青王新雨宋正阳郝卯林王万铁
王肖婷, 汤一冰, 林青青, 王新雨, 宋正阳, 郝卯林, 钱 巍, 王万铁△
(1. 温州医科大学缺血-再灌注损伤研究所, 浙江 温州 325035; 2. 温州医科大学附属第二医院病理科, 浙江 温州 325000;3. 杭州临安区人民医院全科医疗科, 浙江 临安 311300)
近年来,随着袖式肺叶切除术和活体肺叶移植等手术治疗的发展,术后出现肺缺血/再灌注(lung ischemia /reperfusion,LI/R)引起的远端脏器损伤,如脑损伤、肾脏损伤、肝脏损伤等的发生率正在不断提高[1],但目前对这一现象的研究还很少,其发生机制也仍不清楚,因而也尚无有效的防治手段。细胞自噬(cell autophagy) 作为近年来研究的热点,是指活细胞在某种条件下,细胞将自身受损的细胞结构主动转运入溶酶体(lysosome) 并自主降解的过程[2]。有关在脏器缺血/再灌注损伤中,细胞自噬所起的作用问题近来备受关注。据此,本研究以SD大鼠的肺缺血/再灌注损伤(lung ischemia/reperfusion injury, LI/RI)模型为研究对象,探索肺缺血/再灌注过程中肝脏的损伤情况,以及细胞自噬在其中所起的作用,为日后研究LI/R引起的肝损伤提供新的治疗思路。
1 材料与方法
1.1 实验动物
雄性SD大鼠,体重(200±20)g,清洁级,购自温州医科大学动物实验中心,许可证号为 SCXK(浙)2018-0149。
1.2 主要试剂
二甲基亚砜(dimethyl sulfoxide,DMSO)、3-甲基腺嘌呤(3-methyladenine,3-MA)、水合氯醛购于中国上海生工生物技术有限公司;BCA蛋白定量试剂盒购自中国碧云天生物技术研究所;兔抗大鼠 p-AMPK/AMPK 抗体、抗 p-mTOR/mTOR 抗体、抗 LC3II抗体、抗 p62 抗体、抗 beclin-1 抗体和抗 GAPDH 抗体均购自 Abcam 公司;山羊抗兔IgG HRP抗体购自Biosharp公司。
1.3 大鼠LI/RI模型的构建
手术前腹腔注射5%水合氯醛(10 ml/kg体重)麻醉大鼠后,暴露并切开气管实施气管插管,并接小动物呼吸机进行机械通气,小动物呼吸机参数设置为:潮气量30 ml/kg,呼吸频率70次/分,吸呼比3∶2,外接100%浓度的氧气。开胸并用微型动脉夹夹闭左肺门,若观察到左侧肺组织不再膨胀,则可认为已夹闭肺门,以此模拟肺组织缺血缺氧;在夹闭肺门30 min后松开动脉夹,可见左侧肺组织重新膨胀,使左肺再灌注3 h,期间监测大鼠生命体征。实验结束时,重新打开胸腔,抽取腔静脉血,取肺组织,滤纸吸净肺组织表面并称重,记录重量为湿重(wet weight,W),之后烘箱70℃烘干24 h后再次称重,记为干重(dry weight,D),计算肺组织湿干重比,即W/D作为肺组织损伤及造模是否成功的依据[3]。之后使用过量麻药使大鼠死亡,并取肝脏组织进行之后的检测。
1.4 实验分组
随机将大鼠分为4组,每组6只,实验操作前12 h均禁食禁饮。各组分别作如下处理:(1)假手术组(sham组):将大鼠麻醉后,气管插管并打开胸腔,机械通气3.5 h后取材检测;(2)缺血/再灌注组(I/R组):见1.3;(3)溶剂组(DMSO组):根据称量的体重,术前1 h腹腔注射与3-MA组等量的DMSO溶液,余操作同I/R组;(4)自噬拮抗剂组(3-MA组):术前1 h腹腔注射3-甲基腺嘌呤溶液30 mg/kg(使用DMSO溶解3-MA,使3-MA溶液浓度为30 mg/kg),余操作同I/R组。
1.5 肝脏组织形态学观察
将大鼠处死后,取再灌注侧肺下叶及肝脏下叶,先进行组织固定脱水,再通过浸蜡、包埋、切片、脱蜡等步骤,最后用苏木素-伊红(HE)染色并封片,于普通光学显微镜下观察肝脏组织形态学改变,主要包括肝小叶结构、肝细胞形态、炎症细胞浸润等。
1.6 肝脏细胞超微结构观察
用生理盐水漂洗后将组织迅速地放在预冷并滴有固定液的蜡板上,在固定液中用手术刀片将组织块修成1 mm×1mm×1mm的立方体组织块。各组织块分别经过后固定、块染、丙酮梯度脱水、浸透、包埋聚合、半薄切片、超薄切片等一系列步骤后,在电镜下观察肝细胞的内部超微结构,拍照保存。
1.7 肝脏谷丙转氨酶与谷草转氨酶表达水平的检测
大鼠在造模完成处死前,抽取腔静脉血,将标本离心分离出血清。取丙氨酸氨基转移酶测定试剂盒和天冬氨酸氨基转移酶试剂盒,采用ADVIA2400全自动生化分析仪检测谷丙转氨酶与谷草转氨酶的水平。
1.8 RT-qPCR检测肝细胞自噬相关蛋白基因(mRNA)的表达水平
将肝组织剪成小块,加入Trizol在冰上裂解5 min。加入约200 μl氯仿后颠倒混匀,低温高速离心后吸取上层水相。加入等体积异丙醇,颠倒混匀,离心后弃去上清液加入75%乙醇,再次离心后除去乙醇残液,收集沉淀即为提取的总RNA。将RNA沉淀溶于30 μl DEPC水中,测定总RNA浓度并根据浓度计算上样体积,按照逆转录试剂盒说明书合成cDNA。引物的设计和合成工作由上海捷瑞生物工程有限公司及上海生物工程股份有限公司负责(表1)。反应结束后确认PCR扩增曲线和融解曲线,根据目的基因与内参GAPDH基因的Ct值计算目的基因相对表达量。

Tab. 1 The sequences of the primers for RT-qPCR
1.9 Western blot法检测肝脏组织自噬相关蛋白的表达水平
将各组肝组织剪碎,在含PMSF的RIPA裂解液中充分裂解,低温高速离心并收集上层蛋白溶液,后采用BCA蛋白定量法检测蛋白浓度。各组测定浓度后确定上样量,用蛋白免疫印迹实验检测肝组织自噬相关蛋白的表达,通过SDS-PAGE凝胶电泳、转膜、封闭与一抗二抗孵育、化学发光成像等步骤,并使用Image J 软件对得到的图像进行分析。将自噬相关蛋白LC3-B、Beclin 1、p62蛋白条带的灰度值分别与内参蛋白GAPDH条带相比,比值作为反映蛋白表达水平的相对指标。将p-AMPK与AMPK蛋白条带,p-mTOR与mTOR蛋白条带灰度值之比反映蛋白磷酸化表达水平。
1.10 统计学处理
2 结果
2.1 各组肺湿/干重比的比较
与Sham组(2.120±0.461)相比,I/R组(5.285±1.187)、DMSO组(5.694±0.727)、3-MA组的肺湿/干重比(4.243±0.626)均有升高(P<0.01);与DMSO组(5.694±0.727)相比,3-MA组的肺湿/干重比(4.243±0.626)略有下降(P<0.05)。W/D作为反映肺组织损伤程度的指标,说明本实验的肺缺血/再灌注模型构建成功。
2.2 各组肝脏组织光镜观察形态学的比较
光镜下可见,Sham组的肝脏结构正常,肝小叶完整,肝细胞索排列有序呈辐射状,肝细胞形态正常,未见水肿、坏死及炎症细胞浸润。I/R组、DMSO组的肝小叶结构紊乱,肝索结构消失不见,肝细胞水肿,细胞间出现点状坏死。而3-MA组肝小叶较为完整,仍可见肝索结构,肝细胞稍有水肿(图1)。
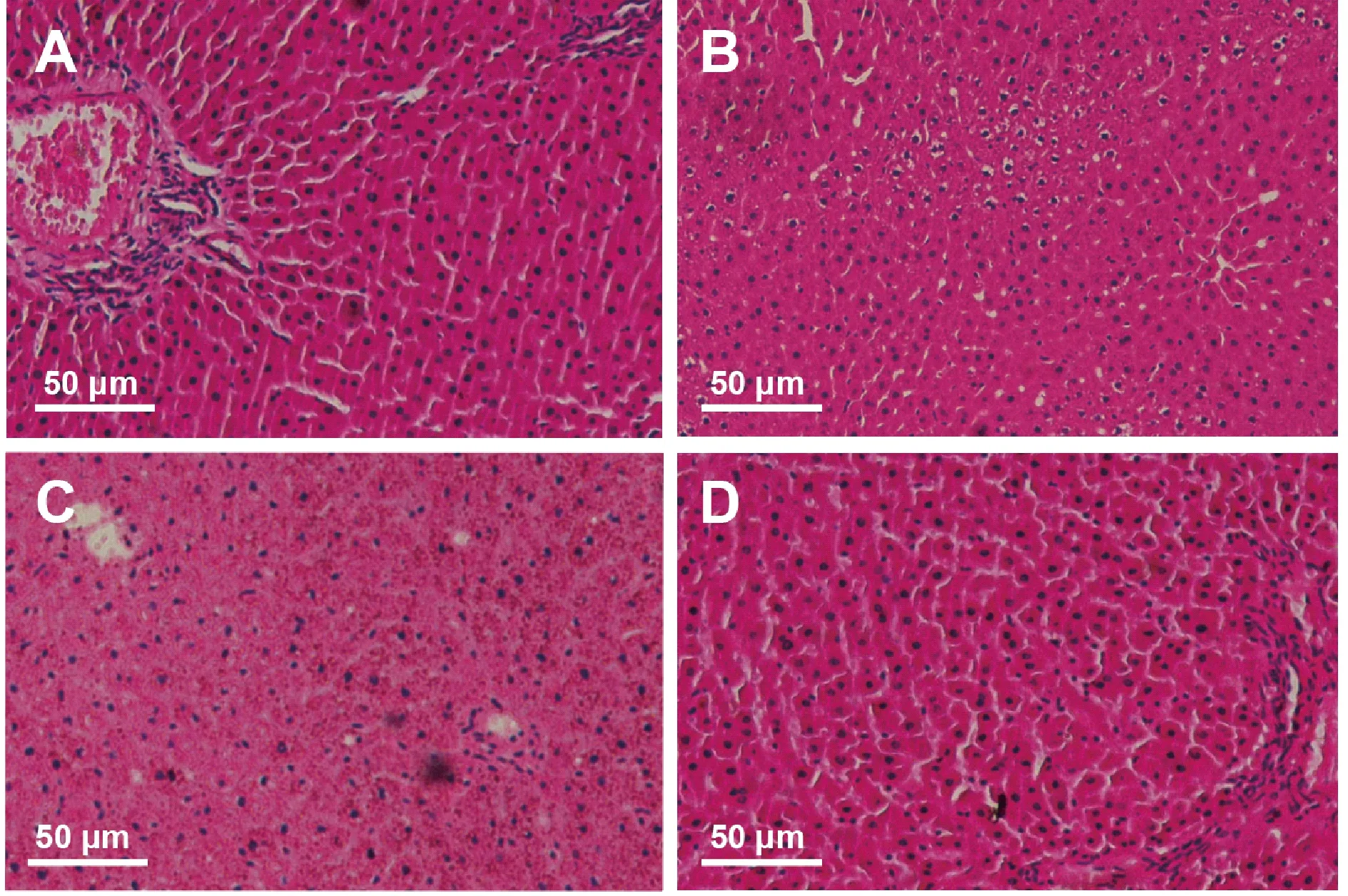
Fig. 1 HE staining of hepatic tissues in each group(×200, Bar=50 μm)
2.3 各组肝脏组织透射电镜观察形态学的比较
透射电镜下可见,Sham组肝细胞线粒体形态良好,无明显空泡,肝细胞核结构完好。而I/R组、DMSO组有较多线粒体出现空泡状,其中DMSO组可见自噬小体,细胞损伤也较重。3-MA组自噬体形成明显受到抑制,肝细胞损伤也相对较轻(图2)。
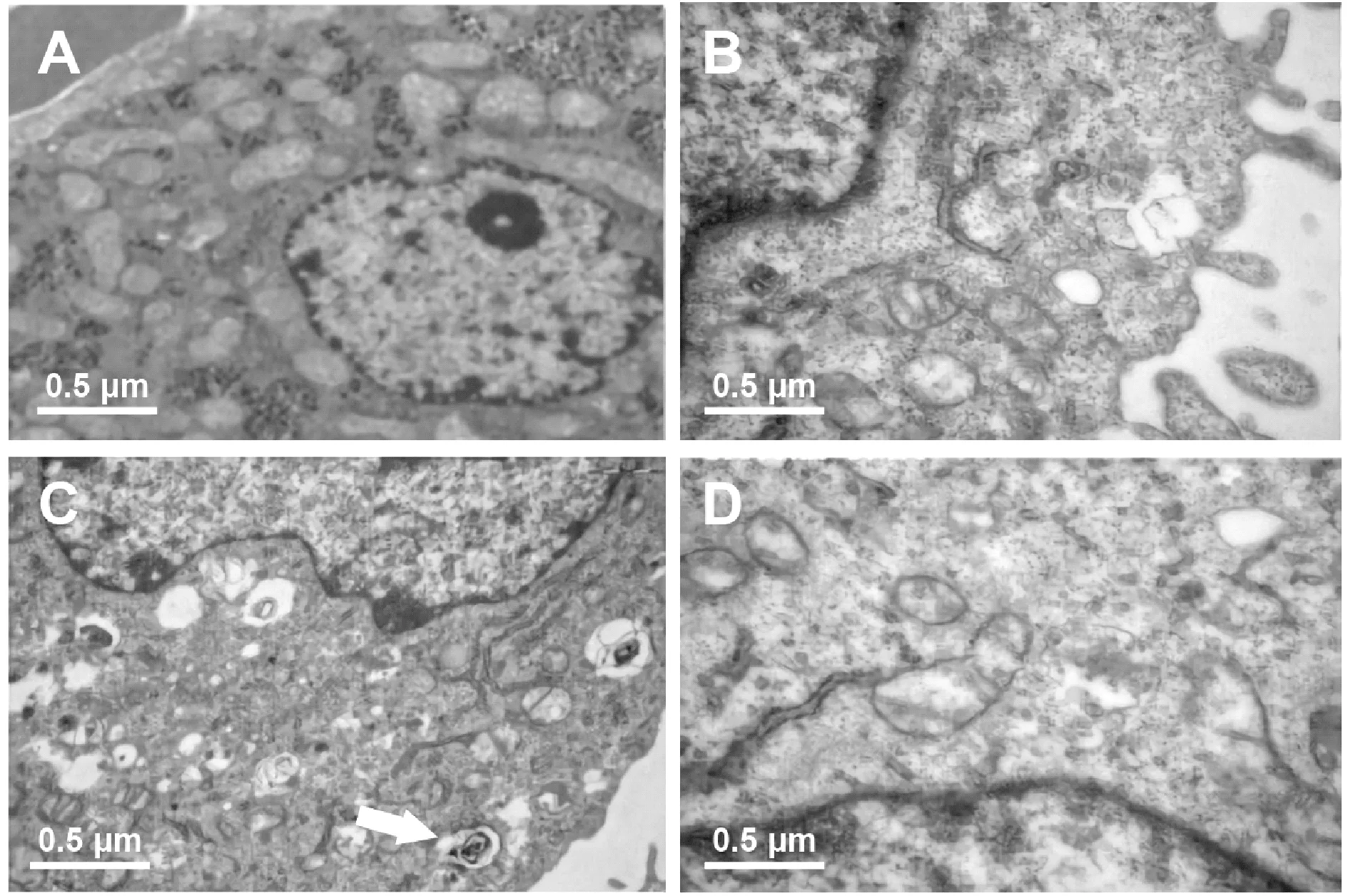
Fig. 2 Hepatic cell ultrastructure of each group under electron microscopy(×15 000, Bar=0.5 μm)
2.4 各组谷丙转氨酶与谷草转氨酶水平的比较
与Sham组相比,I/R组、DMSO组、3-MA组的ALT和AST水平均升高显著 (P<0.05);而I/R组、DMSO组间的ALT和AST水平均无统计学差异(P>0.05);相较于DMSO组,3-MA组的ALT水平有所下降(P<0.05)。即缺血/再灌注时肝细胞损伤可能加重(表2)。

Tab. 2 Theserum levels of ALT and AST in each group (U/L, n=6)
2.5 各组肝脏组织自噬相关基因(mRNA)表达的比较
RT-qPCR检测结果显示,与Sham组相比,I/R、DMSO、3-MA三组肝脏组织的AMPK、Beclin 1和LC3 mRNA表达均有增多,而mTOR和p62 mRNA表达降低(P<0.05或P<0.01);I/R和DMSO组相比,两组间AMPK、Beclin 1、LC3、mTOR和p62 mRNA的表达变化无统计学差异(P>0.05);与DMSO组相比,3-MA组的AMPK、Beclin 1和LC3 mRNA表达显著下降,而mTOR和p62 mRNA表达水平上升(P<0.05或P<0.01,表3)。
2.6 各组肺组织自噬相关蛋白水平的比较
Western blot检测结果显示,与Sham组相比,AMPK蛋白磷酸化水平和Beclin 1、LC3-B蛋白表达在其余各组肝脏组织中均明显升高,mTOR蛋白磷酸化水平和p62蛋白表达则显著下降(P<0.05或P<0.01);I/R组与DMSO组比较,各蛋白表达水平无明显差异(P>0.05);与DMSO组相比,AMPK蛋白磷酸化水平和Beclin 1、LC3-B蛋白表达在3-MA组中显著下降,mTOR蛋白磷酸化水平和p62蛋白表达有明显上升(P<0.05或P<0.01,图3、表4)。
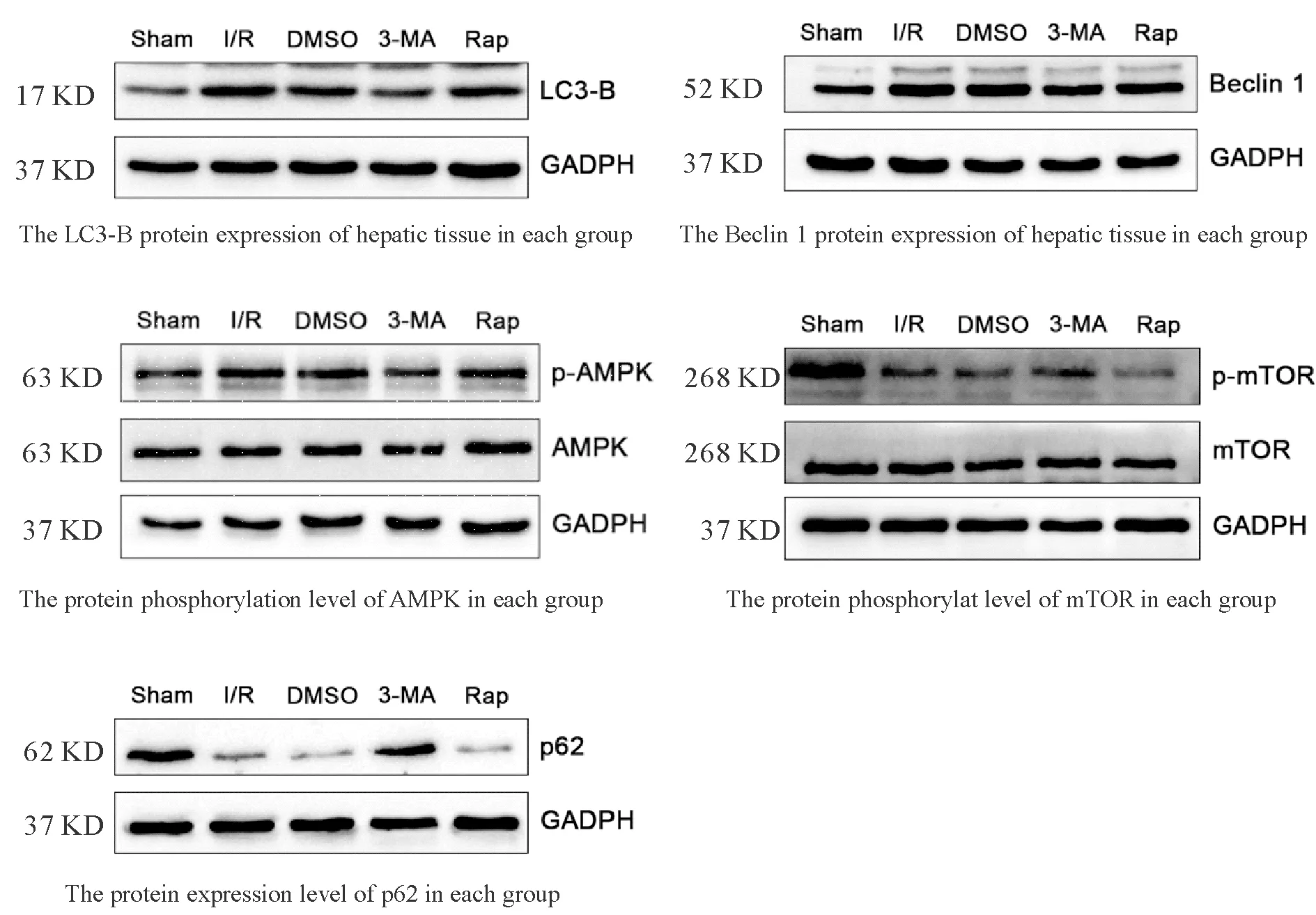
Fig. 3 The protein expressions of LC3-B and Beclin 1 in hepatic tissue and the protein phosphorylation levels of AMPK, mTOR and p62 in each group
3 讨论
随着肺移植、心脏外科手术体外循环、心肺复苏以及肺外科中单侧肺循环阻断技术的进步与发展,肺缺血/再灌注(lung ischemia/reperfusion,LI/R)的发生率正显著提高,其常可引起多种不良后果,包括低氧血症及急性呼吸功能衰竭等[4]。LI/RI的发生涉及到了多重细胞及分子机制。最新研究表明,无菌性免疫反应、氧化应激、补体或纤维蛋白激活、内皮功能异常等[5,6]在肺缺血/再灌注损伤中起到重要作用。随着研究的深入发现, LI/R与细胞坏死和程序性凋亡亦有相关性,细胞或程序性死亡及其诱导的炎症反应也正被广泛研究。
LI/R除了直接损伤肺脏外,还可通过某些机制影响远端脏器。临床上观察到,肺缺血/再灌注不仅仅是一个局部事件,在造成肺脏本身损伤的同时,还可通过全身循环影响远端器官,包括脑、心肌、肾脏、肝脏等损伤[7,8]
肝和肺都是人体中非常重要的器官,肝脏作为“生化工厂”,承担着代谢、解毒、分泌胆汁、免疫及凝血等多种功能,而肺进行气体交换,维持人体一系列的生命活动。在人体中,肝与肺互相调节,共同维持内环境的稳态,而当某疾病发生时,肝与肺又会互相影响,参与并推动疾病的病理生理过程。 肝脏的疾病如肝肺综合征(HPS)、肝源性脓毒血症等[9]会引起肺功能紊乱,同样的,肺脏的疾病如ARDS,甚至是最近研究的热点新型冠状病毒肺炎(COVID-19)[10,11],亦都会对肝脏造成损伤。而对于LI/R引起的肝脏损伤,目前的研究认为其机制可能是过量的活性氧 (reactive oxygen species, ROS) 引发氧化应激从而导致急性炎症反应,其诱因与肿瘤坏死因子-α(TNF-α) 、白细胞介素-1 (IL-1) 、白细胞介素-6 (IL-6) 等细胞因子有关,其特点是中性粒细胞的活化和大量活性氧的释放[12],但相关的研究还较少,因而深入的研究可能对寻找有效的防治措施具有一定的理论意义和应用价值。
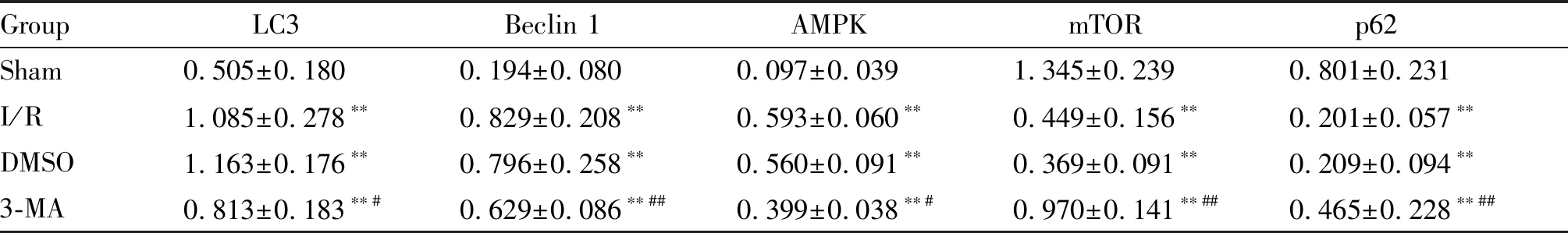
Tab. 3 The mRNA expressions of LC3, Beclin 1, AMPK, mTOR and p62 in each group
本研究依据文献构建大鼠的LI/R模型,通过该模型测定肝脏的相关指标,可反映肺缺血/再灌注时肝脏发生的相关变化。谷丙转氨酶(ALT)和谷草转氨酶(AST)大量存在于肝脏内。当肝细胞受损时,ALT和AST会从细胞中释放并导致血液中该两项指标迅速上升,因此测定ALT和AST水平可反映肝脏组织的受损情况。本实验中3-MA组的ALT和AST水平均较低,说明自噬拮抗剂3-MA可减轻肝脏组织的受损情况。光镜和透射电镜的结果也表明,肺缺血/再灌注在引起肺组织损伤的同时,也的确可引起肝脏组织的损伤。
在缺血/再灌注损伤(ischemia/reperfusion injury, I/RI)中,细胞自噬被认为起到双向调控的作用[13]。适度的自噬增强可为细胞提供能量,但若再灌注损伤超过细胞承受范围,可导致细胞死亡[14]。当细胞在应激时自噬会被激活, 如缺血和缺氧, 在这些条件下抑制自噬会导致细胞死亡增加。相反, 诱导自噬可以保护动物免受缺血/再灌注损伤。研究表明,大鼠缺血/再灌注肺损伤时细胞自噬作用增强[15]。在肝脏组织,由于自噬调节过程的机制复杂,其与肝、I/RI之间的具体作用关系仍存在着矛盾与争议[16]。AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)和雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR) 作为自噬信号通路的上游调控蛋白,可分别诱导和抑制自噬的发生[17,18]。本研究中,经肺缺血/再灌注处理的实验组AMPK mRNA和蛋白磷酸化水平上升,而mTOR则为相反趋势;Beclin 1作为Beclin 1-PI3K class III通路中的重要蛋白,也在自噬启动阶段发挥关键作用,而本研究中的3-甲基腺嘌呤(3-MA)即是通过抑制ClassIII-PI3K的活性来抑制自噬[19,20]。除此之外,自噬效应蛋白微管相关蛋白1轻链3 (microtubule-associated protein 1 light chain 3,LC3)作为自噬的标志性蛋白,其表达水平可有效反映细胞内自噬体的数量,是与自噬发生的程度呈正相关性的自噬体标志物之一[21,22]。p62也是自噬溶酶体系统蛋白降解过程中的重要蛋白之一,在自噬的过程中,p62被不断消耗,因此其表达与细胞自噬的活性呈负相关。在本研究中,将其亦作为检测自噬水平的关键指标[23]。本实验结果表明,肺缺血/再灌注会引起肝脏组织中Beclin 1、 LC3 mRNA表达增加,对应的自噬正性蛋白Beclin 1、LC3-B蛋白的表达也有上升, 而p62 mRNA和p62蛋白水平下降,说明肺缺血/再灌注会引起肝组织细胞自噬水平上升;而应用自噬抑制剂3-MA后,可观察到自噬被抑制,同时肝细胞损伤情况有所改善。但有学者发现,DMSO可通过自噬诱导减少肝细胞脂质积累,并认为DMSO可能通过抑制激活转录因子(activating transcription factor 4,ATF4)表达来激活自噬,但存在时间和剂量依赖性[24]。本实验中,DMSO组与I/R组各项指标差异无明显差异,故可认为本实验中的DMSO浓度尚不足以影响其对自噬的调节。
综上所述,本实验通过建立大鼠LI/R模型,证实在大鼠肺组织发生缺血/再灌注时,会诱发肝脏组织损伤并出现自噬的高表达;而抑制自噬后,可减轻肺缺血/再灌注带来的肝脏组织损伤。在缺血/再灌注损伤过程中,如何适当干预自噬调控通路,从而有效保护细胞,减轻损伤,是我们今后研究工作努力的方向。
