沙利度胺抑制肿瘤细胞分泌VEGF/bFGF机制的探讨*
2022-08-29黄海宁龙超良
黄海宁, 汪 汇, 龙超良, 张 浩,△, 汪 海,3,△
(1. 济宁医学院附属医院, 山东 济宁 272029; 2. 北京赛德维康医药研究院, 北京 100039; 3. 江苏师范大学健康科学学院, 徐州 221116; 4. 中国人民解放军总医院, 北京 100853)
沙利度胺(thalidomide,Thal)又称反应停,化学名为α-酞胺哌啶酮,在1950年被德国药物公司首先合成并作为一种镇静剂上市,后来由于沙利度胺能缓解妊娠期妇女的呕吐症状而被用于孕妇早期呕吐,但是很快发现沙利度胺有严重的致畸作用,造成大面积的畸形儿童的产生。因此,该药物在1961年撤出市场[1]。然而,沙利度胺致畸作用的机制引起了科学家们的极大兴趣,并进行了大量的研究,发现了其重要的生物学作用,如抗血管生成[2-4]、抗炎[5]、免疫调节[6]和氧化应激[7, 8], 2006年美国FDA批准其用于多发性骨髓瘤的治疗,在近几年其在实体瘤的临床治疗中也取得了很好的成效[9, 10]。但沙利度胺的抗肿瘤作用机制尚不明确,有研究指出沙利度胺可能因抑制肿瘤血管新生从而抑制恶性肿瘤的转移及生长。
2010年,Takumi等人发现CRBN是沙利度胺结合蛋白,沙利度胺通过与CRBN结合并抑制相关的泛素连接酶活性来启动致畸作用,由此得出CRBN是沙利度胺致畸作用的主要靶点[11]。然而,CRBN是否参与调控沙利度胺抑制肿瘤血管生成罕见报道。肿瘤细胞分泌的VEGF和bFGF被认为是最重要的血管生成因子,可以启动肿瘤血管生成从而促进实体肿瘤的生长和转移[12-14]。本研究利用载体构建技术构建CRBN-shRNA干扰质粒敲低A549和HepG2细胞中CRBN,探讨CRBN对沙利度胺抑制A549细胞及HepG2细胞分泌的VEGF和bFGF的影响,并进一步研究其可能的分子机制。
1 材料与方法
1.1 实验材料
人肺腺癌A549细胞及人肝癌HepG2细胞购于美国 ATCC公司;DMEM培养基及胎牛血清购于美国HyClone Laboratory公司;沙利度胺由北京赛德维康医药研究院合成并提供,用二甲基亚砜 (DMSO)配制成100 mmol/L的母液并储存在-20℃冰箱中以备用,为了保证含DMSO≤1‰,在使用前需用DMEM培养基稀释1 000倍;TRIzol试剂购于美国Invitrogen公司;SYBR Green Real-time PCR Master Mix Plus和qPCR RT Master Mix购于日本 TOYOBO 公司;限制性内切酶和DNA聚合酶购于日本TaKaRa公司;转染所用的试剂购于北京威格拉斯公司;RNA干扰引物由Damacon公司设计;bFGF和VEGF ELISA试剂盒购于武汉博士德生物技术公司。
1.2 MTS实验检测细胞增殖活力
将A549细胞及HepG2细胞用10%FBS的DMEM培养基制成5×104cells/ml的细胞混悬液,每孔加入100 μl细胞混悬液于96孔板中,随机分为含1‰DMSO的l00 μl培养基的空白对照组,1 、10、50、100、500 μmol/L的沙利度胺组,每组设置3个复孔。将加入药物的96孔板放入培养箱中培养48 h,每孔加入20 μl MTS,放在酶标仪上,调整到490 nm测吸光度 (A)值,计算方法参照文献[15],用抑制率(inhibition ratio,IR)间接表示药物对细胞增殖活力的影响,其计算公式如下:
IR(%)=(A空白-A药物)/A空白×100%
1.3 构建shRNA稳定敲低CRBN的肿瘤细胞株
1.3.1 CRBN短发夹RNA (short hairpin RNA, shRNA)慢病毒载体的构建 登录GenBank数据库获取人CRBN基因序列,利用Damacon公司的shRNA靶序列分析软件针对靶序列设计RNA干扰引物,针对的靶序列:5’- CGCTGGCTGTATTCCTTATAT-3’;荧光素酶(luciferase) shRNA(对照组)的靶序列为:5’- CTTCGAAATGTCCGTTCGGTT-3’。将合成好的正义链与反义链RNA干扰引物置于1/10 TE(Tris盐酸和EDTA的混合液)分开溶解,按照等比例混匀后以90℃加热3 min,待降温至37℃后便得到双链的寡核苷酸;shRNA慢病毒表达载体(pLKO)用限制性内切酶EcoR I和Age I进行双酶切后,跑胶并回收目的片段,回收产物与前面退火得到的引物进行连接,通过大肠杆菌DH5α感受态细胞转化,挑取单克隆,送至北京华大生物技术公司测定基因序列。
1.3.2 CRBN shRNA慢病毒表达载体的包装 将HEK293T细胞接种于6孔板中(转染时细胞密度约为80%),第2日包装前1 h更换新鲜的完全培养基,然后用磷酸钙转染法将已克隆好的CRBN shRNA序列的慢病毒表达载体和相应的病毒包装质粒(慢病毒shRNA表达载体1.25 μg,PLP1 1 μg,PLP2 0.5 μg和VSVG 0.7 μg)共同转染到293T细胞中,6 h后更换新鲜培养基,转染36 h后收集包含病毒的上清,4℃ 3 000 r/min的离心10 min,离心好的病毒上清于-80℃保存备用。
1.3.3 获取稳定表达CRBN shRNA 肿瘤细胞株 A549及HepG2细胞经胰酶消化后,取2×105cells/well于6孔板中,加入100 μl病毒上清和终浓度8 μg/ml的聚凝胺(Polybrene),实验分为CRBN shRNA组(相应病毒上清+Polybrene)、luciferase shRNA组(相应病毒上清+Polybrene),6 h后换液,24 h后加入2 μg/ml的嘌呤霉素(puromycin),3 d后观察空白对照细胞状态(理论上应该全部死亡),此时将CRBN shRNA和luciferase shRNA组中存活的细胞传代培养,获得稳定整合可表达CRBN shRNA及luciferase shRNA慢病毒载体的混合细胞克隆,随后分别提取2种细胞RNA及总蛋白进行进行实时定量PCR及Western blot检测其转染效果。
1.4 实验设计
将 A549细胞及HepG2细胞按照 3×105cells/well接种到6孔板中,随机分为以下几组,将A549细胞分为阴性对照组(A549luciferase)、CRBN低表达组(A549CRBN);HepG2细胞分为阴性对照组(HepG2luciferase)、CRBN低表达组(HepG2CRBN),放入37℃,5%CO2的培养箱中培养24 h后,更换培养液,分别加入1 ml含100 μmol/L沙利度胺(thalidomide组)和1 ml 1‰ DMSO(control组)的培养液,继续培养24 h再行后续实验,每组设计3个复孔。
1.5 Western blot 检测蛋白表达
取A549luciferase细胞、A549CRBN细胞、HepG2luciferase细胞及HepG2CRBN细胞,分别加200 μl RIPA裂解液,冰上裂解30 min,收集上清液。使用BCA法测定蛋白浓度,每个样品取50 μg总蛋白进行SDS-PAGE凝胶电泳。利用半干转膜法将细胞蛋白转至PVDF膜,将膜置于5 %脱脂奶粉封闭1 h,加入稀释过的一抗4℃过夜,TBST洗膜后,加入HRP标记的二抗孵育1 h。TBST洗膜后再加入ECL发光液进行显影并拍照。采用Image J软件分析蛋白相对灰度值,以β-actin为内参计算蛋白表达相对量,所有实验独立重复3次。
1.6 实时定量PCR (Real-time PCR)检测基因表达
采用 TRIzol试剂盒提取各组的总RNA,参照试剂盒说明书反转录成cDNA,每个样品重复三次,引物见下表1。依照2-△△Ct法计算基因表达水平,△△Ct=(Ct目标基因-Ct内参基因)样品组-(Ct目标基因-Ct内参基因)对照组。

Tab. 1 Sequences of primers for real-time PCR
1.7 ELISA检测蛋白表达
收集按照上述分组进行干预的各组细胞上清液,各取100 μl加入抗体包被的96孔板中,37℃反应90 min,甩去液体,将提前稀释好的抗体100 μl/well加入96孔板中,37℃ 60 min。用PBS洗涤1 min/3次,将在37℃预热的ABC工作液100 μl/well加入,37℃30 min。再用PBS洗涤1 min/5次,加入90 μl/well的显色液,放入37℃培养箱内避光反应20~25 min,再加入100 μl/well终止液,在酶标仪450 nm中测定吸光度(OD)值,每个实验样品重复3次。
1.8 统计学处理
2 结果
2.1 MTS法检测沙利度胺对细胞增殖活力的影响
1、10、50、100和500 μmol/L沙利度胺对细胞增殖的抑制率见表2。与空白对照组比较, 500 μmol/L沙利度胺能显著抑制 A549及HepG2 细胞的增殖活力(P<0.05),而其它浓度对细胞增殖无显著抑制作用,该结果与报道一致。
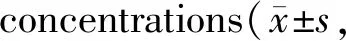
Tab. 2 The inhibition rate of thalidomide on A549 and HepG2 cells at different n=3)
2.2 获得稳定敲低CRBN 的A549及HepG2细胞
运用慢病毒介导的 shRNA方法(pLKO shRNA 质粒),构建敲低CRBN的A549CRBN及HepG2CRBN细胞。Real-time PCR及Western blot法检测其敲低效果,与A549luciferase及HepG2luciferase细胞比较,A549CRBN及HepG2CRBN细胞的CRBN 基因水平显著降低(P<0.01,表3),蛋白表达水平也显著降低(P<0.01,图1)。
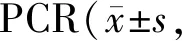
Tab. 3 The expression levels of CRBN mRNA determined by real-time n=3)
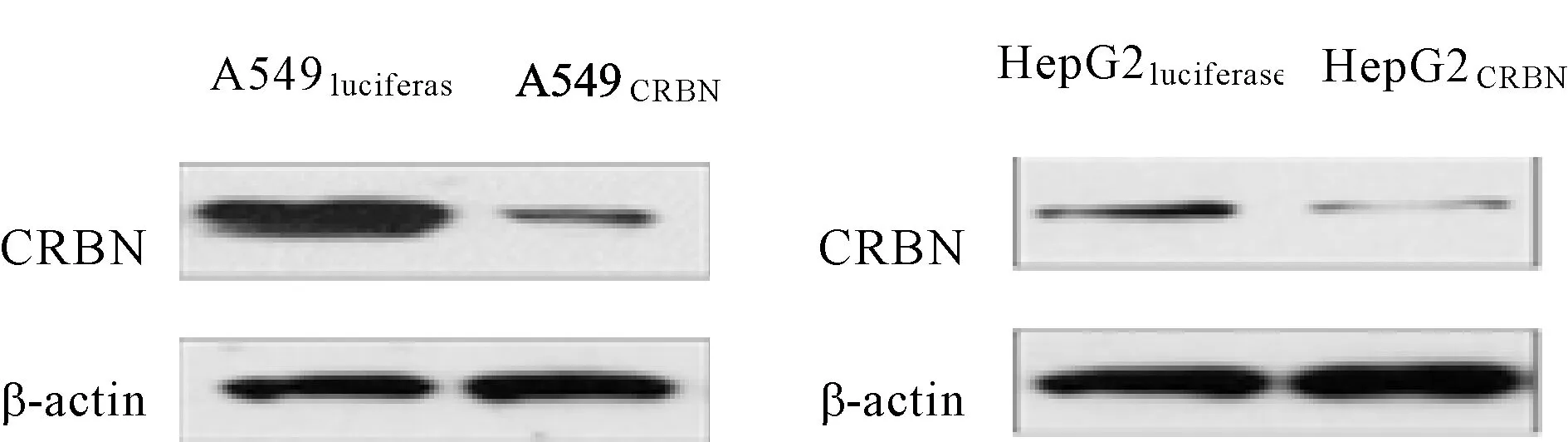
Fig. 1 Proteinexpressions of CRBN detected by Western blot n=3)
2.3 敲低CRBN对A549及HepG2细胞VEGF和bFGF表达的影响
与A549luciferase及HepG2luciferase比较, A549CRBN及HepG2CRBN组VEGF和bFGF的mRNA及蛋白表达水平明显降低 (P<0.05,表4,5),表明CRBN与VEGF或bFGF表达同步下调。

Tab. 4 Effects of CRBN on the expressions of VEGF and bFGF at the mRNA level n=3)

Tab. 5 Effects of CRBN on the expressions of VEGF and bFGF at the protein level (pg/ml, n=3)
2.4 CRBN调控沙利度胺抑制细胞VEGF和bFGF的表达
沙利度胺抑制A549和HepG2细胞VEGF、bFGF的表达,当敲低CRBN后,抑制作用消失 (P< 0.05,表6,7),说明沙利度胺对A549或HepG2细胞中VEGF和bFGF表达的影响是由CRBN调控的。
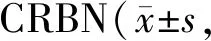
Tab. 6 Effects of thalidomide on the expressions of VEGF at the mRNA level regulated by n=3)

Tab. 7 Effects of thalidomide on the expressions of VEGF at the protein level regulated by CRBN(pg/ml, n=3)
2.5 敲低CRBN对VEGF和bFGF转录因子(c-Jun)基因表达的影响
c-Jun是VEGF和bFGF共同的转录因子。为了确定CRBN对c-Jun表达的影响,我们检测了c-Jun的mRNA表达水平。结果表明,在A549细胞及HepG2细胞中,敲低CRBN c-Jun mRNA的表达水平降低 (P<0.05,表8),表明CRBN和c-Jun的表达同步下调。
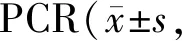
Tab. 8 The expressions of c-jun mRNA detected by real-time n=3)
2.6 CRBN调控沙利度胺抑制c-Jun的表达
沙利度胺处理A549细胞及HepG2细胞48 h后,在mRNA水平上检测c-jun的表达。沙利度胺抑制VEGF和bFGF转录因子c-jun的mRNA转录水平,敲低CRBN,在HepG2细胞中沙利度胺对c-jun的抑制作用消失 (P<0.05,表9),而在A549细胞中抑制作用反而增强,提示c-Jun可能是HepG2细胞中介导沙利度胺抑制VEGF和bFGF的转录因子之一。
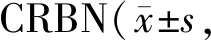
Tab. 9 Effects of thalidomide on the expressions of c-jun at the mRNA level regulated by n=3)
3 讨论
肿瘤细胞分泌的VEGF和bFGF是最重要的血管生成因子,临床和动物实验结果显示,沙利度胺可下调骨髓瘤细胞、食管癌细胞和肺癌细胞中VEGF和bFGF的表达[16-18]。这些结果表明,沙利度胺的抗肿瘤活性可能部分通过调控肿瘤细胞中VEGF和bFGF的表达来实现,但沙利度胺调控VEGF和bFGF的分子机制尚不清楚。
本研究采用RNA干扰技术敲低A549及HepG2细胞中CRBN的表达,探讨沙利度胺对敲低CRBN的 A549细胞及HepG2细胞分泌VEGF/bFGF的影响。本研究显示100 μmol/l沙利度胺对A549细胞的增殖没有明显的抑制作用,也就是说沙利度胺在该浓度下不影响细胞的增殖能力,排除沙利度胺通过抑制细胞增殖来降低VEGF/bFGF的表达。接下来我们的研究发现,在A549和HepG2细胞中,VEGF和bFGF的分泌与CRBN的表达显著相关,而CRBN的下调可以显著降低VEGF和bFGF的表达。沙利度胺可抑制A549和HepG2细胞中VEGF和bFGF的表达[10],这与我们的结果是一致的,而敲低CRBN后对A549和HepG2细胞中VEGF和bFGF的表达的抑制作用消失,表明CRBN在沙利度胺抑制A549和HepG2细胞分泌VEGF/bFGF中发挥重要作用。沙利度胺对血管生成因子的影响是抗血管生成的触发因子,可影响血管内皮细胞的增殖和迁移。前期研究表明沙利度胺可能通过CRBN抑制A549细胞的迁移[19]。
c-Jun是VEGF和bFGF的共同的转录因子[20]。沙利度胺同时抑制VEGF和bFGF的分泌,它们是否受到其共同的转录因子的调控?因此,我们下一步研究的重点是探讨沙利度胺对c-Jun的影响。结果表明在HepG2和A549细胞中,沙利度胺都能抑制c-jun的mRNA转录水平,并且敲低CRBN后c-jun表达都降低,但是只有在HepG2细胞中,敲低CRBN,沙利度胺对c-jun的抑制作用消失,因此HepG2细胞中,c-Jun可能是CRBN介导沙利度胺抑制VEGF和bFGF的转录因子之一。
综上所述,沙利度胺抑制A549和HepG2细胞中VEGF和bFGF的分泌与CRBN有关,在HepG2细胞中,c-jun可能是CRBN介导沙利度胺抑制VEGF和bFGF表达的关键转录因子之一。这一发现提示CRBN可能是沙利度胺抑制VEGF/bFGF分泌的潜在靶点,但CRBN如何介导沙利度胺抑制VEGF/bFGF分泌的机制及其下游信号通路有待进一步研究,研究结果为沙利度胺抑制肿瘤血管生成因子提供新的思路。
