依达拉奉对毒死蜱所致大鼠脑损伤的保护作用及其机制*
2022-08-29林佩瑶秦东旭卢栋泽范徐丽
林佩瑶, 宋 英, 秦东旭, 卢栋泽, 范徐丽
(浙江工业大学药学院, 杭州 310014)
动力相关蛋白1(dynamin-related protein 1, DRP1)在线粒体破裂的过程中起主导作用,表现为DRP1在线粒体受损时聚集于外膜,最终细胞凋亡[7]。依达拉奉(edaravone , ED)是临床上常用的自由基清除剂,其对脑神经的保护作用已得到证实[8],但ED如何通过DRP1改善毒死蜱导致的细胞凋亡仍少见报道。本实验通过皮下注射毒死蜱建立脑损伤模型,用依达拉奉进行治疗,探讨依达拉奉缓解毒死蜱蓄积导致的神经细胞损伤与DRP1蛋白的相关性。
1 材料与方法
1.1 试剂与仪器
毒死蜱 (Chlorpyrifos, 上海阿拉丁), 依达拉奉 (Edaravone, Mitsubishi Chemical Corporation, Janpanse), RIPA裂解液,ATP检测试剂盒 (ATP Assay Kit, 碧云天), ATP酶试剂盒(Adenosinetriphosphatase Assay Kit, 南京建成), GAPDH抗体、DRP1抗体(Abcam, USA)、phospho-DRP1(Ser637) 抗体 (Affinity Biosciences, China), 酶标仪 (型号: speetramaxMZe, MoleeularDevices , USA), 透射电子显微镜 (型号: H7650, HITACHI, Janpanse) 等。
1.2 实验动物饲养
体重在220~250 g之间的成年健康雄性SD(Sprague Dawley)大鼠,清洁级,浙江省医学科学院实验动物中心(SCXK-2019-0002)。所有动物在RT 25℃,湿度50%,保持12 h光明和黑暗交替的环境下饲养1周。本研究经浙江工业大学实验动物伦理委员会审查批准。
1.3 毒死蜱脑损伤模型的建立
通过随机分组,将大鼠分为对照组(Control), 毒死蜱组(Model),依达拉奉组(ED)。橄榄油溶解毒死蜱后,连续28 d以18 mg/kg的剂量将其皮下注射于大鼠颈部[9,10]。在28 d内,依达拉奉组在注射毒死蜱1 h后,通过腹腔注射纯度为99%的依达拉奉(10 mg/kg)[11]予以治疗。
1.4 行为学检测
1.4.1 旷场试验 实验进行28 d后,在黑色不透明钢板制成的干净无味箱子 (大小为45 cm×45 cm×50 cm) 中进行试验。每次将大鼠沿箱壁放入,并允许自由探索3 min,整个实验过程的动物行为记录在ANY-maze分析系统中。
1.4.2 Morris水迷宫 旷场实验结束后,将大鼠置于直径1.2 m,高0.5 m的圆形黑色水池中,水温保持在23℃左右。设置四个象限,每个象限各有一个参照物。水上逃生平台直径0.14 m,高0.3 m,低于液面1 cm左右,置于第Ⅱ象限。摄像头置于水池上方,实时录像。每次从四个象限内背对实验者抛入,训练其2 min内找到逃生平台,训练4 d后,通过ANY-maze系统分析评判大鼠的学习记忆能力。
1.5 HE染色
用生理盐水和4%多聚甲醛进行心脏灌注,取脑组织浸入石蜡,4 μm切片。HE染色光镜下观察病理损伤。
1.6 透射电镜观察神经元细胞
同上,取脑组织用2.5%(0.025 g/ml)戊二醛固定,4℃过夜,次日按标准程序包埋并超薄切片,在透射电镜下观察细胞凋亡和线粒体形态。
企业在实际发展中经常会出现用户或是顾客对商家不满意或是满意客户不忠诚的情况,这一问题也有效表明顾客满意度对其忠诚度并不能产生直接影响,受到各种因素的影响也比较显著。比如顾客满意度如果能保持在合理水平上,顾客忠诚度也会受到转换成本的影响和限制。
1.7 线粒体损伤相关生化指标检测
每20 mg大鼠脑组织样品加入100~200 μl裂解液进行裂解匀浆,把匀浆组织液转移至离心机后,4℃、12,000 g 离心 5 min,取上清液。根据试剂盒说明书步骤得到ATP含量和Na+-K+-ATP酶活力。用BCA试剂盒检测蛋白质浓度。
1.8 Western blot检测
提取部分大鼠脑组织蛋白,变性后,电泳分离,转膜封闭,4℃下孵育兔抗DRP1多克隆抗体(1∶ 1 000)、兔抗phospho-DRP1(Ser637) 多克隆抗体(1∶1 000),过夜。次日,室温下孵育山羊抗兔二抗(1∶5 000)2 h,显影。
1.9 免疫组织化学
将大鼠脑组织石蜡切片水化,柠檬酸抗原修复,BSA封闭,滴加一抗和二抗。DAB显色,HE再染后,光镜观察。
1.10 统计学处理
2 结果
2.1 依达拉奉对毒死蜱损伤大鼠的学习记忆能力的影响
如图1和表1所示,旷场试验中,与Control组比,Model组运动轨迹较短,在旷场中运动总距离缩短(P<0.01),平均速度下降(P<0.01)。而经依达拉奉给药后,ED组大鼠活动更频繁,运动距离与平均速度有显著改善 (P<0.05)。

Fig. 1 Edaravone improves the ability of learning and memory in rats
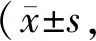
Tab. 1 The total movement distance and average speed of the rats in each group in the open field test n=6)
如图2和表2所示,水迷宫试验中,与Control组比较,Model组活动轨迹较复杂且逃避潜伏期增长(P<0.01),1 min内穿越平台次数明显减少(P<0.01)。经依达拉奉治疗后,大鼠活动轨迹简单,逃避潜伏期明显缩短(P<0.01),穿越平台次数显著增加(P<0.01)。
Fig. 2 Edaravone improves the ability of learning and memory in rats
Tab. 2 The crossing-target number and the escape latency of rats in each group crossed the platform in the water maze n=6)
2.2 依达拉奉对毒死蜱诱导的大鼠脑组织病理损伤的影响
如图3所示,Control组海马CA1、CA3、DG区神经元分布整齐、密集,神经元细胞核和细胞质清晰可见,胞浆浅染。与对照组相比,毒死蜱损伤组海马区域的正常细胞含量减少,且分布不规则,主要表现为细胞边界不清、胞浆减少或消失,可见CA3区损伤。依达拉奉给药后,与Model组相比,ED组大鼠CA3区神经细胞损伤程度明显减轻,神经细胞分布较为整齐,胞浆浅染增多。

Fig. 3 Edaravone protected against Chlopyrifos induced hippocampal injury in SD rats (n=3)
2.3 依达拉奉对毒死蜱诱导大鼠脑细胞损伤的影响
如图4所示,Control组细胞核核膜正常,线粒体内嵴完整。Model组核膜破裂,染色质断裂凝集,核固缩;且线粒体内嵴断裂。经ED给药后,大鼠脑组织中细胞核膜相对完整,正常线粒体的数量增加,线粒体膜破裂与嵴断裂的现象也明显减少。

Fig. 4 Determination of mitochondrial and cell nucleus damage levels (n=3)
2.4 依达拉奉对毒死蜱诱导脑损伤大鼠的Na+-K+-ATP酶活性与ATP含量的影响
通过检测细胞内Na+-K+-ATP酶活性和ATP含量来评价线粒体供能状况。如表3所示,与Control相比,反复暴露于毒死蜱的大鼠脑组织中Na+-K+-ATP酶活性与ATP含量明显降低(P<0.01,P< 0.05)。而经ED给药治疗后,钠钾ATP酶活性恢复(P<0.01),三磷酸腺苷含量也明显升高(P< 0.05)。提示ED对于CPF导致的线粒体功能障碍具有显著的治疗作用。

Tab. 3 Determination of mitochondrial damage levels (%, n=6)
2.5 依达拉奉对毒死蜱诱导脑损伤大鼠DRP1- Ser637位点的磷酸化表达及线粒体损伤的影响
采用免疫组化探究各组DRP1蛋白及其Ser637位点的磷酸化表达,结果如图5和表4所示:线粒体分裂蛋白DRP1在各组大鼠脑组织中均有棕色显色。DRP1的Ser637位点的磷酸化蛋白棕色显色在Model组中明显减少 (P<0.05),但这种趋势在经ED给药后得到显著性逆转(P<0.05)。
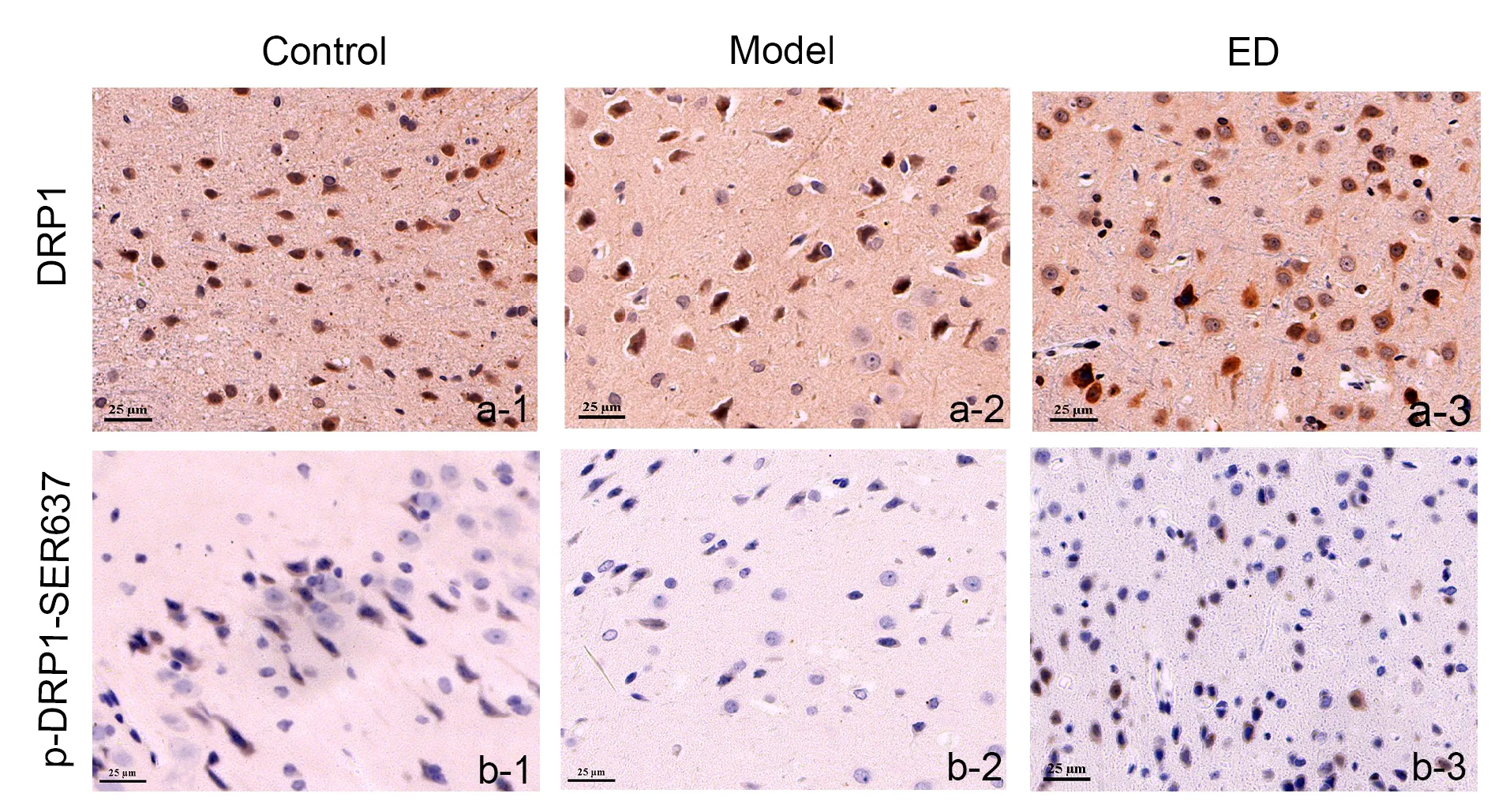
Fig. 5 The effects of ED on the expressions of DRP1 and p-DRP1-Ser637
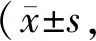
Tab. 4 Mean optic density of DRP1 and p-DRP1 -Ser637 and the ratio of relative levels of p-DRP1-Ser637 and DRP1 of rat among different groups n=3)
采用免疫印迹法探究各组DRP1蛋白及其Ser637位点的磷酸化表达,结果如图6和表4所示,以DRP1蛋白表达量为参照,p-DRP1-Ser637在Model组表达显著减少(P<0.01),依达拉奉组表达明显增多(P<0.01)。

Fig. 6 The expressions and ratio of p-DRP1-Ser637 and DRP1 in each group
3 讨论
在我国,毒死蜱作为广谱杀虫剂,被广泛用在各种作物的种植。但长期地暴露在低浓度的毒死蜱中,对人类的健康产生了影响。研究表明,毒死蜱作用孕鼠或新生小鼠会引发中枢神经发育障碍,同时影响神经轴突运输和神经元功能[10]。除此之外,长期暴露于毒死蜱将增加患帕金森和阿尔兹海默症的风险[12]。我们之前的体外研究表明,200 μmol/L下的毒死蜱会诱导PC12细胞的凋亡[13];徐等人发现,15 mg/kg 的毒死蜱会改变大鼠脑组织线粒体的超微结构,降低线粒体电位,干扰细胞抗氧化能力,导致细胞凋亡[14]。本研究中发现长期皮下注射毒死蜱,SD大鼠的学习记忆、运动能力明显下降。正常生理情况下,海马CA3区是控制大脑学习、记忆及运动的重要区域。动物脑组织苏木素染色显示毒死蜱组海马CA3区被破环,神经元数量显著减少。这提示长期暴露于毒死蜱会导致大脑神经细胞的损伤。
线粒体是生成ATP的主要场所,能量产生需要氧化磷酸化,而线粒体发生氧化磷酸化是依靠正常的形态和生物活性。在本研究中,我们在电镜下观察到毒死蜱组线粒体损伤,伴随着ATP含量和Na+-K+-ATP酶活性下降。
DRP1是一种胞浆动力蛋白样GTP酶[15],是调控线粒体裂变的主要蛋白,同时也介导线粒体依赖性细胞凋亡:在氧化应激刺激下,它被募集到线粒体上,引起线粒体肿胀和外膜上通透性转换孔的大量开放,继而提高线粒体膜通透性并引起细胞色素酶C的大量释放。Cyt C作用于凋亡酶激活因子(apoptotic protease activating factor-1, Apaf-1)、催化天冬氨酸蛋白水解酶-9,激活天冬氨酸蛋白水解酶-3,最终细胞凋亡[16]。但DRP1的活性受蛋白翻译后修饰的调节,其Ser637位点被磷酸化后,可抑制DRP1向线粒体膜的转运,减少线粒体碎片化从而保护细胞[17]。我们通过电镜观察到毒死蜱组细胞核和线粒体形态明显改变;进一步用免疫组化及免疫印迹反映DRP1的Ser637位点磷酸化表达情况,发现毒死蜱抑制了DRP1的Ser637位点磷酸化表达,从而促进线粒体损伤和细胞凋亡。
依达拉奉是临床中常用的脑保护药物。在此前的研究中,我们发现依达拉奉能通过抑制5-脂氧合酶 (5-LOX)的激活来维持线粒体的超微结构,保护神经元免受缺血损伤[18];同时依达拉奉能通过NRF2减轻毒死蜱对PC12细胞的氧化应激损伤[19]。此外,依达拉奉的预防给药具有抗炎作用,抑制肺中毒小鼠的细胞凋亡[20]。但是依达拉奉通过DRP1分子保护线粒体,减少细胞凋亡的研究较少。我们这次实验侧重探究毒死蜱损伤下,依达拉奉与线粒体DRP1蛋白的关系。结果发现,依达拉奉使线粒体碎片化减少、细胞核形态恢复正常;也促进了DRP1蛋白的Ser637位点磷酸化表达。因此,依达拉奉通过抑制线粒体分裂,保护神经元细胞的作用得以证实。
综上,本文的研究发现,依达拉奉通过促进DRP1的Ser637位点磷酸化的表达减轻毒死蜱所致大鼠脑损伤。这为治疗毒死蜱所致中枢神经病变提供新的实验思路,同时我们也希望进行更深入研究来探讨依达拉奉促进p-DRP1-Ser637表达的潜在途径。
