基于lncRNA NEAT1与Nrf2/ARE通路研究荣筋拈痛方延缓膝骨关节炎软骨退变作用机制
2022-08-29付长龙谢新宇邱志伟黄艳峰金灵璐李西海
付长龙,谢新宇,邱志伟,黄艳峰,金灵璐,李西海
1 福建中医药大学中西医结合研究院,福建福州 350122;2 福建省中西医结合老年性疾病重点实验室,福建福州 350122;3 福建中医药大学中西医结合学院,福建福州 350122
膝骨关节炎(knee osteoarthritis,KOA)是一种因生物因素及力学异常等引起关节结构与组织形态紊乱,致使膝关节功能退变乃至丧失的关节疾病[1]。其显著的病理表现为关节软骨变性、退化,滑膜炎性浸润以及继发性骨赘形成,临床常表现为患膝关节的慢性疼痛、屈伸活动不利等症状,病程后期还可出现关节活动受限甚至致残,严重危害中老年人的健康[2-3]。KOA 归属于中医“膝痹”范畴,其病位在骨,历代医家认为其病机主要与肝、肾亏虚,筋骨失养等密切相关,病机属性为本虚标实,本痿标痹,故对其治则宜行补肾柔肝、除痹消痛之法[4-7]。
课题组前期从《清宫配方集成》中筛选治疗KOA 的高频、核心用药组方,以中医“肝主筋、肾主骨”理论为核心,重新组方成荣筋拈痛方。该方经国医大师陈可冀院士审定,由牛膝、当归、独活、羌活、防风、甘草组成,用于临床治疗KOA 具有良好疗效[8]。通过计算机分子模拟技术分析发现,荣筋拈痛方治疗KOA 的作用机制可能与核因子NF-E2 相关因子/抗氧化元件(nuclear factor-erythroid 2-related factor 2/antioxidant response element,Nrf2/ARE)信号通路相关[9]。KOA软骨受炎性因子影响导致软骨中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达升高从而激活Nrf2/ARE 通路。其中,Kelch 样ECH 相关蛋白1(kelch-like ECH-associated protein 1,Keap1)是Nrf2/ARE 通路中的关键调控因子,激活通路后引起下游血红素加氧酶1(heme oxygenase-1,HO-1)、NAD(P)H醌氧化还原酶-1[NAD(P)H:quinone oxidoreductase-1,NQO-1]表达变化。研究证实,长链非编码RNA(long noncoding RNA,lncRNA)在KOA 病理进程中发挥了重要调控作用[10-11],其中,lncRNA NEAT1 在骨关节炎软骨中表达上调,并促进软骨细胞凋亡,加剧软骨变性[12-13]。研 究 表 明,lncRNA NEAT1 可 以 调 节Nrf2/ARE 通路[14]。因此,本研究基于前期临床及网络药理学研究基础,观察荣筋拈痛方对KOA 模型大鼠lncRNA NEAT1 及Nrf2/ARE 通路的影响,探讨该方延缓膝骨关节炎软骨退变的机制,为其临床应用提供科学依据。
1 材料与方法
1.1 实验动物
选择SPF 级2 月龄雄性SD 大鼠45 只,体质量(300±10)g,由上海斯莱克实验动物有限责任公司提供[实验动物生产许可证号:SCXK(沪)2017-0005];饲养于福建中医药大学实验动物中心[使用许可证号:SYXK(闽)2019-0007],实行分笼饲养,自由饮水,标准饲料喂养。
1.2 实验药物
荣筋拈痛方颗粒(江阴天江药业有限公司,规格:9.5 g/袋,生产批号:2006001),将其溶于100 mL生理盐水中,配制成浓度为0.095 g/mL 的荣筋拈痛方溶液。
1.3 主要试剂与仪器
苏木素-伊红(北京索莱宝科技有限公司);苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、RIPA 裂解液(radio immuno precipitation assay)、蛋白上样缓冲液、10×电泳液(上海碧云天生物技术有限公司);10×Tris-HCl 缓冲盐溶液-吐温(10×Tris buffered saline-tween,10×TBST,北京索莱宝科技有限公司);Nrf2抗体、HO-1抗体、Keap1抗体、iNOS抗体(武汉三鹰生物技术有限公司)、NQO-1 抗体(博士德生物工程有限公司),GAPDH(美国Signalway Antibody有限公司);HiScript Ⅱ1st Strand cDNA Synthesis Kit、ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司);LncRNA NEAT1(Forward:TGGCTAGCTCAGGGCTTCAG,Reverse:TCTCCTTGCCAAGCTTCCTTC)、GAPDH(Forward:ACGGCAAGTTCAACGGCACAG,Reverse:GAAGACGCCAGTAGACTCCACGAC)引物(福州尚亚生物技术有限公司);微量紫外分光光度计(美国Thermo Fisher Scientific 公司,NanoDrope 2000);荧光定量PCR仪(美国Bio-Rad公司,CFX96)。
1.4 实验方法
1.4.1 实验分组及动物造模 45 只大鼠适应性喂养1 周后,采用随机数字表法分为空白组和碘乙酸钠组,每组分别15 只、30 只。采用2 %戊巴比妥钠(40 mg/kg)麻醉后,右侧膝关节腔注射20 mg/mL 碘乙酸钠0.05 mL,空白组注射等量生理盐水。术后1 周可见大鼠活动频率下降,驱赶运动时出现跛行,大鼠膝关节肿胀,表明成功复制KOA 模型[15]。造模后的碘乙酸钠组采用随机数字表法分为模型组和荣筋拈痛方组,每组15 只。按临床等效剂量换算[16],荣筋拈痛方组的灌胃剂量为1.9 g/(kg·d),即0.095 g/mL 的荣筋拈痛方溶液10 mL/d,分早晚2 次灌胃,连续灌胃8周,灌胃剂量依据大鼠体质量每周计算调整;空白组和模型组给予等量生理盐水灌服。
1.4.2 组织取材与处理 末次灌胃结束后,采用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,仰卧位固定,剪开表皮直至暴露出以右膝关节为中心约3 cm×3 cm 的区域。去除骨组织表面附着的肌肉及各种结缔组织,切开韧带小心打开关节腔,注意刀口避免划伤软骨组织表面。每组随机选择3只切取右侧股骨置于多聚甲醛中固定以备后续HE 染色。收集其余大鼠右膝关节表面的软骨组织,置于液氮中转移至-80 ℃冰箱,以备后续进行基因及蛋白检测。
1.5 观察指标
1.5.1 软骨组织病理改变 采用HE 染色法观察各组大鼠右膝软骨组织病理改变情况。常规制备大鼠股骨内侧髁组织石蜡标本,组织切片后进行常规脱蜡复水,苏木精浸染10 min,流水轻柔漂洗1 min,快速返蓝(1%盐酸乙醇溶液)2 s,再经0.5%伊红染液浸染5 s,封固(中性树脂)后进行镜下观察并拍照。
1.5.2 软骨组织Nrf2/ARE 通路蛋白表达情况 采用Western blot 法检测各组大鼠软骨组织中Nrf2、HO-1、NQO-1、Keap1、iNOS 蛋白含量。提取各组软骨组织总蛋白,BCA 蛋白定量,配制12%分离胶和5%浓缩胶,上样后进行电泳,采用半干式进行转膜,脱脂牛奶封闭2 h 后洗膜,再将各条膜放入预先配置好的Nrf2、HO-1、NQO-1、Keap1、iNOS 的一抗中置于4°C 冰箱摇床过夜进行充分震荡反应,次日取出一抗,洗膜后加入二抗,待二抗反应处理后,使用ECL 发光液进行显影,于凝胶成像仪下进行曝光成像,最后分析储存。
1.5.3 软骨组织lncRNA NEAT1 表达情况 采用实时PCR 法检测各组大鼠软骨组织中lncRNA NEAT1表达水平。将软骨组织研磨后,采用Trizol 法提取总RNA,微量紫外分光光度计检测各样本RNA浓度(g/L)和A260/A280 值。根据反转录试剂盒说明书,取1 μg 总RNA 反转录成cDNA,反转录条件:55 ℃15 min,85 ℃5 s,4 ℃。以1 μL cDNA 为模板扩增lncRNA NEAT1。扩增反应条件:95 ℃5 min;95 ℃10 s,60 ℃30 s,40 个循环。以GAPDH为内参照基因,计算目的基因2-ΔΔCt,比较分析各组lncRNA NEAT1水平变化。
1.6 统计学方法
采用SPSS 22.0 统计软件进行数据分析。计量资料符合正态分布,数据采用(±s)表示,组间比较采用方差分析,若方差齐,两两比较采用LSD-t法;若方差不齐,两两比较则采用Games-Howell 法。P<0.05为差异具有统计学意义。
2 结 果
2.1 3组大鼠软骨组织病理改变情况
HE 染色结果显示,空白组大鼠软骨组织切线层连续且完整,细胞质及其基质成分分布均匀且着色浅红,移行层中软骨细胞纵向条索状分布且排列规律,辐射层、钙化层结构完整且清晰;模型组软骨组织切线层发生破坏,纤维方向出现偏移、变薄,软骨细胞外露且抱团簇集生长,移行层与辐射层的软骨细胞呈无序分布排列状态,部分软骨细胞出现钙化,钙化层软骨细胞钙化现象明显,钙化层与软骨下骨间的黏合线起伏较大,且连续性部分中断;荣筋拈痛方组的切线层与关节面基本平行且完整,移行层、辐射层、钙化层及其他层次相对清晰可辨。见图1。
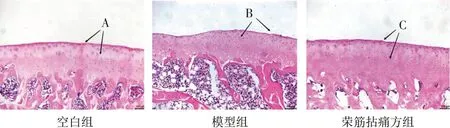
图1 软骨组织HE染色图(×200)Figure 1 HE staining results of cartilage tissue(×200)
2.2 3 组大鼠关节软骨组织中Nrf2/ARE 通路相关蛋白表达比较
Western blot 结果显示,与空白组比较,模型组Keap1、iNOS 蛋白表达明显升高(P<0.05),Nrf2、HO-1、NQO-1 蛋白表达明显降低(P<0.05);与模型组比较,荣筋拈痛方组Keap1、iNOS蛋白表达明显更低(P<0.05),Nrf2、HO-1、NQO-1 蛋白表达明显更高(P<0.05)。这提示荣筋拈痛方可上调Nrf2 信号及抗氧化信号分子表达,下调促氧化信号分子表达。见表1、图2。
表1 3组大鼠关节软骨中Nrf2/ARE通路相关蛋白表达比较(±s)Table 1 Comparison of Nrf2/ARE pathway related protein expression in articular cartilage in three groups(±s)
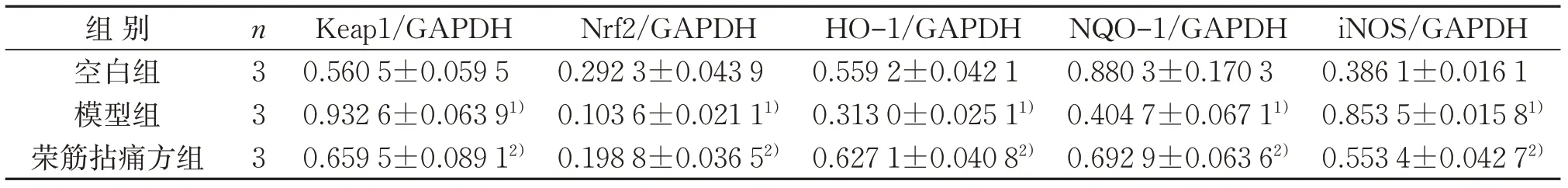
表1 3组大鼠关节软骨中Nrf2/ARE通路相关蛋白表达比较(±s)Table 1 Comparison of Nrf2/ARE pathway related protein expression in articular cartilage in three groups(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05。Note:Compared with the blank group,1)P<0.05;compared with the model group,2)P<0.05.
组别空白组模型组荣筋拈痛方组n333 Keap1/GAPDH 0.560 5±0.059 5 0.932 6±0.063 91)0.659 5±0.089 12)Nrf2/GAPDH 0.292 3±0.043 9 0.103 6±0.021 11)0.198 8±0.036 52)HO-1/GAPDH 0.559 2±0.042 1 0.313 0±0.025 11)0.627 1±0.040 82)NQO-1/GAPDH 0.880 3±0.170 3 0.404 7±0.067 11)0.692 9±0.063 62)iNOS/GAPDH 0.386 1±0.016 1 0.853 5±0.015 81)0.553 4±0.042 72)
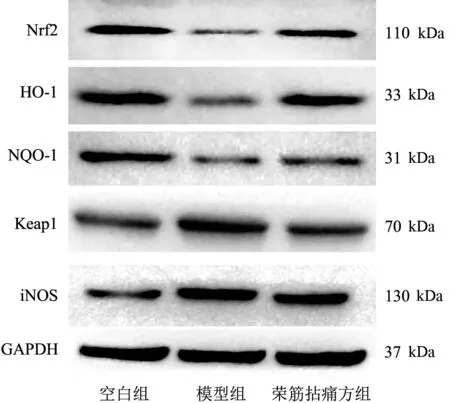
图2 3组大鼠关节软骨中Nrf2/ARE通路相关蛋白条带图Figure 2 Protein strip diagram of Nrf2/ARE pathway indicator in articular cartilage in three groups
2.3 3 组大鼠关节软骨组织中lncRNA NEAT1 水平比较
Real-time PCR 结果显示,与空白组比较,模型组lncRNA NEAT1 水平明显升高(P<0.05)。与模型组比较,荣筋拈痛方组lncRNA NEAT1 水平明显降低(P<0.05)。见表2。
表2 3组大鼠关节软骨组织中lncRNA NEAT1水平比较(±s)Table 2 Expression of lncRNA NEAT1 in articular cartilage in three groups(±s)

表2 3组大鼠关节软骨组织中lncRNA NEAT1水平比较(±s)Table 2 Expression of lncRNA NEAT1 in articular cartilage in three groups(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05。Note:Compared with the blank group, 1) P<0.05; compared with the model group,2)P<0.05.
组别空白组模型组荣筋拈痛方组n333 NEAT1/GAPDH 1 1.799 8±0.085 11)1.451 6±0.109 52)
3 讨 论
3.1 KOA 大鼠关节软骨退变可能与氧化应激反应有关
本研究结果显示,HE 染色可观察到模型组大鼠软骨变薄、细胞无序分布,这提示模型组关节软骨发生明显退行性改变,与GUZMAN 等[17-18]研究一致。此外,本研究结果显示,模型组软骨组织中lncRNA NEAT1 水平升高,Keap1、iNOS 蛋白含量显著升高,Nrf2、HO-1、NQO-1 蛋白含量显著降低,提示氧化应激反应参与KOA 大鼠关节软骨退变。这可能与以下因素有关:①生理条件下软骨中低水平ROS 有助于维持软骨细胞稳态及功能,而KOA 软骨受到炎性因子诱导后iNOS 表达高度上调并产生大量的ROS。过量ROS 会激活核因子κB 途径增加炎症,同时抑制细胞外基质合成并诱导基质降解蛋白酶表达,诱导软骨细胞凋亡最终导致软骨降解[19-21]。②过度产生ROS会导致软骨细胞氧化应激,激活以Nrf2/ARE通路为代表的抗氧化应激防御系统。Keap1具有氧化还原感受器功能,非氧化应激时与Nrf2 结合,氧化应激时则与Nrf2 解离引起下游HO-1、NQO-1 表达升高以及时清除过量的ROS,产生抗氧化效果[22-23]。而KOA 软骨中Nrf2 表达失调,同时HO-1、NQO-1 表达受炎症因子抑制,不能有效清除细胞中的过量ROS,最终导致关节软骨降解[24]。③Nrf2/ARE 通路的表达也同时受非编码RNA 的调控[25]。其中lncRNA NEAT1 在OA 软骨中高表达,且与调节Nrf2/ARE通路相关[26-27]。lncRNA NEAT1 调节的Nrf2/ARE 信号通路是延缓KOA 软骨退变的潜在途径。
3.2 荣筋拈痛方延缓KOA 大鼠软骨退变可能与Nrf2/ARE通路抗ROS作用有关
本研究结果表明,与模型组比较,荣筋拈痛方组大鼠关节软骨退变程度明显减轻,lncRNA NEAT1表达水平下调,Keap1、iNOS 蛋白含量明显降低,Nrf2、HO-1、NQO-1蛋白含量明显升高,这提示荣筋拈痛方延缓KOA 大鼠软骨退变可能与Nrf2/ARE 通路抗ROS作用有关。这可能与以下因素有关:①荣筋拈痛方干预后,软骨组织中iNOS 表达显著降低,细胞中ROS 的产生减少,从而缓解氧化应激反应,延缓OA 软骨退变。②HO-1、NQO-1 是Nrf2 的下游靶蛋白,其表达上调有助于抵抗细胞氧化应激带来的损伤[28-31],荣筋拈痛方作用于Nrf2/ARE 通路,下调Keap1表达,上调Nrf2蛋白表达,调节下游HO-1及NQO-1,通过清除过量ROS、缓解软骨组织氧化应激达到延缓OA软骨退变的疗效。③荣筋拈痛方干预下调软骨组织lncRNA NEAT1 表达,进而调节Nrf2/ARE 通路,促使Keap1 蛋白表达降低,Nrf2、HO-1及NQO-1蛋白表达升高,增强Nrf2/ARE 通路抗ROS 作用以缓解软骨氧化应激,延缓OA 软骨退变。
4 小 结
荣筋拈痛方在延缓KOA 大鼠软骨退变方面具有一定疗效,其机制可能与其下调lncRNA NEAT1水平,上调Nrf2 信号及抗氧化信号分子表达,下调促氧化信号分子表达,抑制氧化应激水平有关。本研究仍存在一些不足,如lncRNA NEAT1 调节Nrf2/ARE 通路的作用机制尚不明确,还需在后续研究中进一步验证明确。
