具有DPP-Ⅳ抑制活性的酪蛋白糖肽分离纯化及其序列鉴定
2022-08-28李琪琪李天歌焦颖泽卢雪娇毛学英
李琪琪,李天歌,焦颖泽,卢雪娇,毛学英
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.河南农业大学食品科学技术学院,郑州 450002)
0 引 言
糖尿病是一种慢性代谢性疾病,该疾病已成为全球性公共卫生问题。目前2 型糖尿病发病率逐年增高,国际糖尿病联盟调查显示2021 年全球有5.37 亿人患有糖尿病,预计到2045 年全球糖尿病患病人数将达到7.83 亿。其中,2021 年中国的成人糖尿病患者数量高达1.4 亿,位居世界第一位[1]。而2 型糖尿病是最常见的糖尿病类型,约占所有糖尿病病例的90%。2 型糖尿病以多种病理缺陷为特征,包括胰岛素抵抗和进行性胰腺β细胞功能障碍,还会导致严重的并发症如糖尿病足病、肾病、视网膜病变、心脑血管疾病等。因此,寻求预防和缓解2 型糖尿病的有效干预措施已引起越来越广泛的关注。
目前2 型糖尿病的治疗以西药为主,主要包括磺脲类、双胍类、噻唑烷二酮类、二肽基肽酶-Ⅳ(dipeptidyl peptidase-IV,DPP-Ⅳ)抑制剂等[2]。DPP-Ⅳ抑制剂可与DPP-Ⅳ酶活性部位的205 位和206 位谷氨酸形成盐桥[3],从而降低DPP-Ⅳ酶的催化活性,提高胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和葡萄糖依赖性胰岛素分泌多肽(glucosedependent insulinotropic peptide,GIP)等肠促胰岛素的浓度,进而通过抑制胰岛α细胞分泌胰高血糖素、促进胰岛β细胞分泌胰岛素、改善胰岛β细胞存活、再生和增殖等发挥降低血糖、保护胰岛α细胞和β细胞功能等作用[4]。此外,由于肠促胰岛素的释放依赖于血液中的葡萄糖水平,在低于正常空腹血糖水平的状态下,肠促胰岛素水平并不会显著升高,因此DPP-IV抑制剂可以有效减少低血糖的发生风险[5-7]。DPP-Ⅳ抑制剂的有效性已经经过了体外细胞实验、动物实验和临床试验的验证。如Liu 等证明了在16.7 mmol/L葡萄糖和10 nmol/L GLP-1 作用下,DPP-IV 抑制剂维格列汀(100 nmol/L)使INS-1 832/13 细胞中葡萄糖刺激的胰岛素分泌(glucose stimulated insulin secretion ,GSIS)增加了22.0%[4]。Mu 等用DPP-IV 抑制剂去氟西格列汀治疗胰岛素分泌缺陷小鼠,可显著增加离体胰岛的胰岛素含量,改善葡萄糖刺激的胰岛素分泌[8]。在临床环境中,DPP-IV 抑制剂阿格列汀单药或与其他药物联合使用可以显著改善2 型糖尿病患者的血糖控制[9]。但是临床研究表明,这些化学合成的DPP-Ⅳ抑制剂会引起头痛、眩晕、外周性水肿、肝功能异常等副作用[10]。因此,亟需寻找天然、无副作用的活性物质作为化学合成DPP-Ⅳ抑制剂的替代物。
生物活性肽因其安全性高、副作用低、生物活性多样化而受到人们的关注[11-12]。天然食物蛋白经体外蛋白酶水解或体内消化道酶水解后,会产生许多具有生理作用的活性肽,对人体发挥多种生理调节作用[13]。其中,来源于牛乳酪蛋白、牛乳乳清蛋白、牦牛乳、骆驼乳等的水解物和活性肽已被证明具有良好的DPPIV 抑制活性[14-18]。根据文献报道,DPP-IV 抑制肽具有一些共同特点:(1)疏水性氨基酸含量较高;(2)序列中有脯氨酸或丙氨酸,并且优先分布在N 端的第二位上,这是因为DPP-IV 能优先裂解氨基末端第二位上含有脯氨酸残基或丙氨酸残基的多肽。但是其两侧的氨基酸类型也会影响多肽对DPP-IV 的抑制活性;(3)氨基酸序列长度也会影响其活性,DPP-IV 抑制肽长度多为2-8 个氨基酸残基[5-6,18-19]。牛乳酪蛋白糖巨肽是一种含有唾液酸的糖肽[20],来源于κ-酪蛋白C-末端残基106-169 区域,具有两亲性,富含疏水性的支链氨基酸(Leu、Val、Ile)。我们课题组前期研究发现酪蛋白糖巨肽酶解物及活性肽段在体内和体外能够通过调控胰岛素信号缓解胰岛素抵抗,从而进一步改善2 型糖尿病的发生发展[21-23]。然而,关于酪蛋白糖巨肽酶解物的DPP-IV 抑制活性及其DPP-IV 抑制肽的分离鉴定尚待研究。
因此,本研究以牛乳酪蛋白糖巨肽为原料酶解制备牛乳酪蛋白糖巨肽酶解产物(即酪蛋白糖肽),以其DPP-IV 抑制活性为指标,筛选DPP-IV 抑制活性最高的酶解产物,并对其进行分离鉴定,旨在为功能性乳配料的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
牛乳酪蛋白糖巨肽,丹麦Arla 公司;风味蛋白酶,丹麦诺维信公司。
氢氧化钠(分析纯)、盐酸(分析纯)、三氯乙酸(TCA)(分析纯)、Tris 粉末(分析纯),北京化工厂;DPP-Ⅳ、Gly-Pro-PNA,美国Sigma 公司。
1.2 仪器与设备
BS124S 电子天平,赛多利斯科学仪器(北京)有限公司;DK-8D 电热恒温水槽,上海一恒科技有限公司;JJ-1 精密定时自动搅拌器,江苏省金坛市荣华仪器制造有限公司;FE28 pH 计,梅特勒-托利多仪器(上海)有限公司;SC-3612 低速离心机,安徽科大中佳;DRP-9082 电恒温培养箱,上海森信;iMark 酶标仪,Bio-Rad Laboratories,Inc.;LGJ-72 冷冻干燥机,北京松源华兴科技仪器有限公司;BSZ-100 自动收集器,苏州江东精密仪器有限公司;HL-2S 恒流泵,上海嘉鹏科技有限公司;UV-2600 紫外可见分光光度计,日本岛津有限公司。
1.3 实验方法
1.3.1 牛乳酪蛋白糖肽的制备
参考Li 等[24]的方法利用风味蛋白酶水解牛乳酪蛋白糖巨肽。具体为,称取一定量的牛乳酪蛋白糖巨肽,按底物浓度5%(w/v)加水,在室温下充分溶解。将温度和pH 值调节至蛋白酶的最适温度和最适pH值,按酶与底物的比例为5%(w/w)加入蛋白酶进行水解,水解在恒温水浴锅中进行,在水解过程中维持体系pH 不变。分别于水解后0.25、0.5、0.75、1、2、3、4、5 h取样,85 ℃灭酶20 min 终止反应,4 000 r/min 离心20 min 取上清液,冻干后待用。
1.3.2 牛乳酪蛋白糖肽DPP-Ⅳ抑制活性测定
参考Song 等[25]的方法。将冻干样品用100 mmol/L Tris-HCl(pH 8.0)配制成10 mg/mL 溶液。取20 μL样品溶液和100 μL 底物Gly-Pro-pNA 溶液于96 孔板上,在37 ℃培养箱中孵育10 min,再加入30 μL DPP-Ⅳ溶液,在37 ℃孵育40 min,使酶标仪在405 nm处测定吸光值。同时设置空白对照组,阴性对照组以及阳性对照组。
1.3.3 牛乳酪蛋白糖肽水解度测定
参考Ma 等[26]的方法。吸取0.5 mL 已灭酶的样品,冷却后转移至25 mL 容量瓶中,用质量浓度为10 mg/mL的十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)溶液定容,静置。取0.125 mL 酶解液的SDS 溶液与1 mL磷酸盐缓冲液(pH 8.2,0.2 mol/L)和1 mL 质量浓度为1 mg/mL 的三硝基苯磺酸溶液振荡混合,于50 ℃避光水浴反应60 min,反应完毕后,用2 mL 0.1 mol/L HCl 溶液立即终止反应。室温放置30 min 后,于波长420 nm 处测定其吸光度。利用0~5.0×10-3mol/L L-亮氨酸绘制标准曲线。
1.3.4 牛乳酪蛋白糖肽氨基酸组成测定
使用氨基酸分析仪测定牛乳酪蛋白糖肽的氨基酸组成[27]。样品前处理方法:准确称取10~20 mg 试样于水解管中,加入10~15 mL 6 mol/L 盐酸溶液和苯酚3~4 滴,放入冷冻剂中冷冻3~5 min,重复抽真空-充入氮气3 次,在充氮气状态下封口,放在110±1 ℃的水解炉内水解22 h,冷却至室温,将水解液定容至50 mL。准确吸取1.0 mL 滤液移入15 mL 试管内,在40~50 ℃加热环境下减压蒸干。用1.0~2.0 mL pH 2.2 柠檬酸钠缓冲溶液溶解样品,过0.22 μm 滤膜上样。
1.3.5 牛乳酪蛋白糖肽不同组分的分离
参考Harnedy 等[28]的方法,采用G-25 凝胶过滤层析对酪蛋白糖肽进行分离。具体为,将溶胀好的Sephadex G-25 介质填充到层析柱中,用去离子水进行平衡。酪蛋白糖肽溶液经0.22 μm 滤膜除去杂质,样品进样量为1 mL,洗脱剂为去离子水,洗脱流速为1 mL/min,在220 nm 波长下进行检测。收集各洗脱峰,冷冻干燥。
1.3.6 牛乳酪蛋白糖肽的纯化及氨基酸序列鉴定
通过RP-HPLC 对酪蛋白糖肽DPP-IV 抑制活性较高组分进行纯化,得到不同保留时间的样品,测定其DPP-IV 抑制活性,再利用LC-ESI-MS/MS 对DPPIV 抑制活性最强的分离组分进行分析,鉴定具有DPP-IV 抑制活性的牛乳酪蛋白糖肽的氨基酸序列。
RP-HPLC 条件:色谱柱:C18 柱(250×4.6 mm,5 μm);流动相A:乙腈,流动相B:超纯水;流量:0.5 mL/min;进样量:5 μL;检测波长:220 nm。
1.4 数据处理
试验至少重复3 次,取其平均值,结果以平均值±标准偏差(x ± SD)表示。采用SPSS 19.0 软件对数据进行分析,当P<0.05 时认为具有统计学差异。
2 结果与分析
2.1 酪蛋白糖巨肽酶解产物(酪蛋白糖肽)对DPP-Ⅳ的抑制作用
酪蛋白糖巨肽不同酶解时间酶解产物的水解度及其DPP-Ⅳ抑制率如图1 所示。由图1 可知,随着水解时间的延长,酪蛋白糖巨肽酶解产物的水解度呈上升趋势,在前30 min 水解时间内变化最为明显,水解60 min 时酶解产物的水解度上升至17.41±0.80%。此后水解度的增长较缓慢,水解5 h 后,酶解产物的水解度达到23.10±0.42%。Gao 等的实验结果也展现出类似的趋势,从0 h 到3 h,水解度随水解时间的延长而增加,且在水解前30 min 水解度的变化幅度最大[29]。此外,为了筛选DPP-IV 抑制活性最高的酶解产物,测定了不同酶解时间酶解产物的DPP-Ⅳ抑制活性,如图1 所示,相比于其他时间点的酶解产物,45 min时获得的酶解产物对DPP-Ⅳ活性的抑制率最高,为54.55±3.65%。该结果的出现可能是因为随着酶解时间的延长,酶解45 min 时产生的DPP-IV 抑制肽进一步被降解为更短的肽段或氨基酸而降低或失去了活性;与此同时,在后续的酶解过程中可能又产生了新的活性肽段。因此,该结果说明在本研究的水解条件下酶解时间为45 min 时水解物中含有更多具有DPP-IV 抑制活性的肽段或者此时酶解物中的肽段DPP-IV 抑制活性最强。已有报道也发现DPP-IV 抑制活性的最高点均出现在酶解过程中的某个时间点而非酶解时间最长的样品[29-31]。因此,本研究选择水解45 min 时获得的酶解产物进行后续实验。
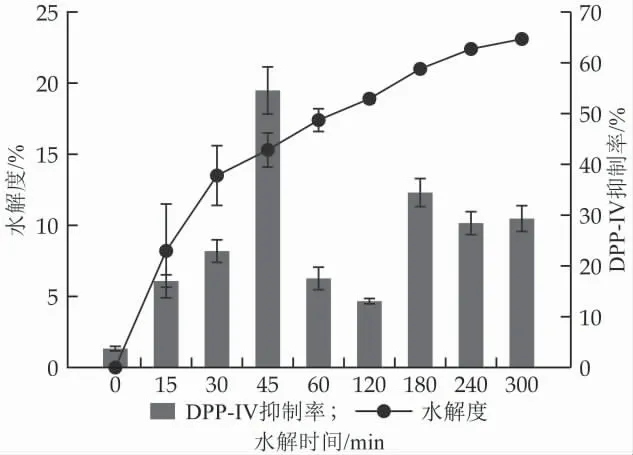
图1 酶解时间对酪蛋白糖巨肽酶解产物水解度及DPP-Ⅳ抑制率的影响
2.2 具有DPP-Ⅳ抑制活性的酪蛋白糖肽的氨基酸组成
具有DPP-Ⅳ抑制活性酪蛋白糖巨肽酶解产物(命名为酪蛋白糖肽)的氨基酸组成如表1 所示。从表中可以看出,酪蛋白糖肽的谷氨酸(Glu)、苏氨酸(Thr)、脯氨酸(Pro)、异亮氨酸(Ile)的含量较高,分别为14.14%、11.53%、7.78%、7.62%。相比于酪蛋白糖巨肽,酪蛋白糖肽的天冬氨酸(Asp)和谷氨酸(Glu)含量明显提高。文献报道表明,具有较高含量的Ile 和Pro 等疏水性氨基酸是DPP-IV 抑制肽的共同特征之一[19]。

表1 酪蛋白糖巨肽及其具有DPP-Ⅳ抑制活性酶解产物的氨基酸组成
2.3 具有DPP-Ⅳ抑制活性酪蛋白糖肽的分离纯化
利用G-25 葡聚糖凝胶柱分离具有DPP-Ⅳ抑制活性酪蛋白糖肽,样品吸光值如图2(a)所示,测定分离组分26~42 号(F1 组分)和43~61 号(F2 组分)的DPP-Ⅳ抑制率,结果如图2(b)所示,相比于未经凝胶柱分离的样品和F2 组分,F1 组分的DPP-Ⅳ抑制率明显提高,达到63.27±3.24% 。因此选用F1 组分进行进一步实验。据报道,活性肽的氨基酸序列长度会影响其DPP-IV 抑制活性[19],在F1 组分中含量可能较高,而F2组分后于F1 组分流出,其中可能含有游离氨基酸。
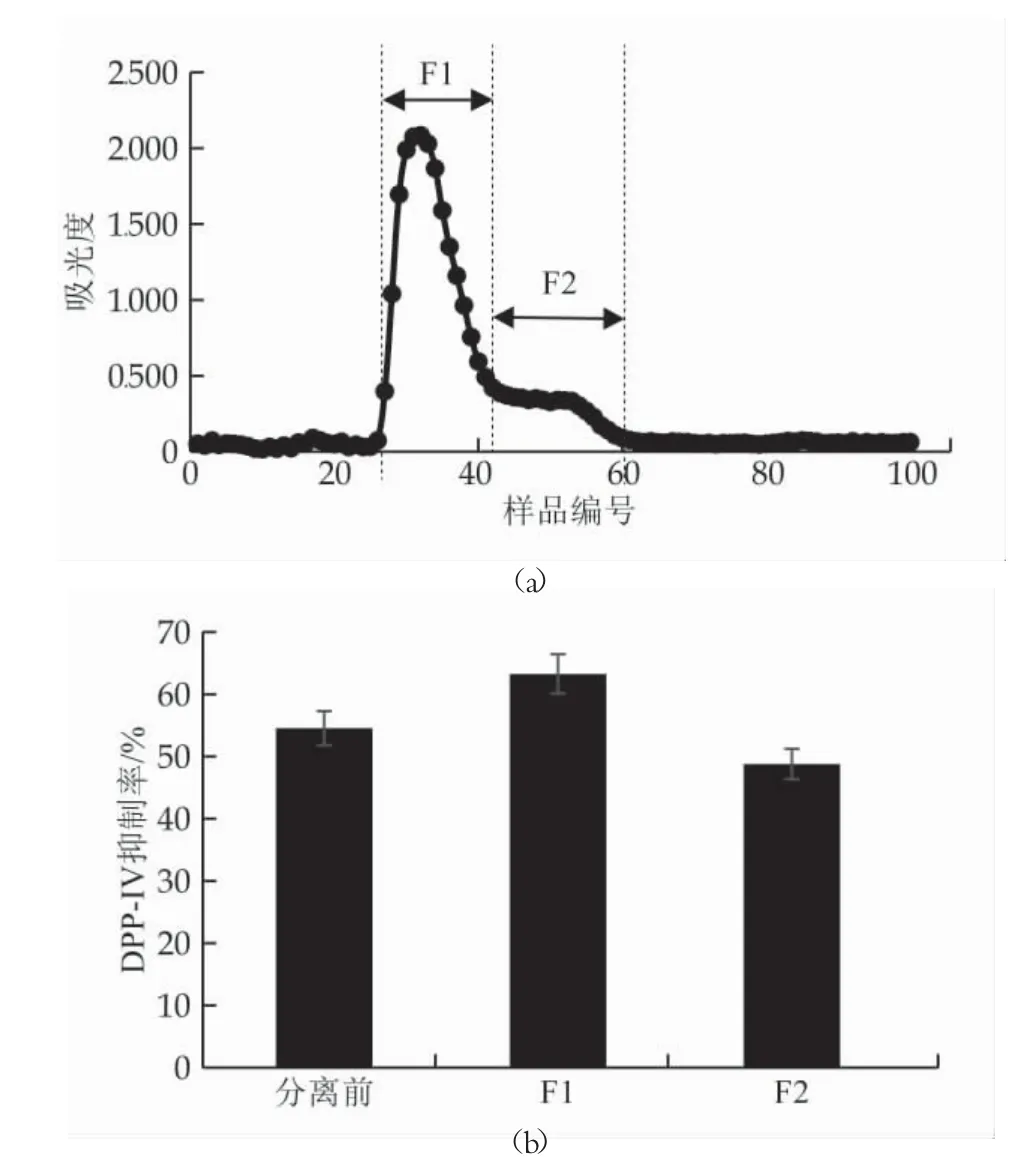
图2 具有DPP-Ⅳ抑制活性酪蛋白糖肽的G-25分离组分及其DPP-Ⅳ抑制率
采用反相高效液相色谱(RP-HPLC)对F1 组分进行进一步分离。F1 组分经RP-HPLC 分离后得到的色谱图,如图3 所示。分离得到2 个峰,保留时间分别为3.33 min 和4.35 min。
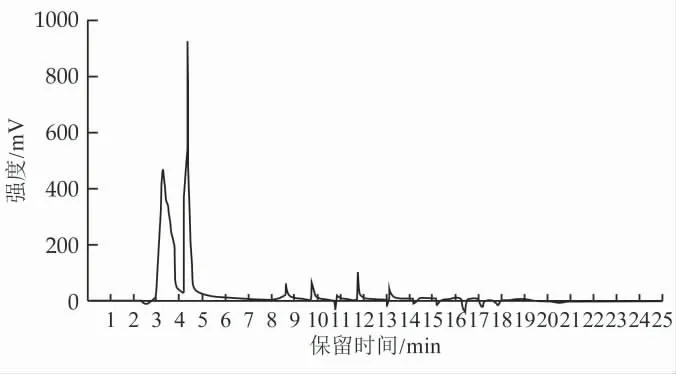
图3 具有DPP-Ⅳ抑制活性酪蛋白糖肽分离组分F1 的RP-HPLC 色谱图
2.4 具有DPP-Ⅳ抑制活性分离组分F1 的氨基酸序列
采用LC-ESI-MS/MS 对反向高效液相色谱分离组分F1 进行氨基酸序列鉴定,通过一级和二级质谱分析,并结合数据库进行比对及与其他文献比较,得到了可能具有DPP-IV 抑制活性的肽段,序列信息见表2。活性肽段二级质谱图如图4 所示,质荷比为685.88 的双电荷离子的LC-MS/MS 谱图与序列MAIPPKKNQDKT 匹配,质荷比为402.98 的四电荷离子的LC-MS/MS 谱图与序列PPKKNQDKTEIPTI匹配,质荷比为655.83 的双电荷离子的LC-MS/MS谱图与序列SPEVIESPPEIN 匹配。这3 条肽段都含有Ala、Pro,且Pro 含量较高,而Pro 已被报道与DPP-Ⅳ抑制活性有关。


表2 具有DPP-Ⅳ抑制活性酪蛋白糖肽的活性肽段信息
3 结 论
本研究收集不同时间的酶解产物,通过测定酪蛋白糖巨肽酶解产物的DPP-IV 抑制率,筛选出DPPIV 抑制活性最高的酶解物(酪蛋白糖肽),抑制率为54.55±3.65%,酪蛋白糖肽中Glu、Thr、Pro、Ile 氨基酸含量较高。具有DPP-IV 抑制活性的酪蛋白糖肽经Sephadex G-25 分离获得两个组分,其中F1 组分具有较强的DPP-IV 抑制活性,抑制率为63.27±3.24%。采用RP-HPLC 对F1 组分进一步分离并通过LC-ESIMS/MS 进行氨基酸序列鉴定,得到DPP-Ⅳ抑制肽MAIPPKKNQDKT、PPKKNQDKTEIPTI、SPEVIESPPE IN。本研究主要对酪蛋白糖肽的DPP-IV 抑制活性进行了体外评价,后续将采用动物实验进一步验证。
由于糖尿病的发病率逐年增加及人们对健康需求的不断提高,天然食物蛋白源DPP-Ⅳ抑制肽类降血糖功能食品的研发逐渐受到关注与重视。本研究明确了酪蛋白糖巨肽酶解产物的DPP-Ⅳ抑制活性,并对其中的DPP-Ⅳ抑制肽进行了分离和鉴定,为酪蛋白糖肽在降糖功能食品的开发应用提供了科学依据。
