成人心脏手术后呼吸机相关肺炎的危险因素
2022-08-28王美珠孙惠英遆新宇杨诏旭
王美珠,孙惠英,常 琰,李 萌,吕 行,遆新宇,吴 朔,杨诏旭
(空军军医大学第一附属医院 1. 疾病预防控制科; 2. 心血管外科; 3. 呼吸及危重症医学科,陕西 西安 710032)
呼吸机相关肺炎(ventilator-associated pneumonia,VAP)是一种常见的医院获得性感染(healthcare-associated,HAI),可导致患者术后住院时间的延长及治疗费用的增加[1-2]。一项Meta分析[3]显示,VAP患者病死率为13%,手术患者可高达69%。心脏开胸手术耗时长、创伤大,极易出现手术后感染。作为心脏手术后常见的HAI之一,VAP发病率为2.1%~13%,17.1~34.5例/1 000机械通气日[4],可直接导致患者住院死亡率的增加[5]。明确心脏患者手术后发生VAP的危险因素可有效帮助临床实施预防措施,降低术后死亡率。本研究对某院2017年1月—2021年5月行心脏开胸手术患者术后发生VAP的危险因素进行分析,以期为临床预防及诊疗提供参考依据。
1 对象与方法
1.1 研究对象 选取某院2017年1月—2021年5月接受胸骨切开心脏手术后入住心脏外科重症监护病房(ICU)行机械通气的成人患者。以VAP患者为病例组,按照1∶1 匹配方法选择同一年龄段(±5岁)、相同性别、同一手术类型的非VAP患者作为对照组,其中手术类型分为瓣膜类、冠脉移植类、混合类(瓣膜+冠脉移植)、主动脉类及其他术式。纳入标准:行胸骨切开术的心脏手术患者,年龄≥18岁且术前未发生感染。排除标准:临床资料缺失或随访中断患者。
1.2 诊断标准 VAP诊断参照2001版《医院感染诊断标准(试行)》[6]和《呼吸机相关性肺炎诊断、预防和治疗指南(2013)》[7]。
1.3 调查方法 患者数据收集使用嘉和电子病历系统。术前实验室数据均记录本次入院术前最后1次检测值。术后危险因素均收集术后至VAP确诊前(对照病例为拔管前)的数据。结局收集VAP确诊后(对照病例为拔管后)至出院或死亡的数据。
1.4 统计学方法 应用Epidata 3.1建立数据库,应用SPSS 24.0统计软件进行病例配对与数据分析。计量资料采用中位数(四分位数间距)[M(P25,P75)]或均数±标准差表示,计数资料采用百分率表示。计量资料若满足参数检验条件时采用独立样本t检验进行比较,若不满足参数检验条件采用Mann-Whitney秩和检验进行比较。手术时间分类依据手术时间的四分位数(P75),其他计量资料根据其目标状态值(是否发生VAP)利用受试者工作特征曲线(ROC曲线)将其划分为2个亚组。计数资料采用χ2检验进行比较。危险因素采用单变量和多变量logistic回归分析(P值:入组0.05,剔除0.10)。P≤0.05为差异具有统计学意义。
2 结果
2.1 基本情况 研究期间共有5 919例成人心脏手术患者术后接受呼吸机辅助呼吸,766例患者呼吸机使用时间>48 h,机械通气日数为3 806 d。62例患者发生VAP,发病率为1.05%、8.03例/1 000机械通气日。各手术类型VAP发生例数依次为:瓣膜类21例,冠脉移植类4例,混合类26例,主动脉类9例以及其他术式2例。一例90岁男性黏液瘤摘除术后VAP患者匹配失败,最终保留在模型中的VAP患者为61例。两组患者基本情况见表1。
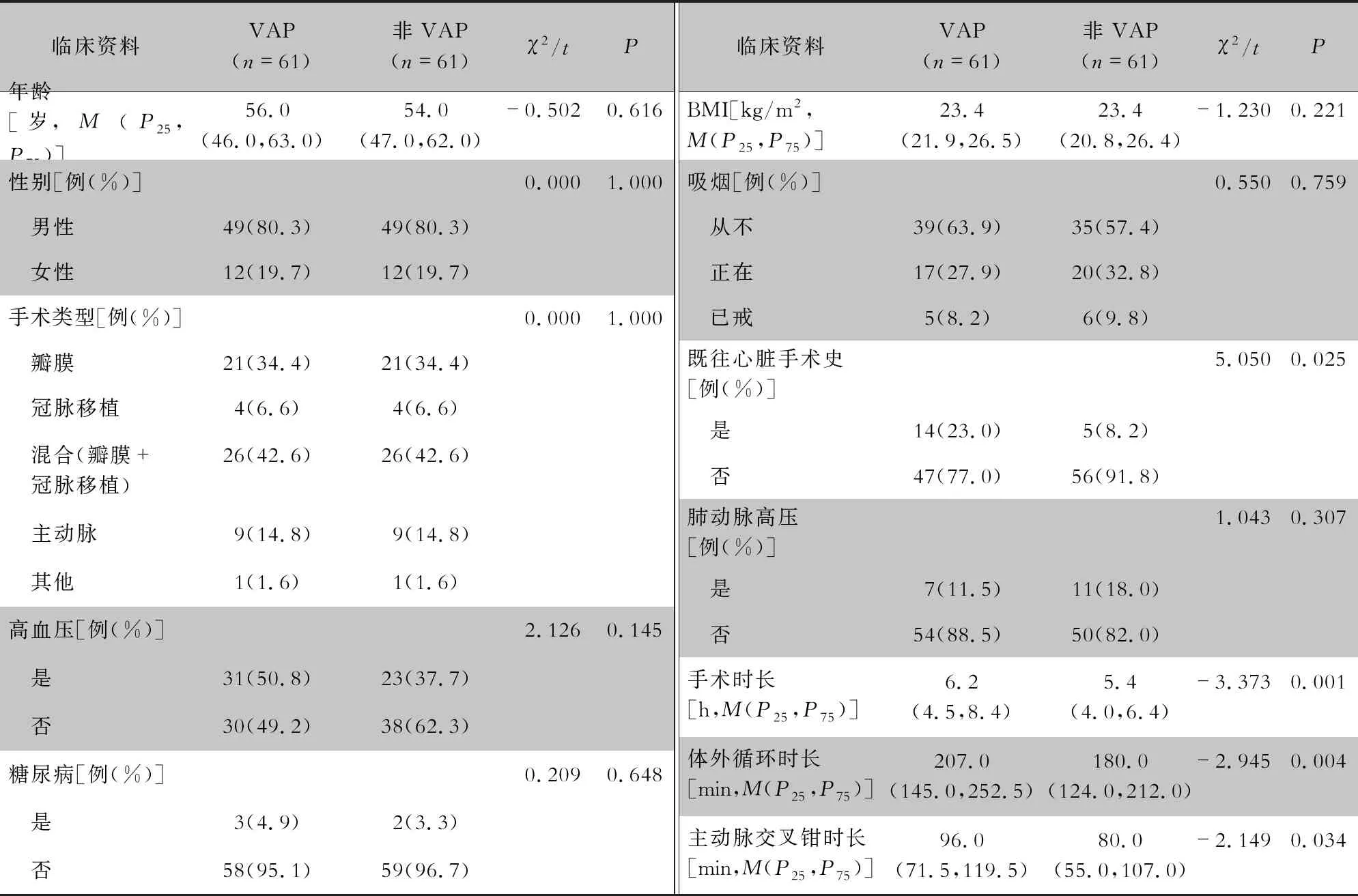
表1 两组成人心脏手术患者基本情况
2.2 VAP危险因素分析
2.2.1 单因素分析 结果显示,术前既往有心脏手术史、肌酐≥1.1 mg/dL、术前ICU住院日数≥0.5 d;术中手术时间≥7.33 h、体外循环时间≥226.5 min、主动脉阻隔时间≥65.5 min、红细胞输注体积≥2.8 U、血浆输注体积≥785 mL、冷沉淀输注体积≥5.8 U;术后意识障碍、肌酐≥1.8 mg/dL(术后第1天)、急性肾损伤、消化道出血、二次置管的患者VAP发病率较高,差异均有统计学意义(均P<0.05)。见表2。

表2 成人心脏手术后VAP的单因素分析
2.2.2 多因素分析 将单因素分析中P<0.05的变量全部纳入多因素回归分析,结果显示:术前肌酐≥1.1 mg/dL、手术时间≥7.33 h及术后意识障碍是成人心脏手术后发生VAP的独立危险因素,差异均有统计学意义(均P<0.05)。见表3。
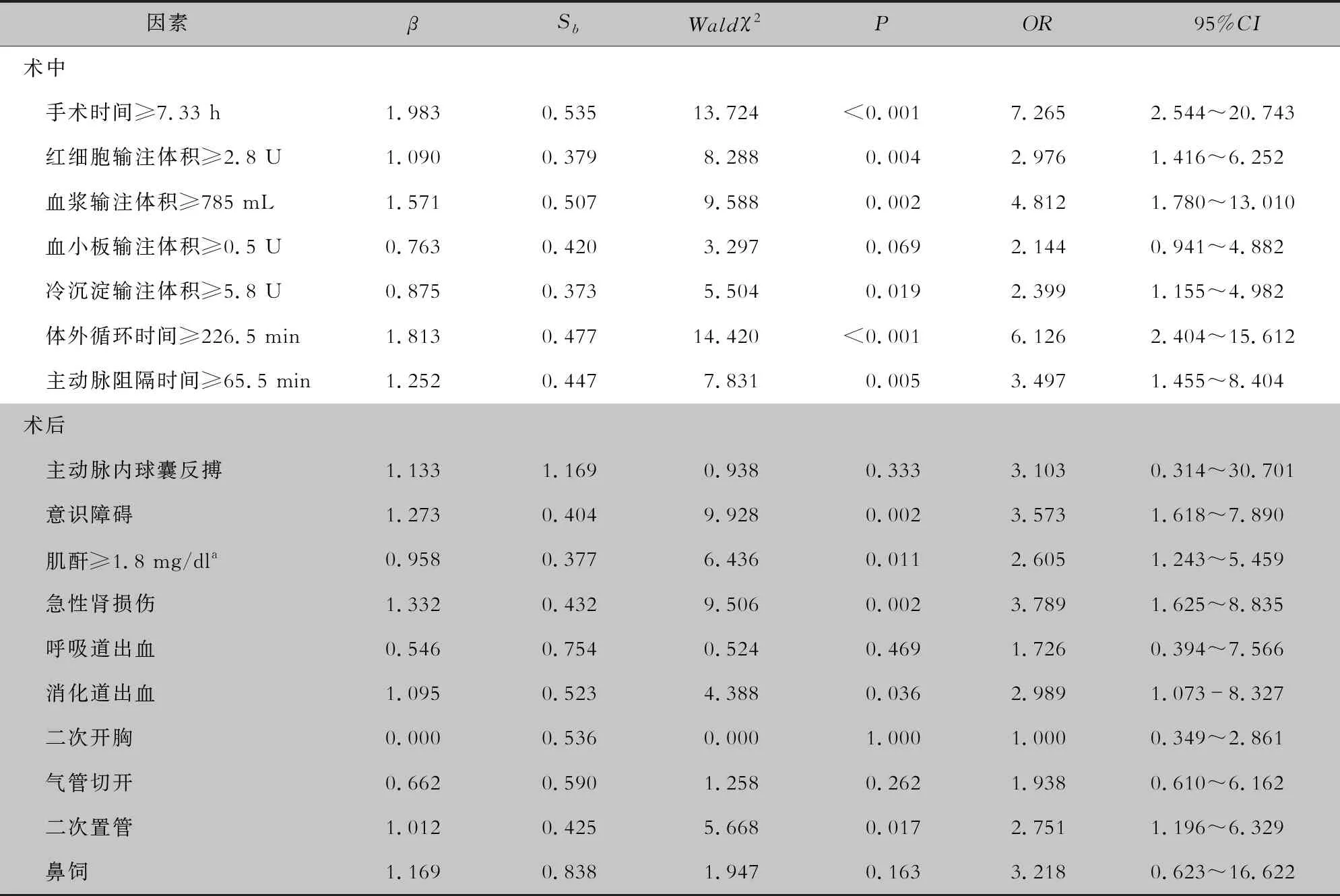
续表2 (Table 2, Continued)
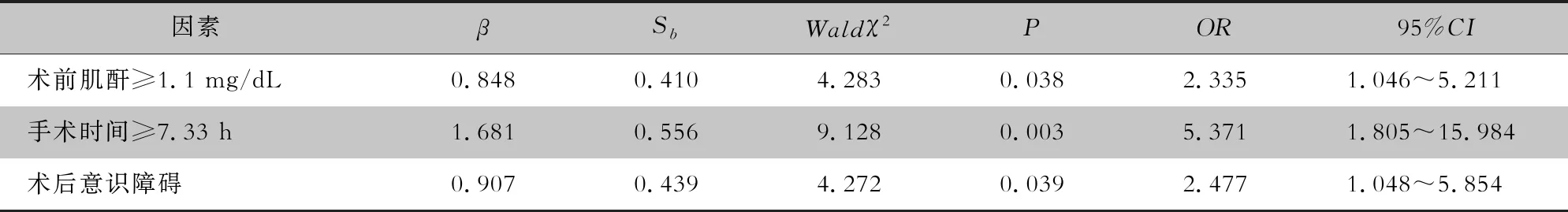
表3 成人心脏手术后VAP多因素分析
2.3 VAP病原菌 61例VAP患者病原菌培养阳性共31例,其中19例患者培养出2种以上病原菌(10例检出2株,8例检出3株,1例检出4株)。分离病原菌以革兰阴性杆菌为主(54株,90.0%),排名前两位为鲍曼不动杆菌(24株,40.0%)和肺炎克雷伯菌(10株,16.6%)。革兰阳性菌检出率较低(1株,1.7%),为肺炎链球菌。共检出5株念珠菌属。见表4。
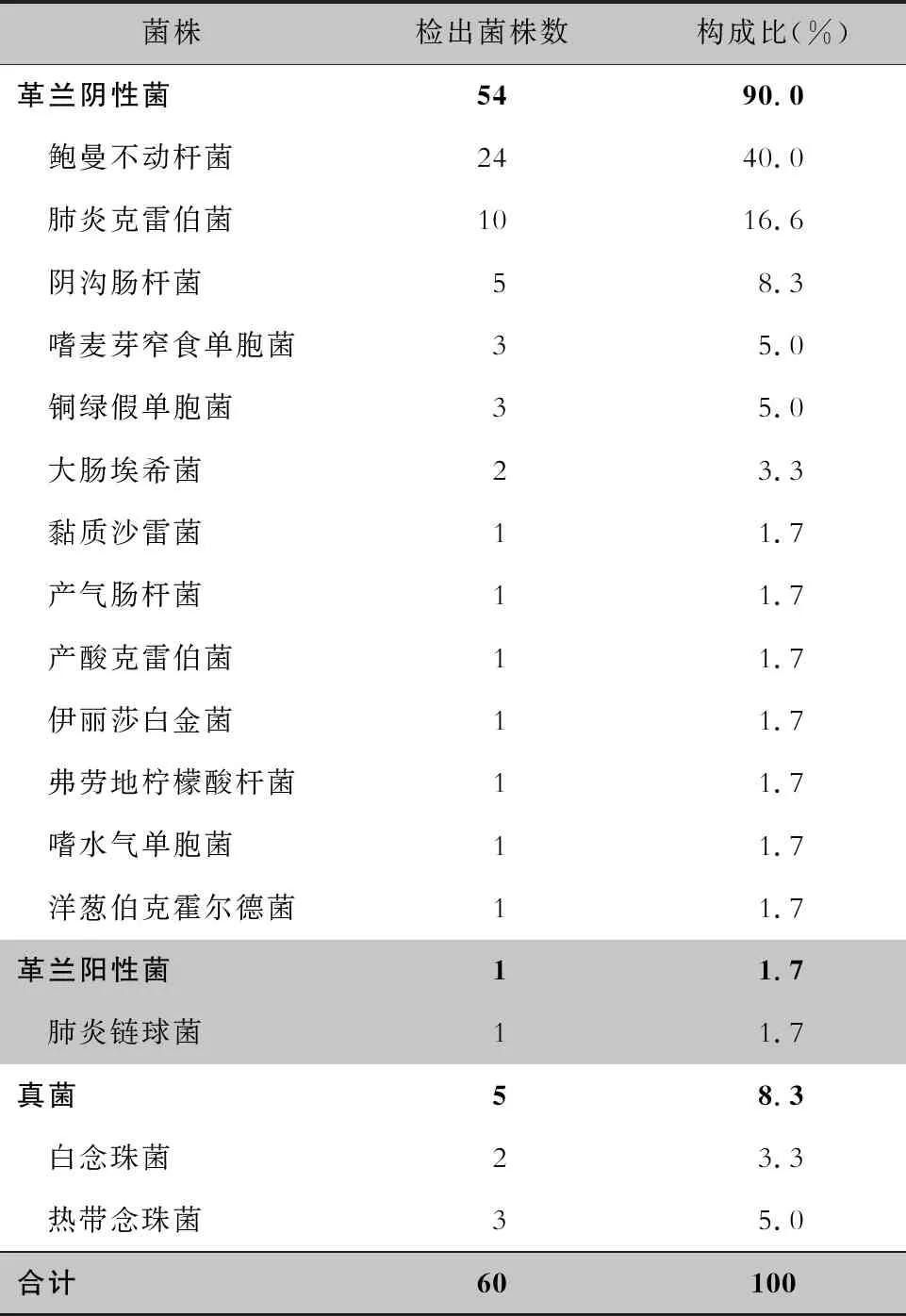
表4 VAP患者检出病原菌分布情况
2.4 结局 心脏手术后VAP患者消化道出血、鼻饲和急性肾损伤风险较非VAP患者显著升高,术后ICU住院日数、总住院费用及28天死亡率升高。见表5。
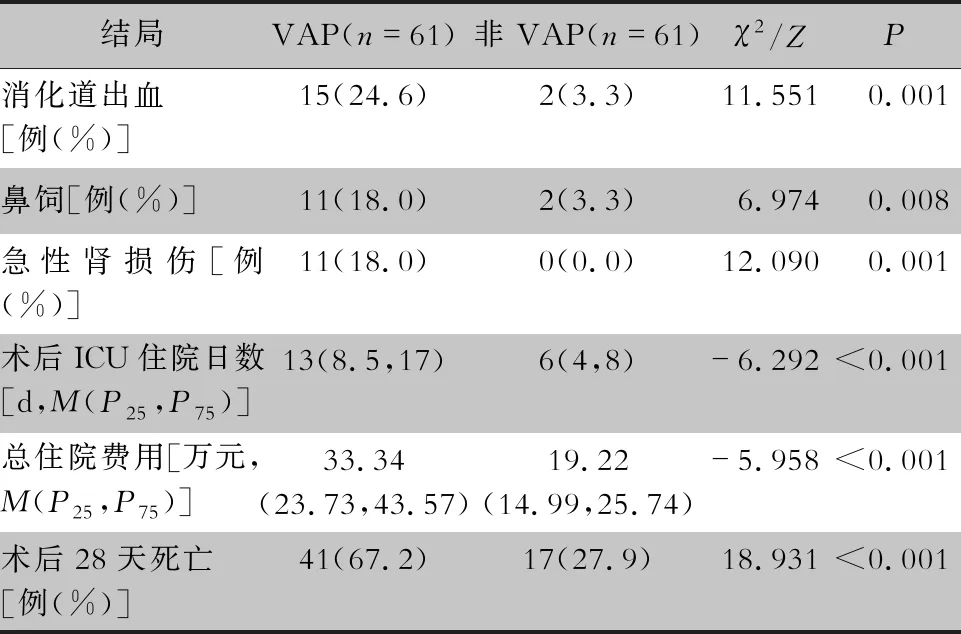
表5 两组成人心脏手术患者结局情况
3 讨论
心脏手术,特别是体外循环手术,通常会引起全身炎症反应[8],结合麻醉和体温过低等因素,极易造成肺功能受损,从而导致实施长时间机械通气[9]。前期研究[10]表明,延长拔管时间可能会破坏呼吸道的正常屏障,从而增加感染风险并导致高病死率。因此,心脏手术患者术后VAP的高发病率是可以预期的,在本研究中也得到证实。
本研究中术前肌酐≥1.1 mg/dL被认为是心脏手术后发生VAP的独立危险因素。肾功能异常患者血液中肌酐等含氮物质升高,参与全身炎症反应间接导致肺功能损伤。术前肌酐清除率不足易导致术后重度低氧血症发生,进而增加气管插管时间并诱发肺部感染。同时术前肾功能不全患者更容易在术后诱发急性肾损伤,多项研究[5,11]表明,急性肾功能损伤是心脏手术后发生VAP的独立危险因素,本研究单因素分析也获得相同结论,其原因也与全身炎症反应及低氧血症相关。临床应重视肾脏基础疾病患者,非急诊手术患者如有条件应于术前积极改善肾功能以预防VAP的发生。
在手术中尽量减少手术时长是预防VAP的关键,在本研究中再次得到证实。手术时间往往同体外循环时间及主动脉阻隔时间正相关。体外循环激活机体炎症反应和凝血系统,可致手术后急性肺损伤和呼吸功能下降;主动脉阻断时机体消除自由基的酶系统活性下降,中性粒白细胞被补体及花生四烯酸激活进入心肌细胞,导致心肌受损,两者均会导致机械通气时间延长,VAP风险增加。因此若条件允许,应尽量提高手术技术,缩短上述时间,以有效控制和降低VAP的发生,应将主动脉夹层一类手术耗时较长患者作为高危人群予以主动识别。
本研究中共有43例手术后患者出现意识障碍,其中30例发生VAP,占69.8%。不同程度的昏迷是意识障碍的主要表现形式,占81.40%。昏迷患者呼吸功能减弱,难以借助咳嗽反射清除气道分泌物,是导致肺部感染风险增加的直接原因。同时,造成心脏手术后意识障碍的原因是多方面的,如高龄、基础疾病、手术类型、麻醉药品剂量及方式、体外循环的使用、围手术期输血及脑内栓塞形成等[12]。因此,意识障碍对VAP的影响也是多因素综合作用的一个体现。临床应采用包括基础疾病管理、术中栓塞预防及针对术后神经炎性反应药物治疗等措施,进而改善手术效果,降低意识障碍发生率[13]。
目前普遍认为VAP感染病原菌以内源性为主,其中口咽部定植菌下移为主要感染菌,肠道定植菌为次要感染菌。不同报道中心脏手术后VAP感染病原菌有所差异,国外曾有铜绿假单胞菌[14]、流感嗜血杆菌[15]或金黄色葡萄球菌[5]检出占据首位的报道,这些差异与患者群体及地区相关。本文中检出量排名第1位的为鲍曼不动杆菌(40.0%),与孙明飞等[16]研究相一致。共有23株鲍曼不动杆菌对碳青霉烯类药物耐药,占95.8%,提示临床应高度重视病原菌规范送检、抗菌药物的合理使用以及消毒隔离措施的严格执行[17]。
研究[5]表明,VAP的发生是心脏外科手术后患者住院死亡的重要危险因素,本文中VAP患者术后28天死亡率为67.2%,与非VAP患者差异明显。本文61例VAP患者在明确诊断后,13例行气管切开,22例行二次置管,呼吸衰竭、胃肠道并发症及急性肾损伤风险较非VAP患者明显升高,因而需要更多设备支持、药物治疗及护理开支,导致重症监护时长及住院费用的明显增长,与以往研究[2,18]结果一致。
综上所述,心脏外科手术后VAP发病率较高,伴随其他并发症风险、重症监护时间及费用明显增长。术前肾功能不全、手术时间及术后意识障碍是心脏开胸手术后患者发生VAP的独立危险因素。针对上述结果临床应采用个性化的、以患者为中心的集束化措施来降低VAP的发生。对于部分无法改变的因素如急诊手术、主动脉夹层等可作为高危人群予以识别,从而最大限度减少心脏手术后患者VAP风险,降低病死率。同时,本研究尚存一定局限性。首先,本研究为单中心研究,数据结果受样本量限制,期待后续开展多中心研究进一步验证。其次,本研究未开展系统的术前多重耐药菌筛查,鉴于VAP患者感染病原菌的高耐药率,期待后续能开展此项筛查工作并探讨其与预防VAP之间的关系。
利益冲突:所有作者均声明不存在利益冲突。
