保护性造口对直肠癌直肠低位前切除术器官腔隙感染的影响分析
2022-08-28贾会学李六亿
贾会学,李六亿
(北京大学第一医院感染管理-疾病预防控制处,北京 100034)
结直肠癌是消化系统中常见的恶性肿瘤,严重危害人类健康。近年来,结直肠癌发病率和死亡率在全球不断上升,其发病率居世界恶性肿瘤第三位,死亡率居恶性肿瘤第四位[1]。直肠癌占结直肠癌的60%~70%,每年死亡率为(4~10)/10万[2]。直肠低位前切除术(Dixon术)是应用最多的直肠癌根治术,一般要求肿瘤距肛缘7 cm以上,远端切缘距肿瘤下缘2 cm以上,以能根治、切除肿瘤为原则。然而,随着外科技术的改进,以及为满足越来越多的低位直肠癌患者保留肛门括约肌的需求,很多肿瘤距肛缘7 cm以下,甚至5 cm以下的直肠癌患者选择了Dixon术[3-5]。随着低位直肠癌保肛手术比例的增加,由于吻合口张力过大和吻合口血液供应问题,吻合口漏的风险增加[6],从而导致术后发生手术部位感染尤其是器官腔隙感染的风险增高。本研究旨在通过分析直肠癌Dixon术后发生器官腔隙感染的危险因素,尤其是保护性造口对术后发生器官腔隙感染的影响,以采取有效控制措施,降低感染发生率。
1 对象与方法
1.1 研究对象 2017—2021年北京大学第一医院行直肠低位前切除术(Dixon术)的直肠癌患者。
1.2 研究方法
1.2.1 Dixon术后器官腔隙感染危险因素 前瞻性监测2017—2021年实施Dixon术的直肠癌患者感染危险因素,包括一般临床资料[性别、年龄、身体质量指数(BMI)]、合并症[术前贫血、术前肠梗阻、糖尿病、低蛋白血症、术前化学治疗(化疗)],实验室检查[术前白细胞(WBC)、术前血糖]、手术类型(腹腔镜、开腹)、手术相关因素(手术持续时间、引流时间、ASA评分、保护性造口)、肿瘤性质(肿瘤距肛缘的距离、肿瘤分期)。手术时间根据是否需要术中追加抗菌药物分为≤3 h和>3 h组,肿瘤距肛缘的距离分为≥7 cm、5~7 cm和<5 cm组,对以上相关因素进行单因素和多因素分析。
1.2.2 保护性造口对Dixon术后器官腔隙感染的影响 针对不同患者肿瘤距肛缘的距离即≥7 cm、5~7 cm和<5 cm,将患者分成三组,分析各组行保护性造口的比例及感染情况,并比较不同组行保护性造口与未行保护性造口情况下感染率。
1.3 器官/腔隙感染定义[7]本研究器官/腔隙感染特指直肠癌术后30 d内发生的与手术有关的腹(盆)腔感染。临床诊断标准是具有下述三条之一者:(1)引流或穿刺有脓液;(2)再次手术探查、经组织病理学或影像学检查发现涉及腹(盆)腔感染的证据;(3)由临床医生诊断的腹(盆)腔感染。病原学诊断:在临床诊断基础上,细菌培养阳性。
1.4 统计分析 应用SPSS 15.0统计软件对数据进行分析,单因素分析组间比较及率的比较用χ2检验;多因素分析采用logistic回归,使用逐步后退法,剔除标准为0.1,P≤0.05为差异有统计学意义。
2 结果
2.1 感染基本情况 2017—2021年该院行Dixon术的直肠癌患者共1 064例,发生手术部位感染54例,手术部位感染率为5.08%,其中表浅切口感染3例,器官腔隙感染51例,器官腔隙感染率为4.79%。
2.2 危险因素分析 单因素分析显示,男性、术前贫血、术前化疗、引流时间>10 d、肿瘤距肛缘距离<7 cm、手术持续时间>3 h是发生器官腔隙感染的危险因素,差异均有统计学意义(均P<0.05)。多因素分析显示,男性、术前贫血、术前肠梗阻、引流时间>10 d、肿瘤距肛缘距离<7 cm、手术持续时间>3 h为发生器官腔隙感染的独立危险因素,肿瘤距肛缘距离<7 cm对发生感染的影响最大,尤其是5~7 cm;而手术时即行保护性造口是发生器官腔隙感染的独立保护因素。见表1、2。
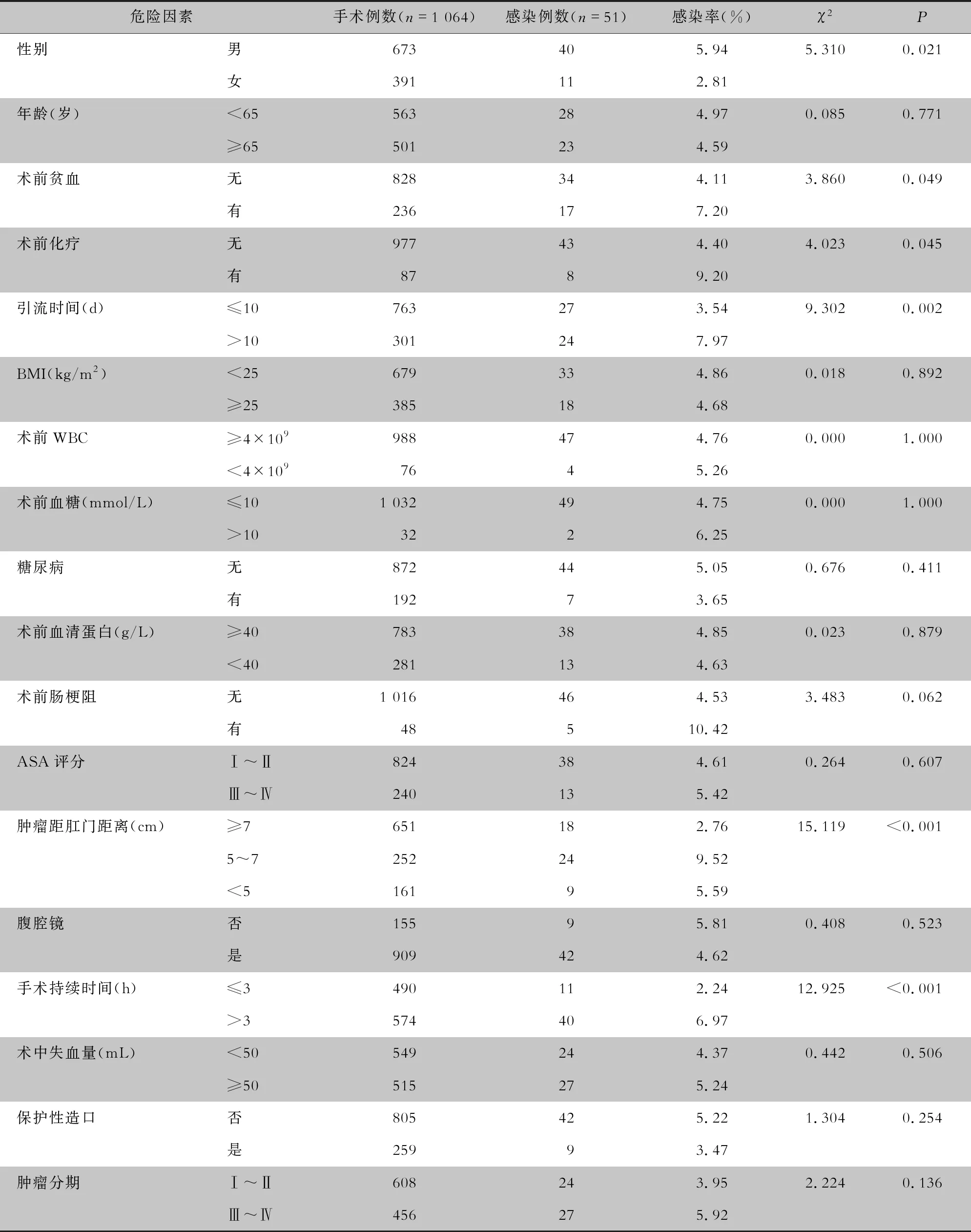
表1 直肠癌患者Dixon术后器官腔隙感染单因素分析
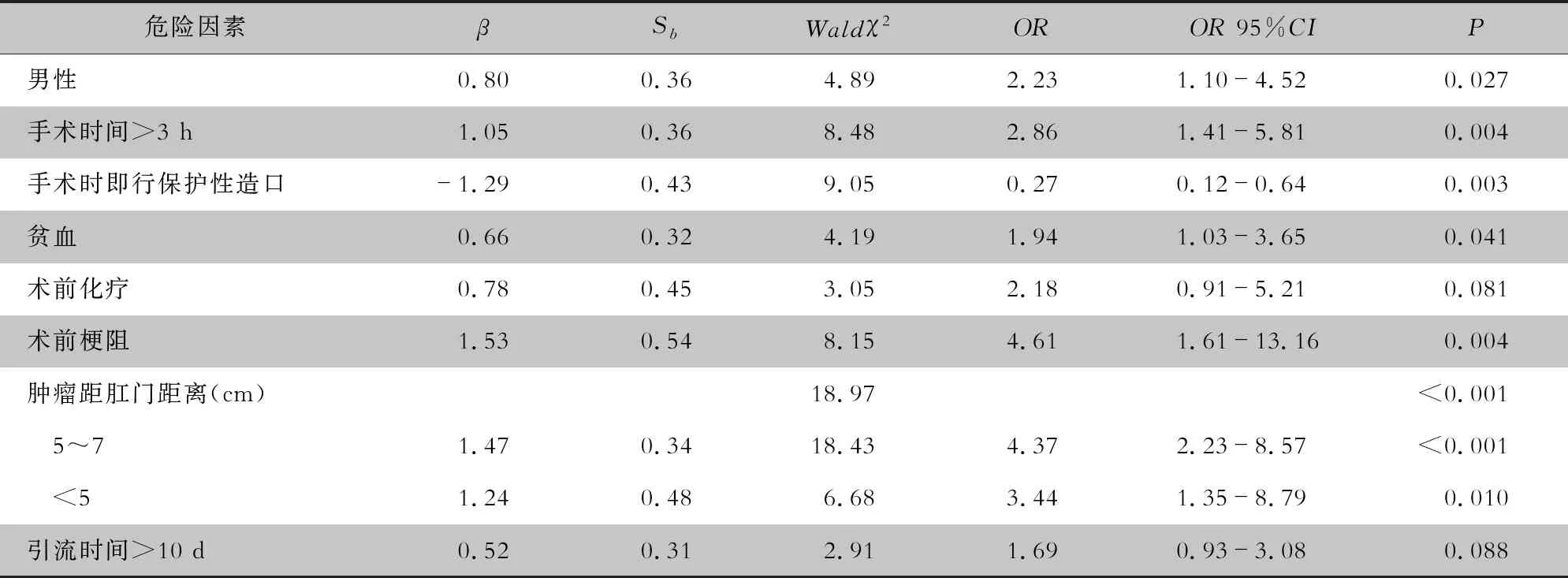
表2 直肠癌患者Dixon术后器官腔隙感染多因素分析
2.3 不同患者肿瘤距肛门距离及保护性造口对感染的影响 肿瘤距肛门距离≥7 cm的患者术后器官腔隙感染率最低,为2.76%。随着肿瘤距肛门距离越短,保护性造口比例越高。肿瘤距肛门距离<5 cm患者行保护性造口比例最高,为72.05%。见表3。肿瘤距肛门距离不同,行保护性造口预防器官腔隙感染的效果不同,见表4。对于肿瘤距肛门距离≥7 cm患者,行保护性造口并不能有效预防感染的发生;对于肿瘤距肛门<5 cm患者,行保护性造口可降低器官腔隙感染率,差异有统计学意义(P=0.02);5~7 cm患者,行保护性造口后感染率降低幅度也很大,但差异无统计学意义(P=0.07)。
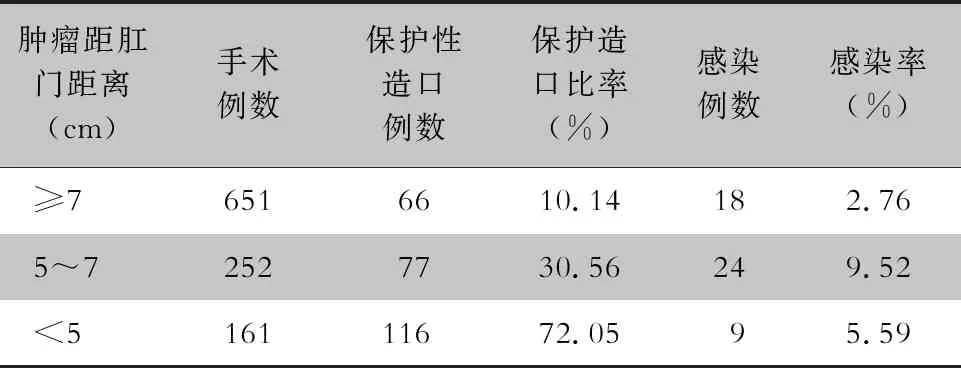
表3 不同肿瘤距肛门距离组患者行保护性造口及器官腔隙感染情况
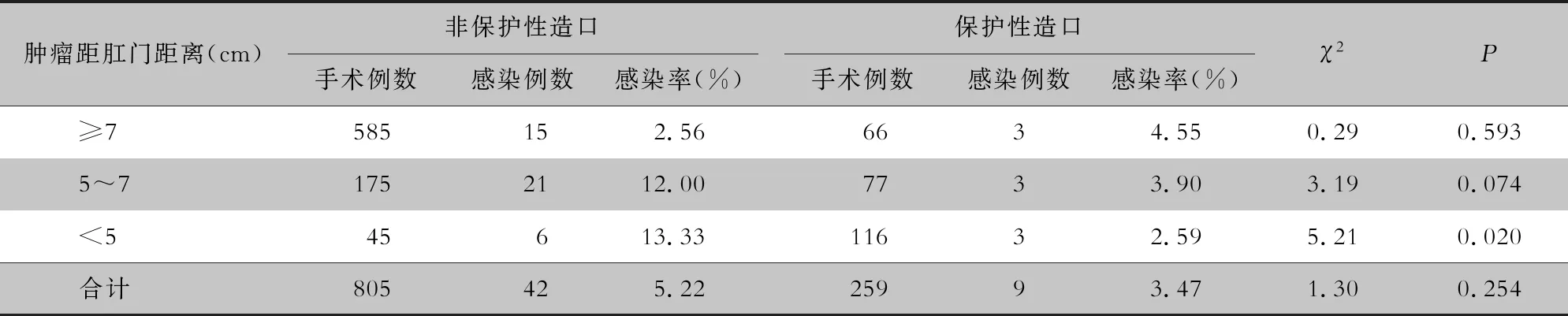
表4 不同肿瘤距肛门距离组患者行保护性造口与非保护性造口器官腔隙感染情况
3 讨论
直肠癌是常见的消化道恶性肿瘤之一,近年来,直肠癌的发病率逐年上升,其中70%~80%为中低位直肠癌[8-9]。随着社会经济的不断发展和物质生活水平的不断提高,直肠癌患者就诊目的不仅仅是单纯治愈肿瘤,还要求保留有功能的肛门。随着对解剖层面认识的提高,手术操作技术、影像学技术、内镜技术、腹腔镜下切割闭合技术、腔内吻合技术等不断进步和发展,直肠癌患者术后保肛率得到明显的提高。但由于多数直肠癌位于盆腔,手术空间狭窄,手术操作比较困难,更易引发并发症,其中非常重要的就是手术部位感染,尤其是器官腔隙感染。研究[1,10-13]表明,直肠癌术后器官腔隙感染率在3%~30%之间,导致住院时间延长,增加了护理难度和患者痛苦,也影响手术疗效。寻找术后器官腔隙感染发生的主要危险因素并进行早期识别和干预,是改善患者生存预后的重要途径。
本研究对1 604例行Dixon术直肠癌患者的临床资料进行监测分析,发现器官腔隙感染发生率为4.79%。危险因素分析,男性、术前贫血、术前肠梗阻、引流时间>10 d、肿瘤距肛缘距离<7 cm、手术持续时间>3 h是发生器官腔隙感染的独立危险因素,与其他研究[14-16]结果相近。男性患者较女性骨盆狭窄,增加了低位直肠癌手术的难度,容易造成远端肠管的穿孔和闭合不良[17];贫血导致患者免疫功能下降,也可影响吻合部位的血液供应;对于术前合并肠梗阻的直肠癌患者,无法术前准备或不完全性肠梗阻准备不佳,导致肠内菌群紊乱、肠壁扩张水肿,均不利于吻合口的愈合。低位直肠癌会引发吻合口张力增加,吻合口漏的危险性也相应增大,而术后吻合口漏是造成术后腹腔感染的重要原因。
目前,保护性造口是针对一些存在吻合口漏高危险因素患者的常规使用方式[18-19],主要是通过近端结肠或末端回肠近端造口,远端关闭,可达到转流效果,即使存在有小的瘘口,由于大部分肠内容物已经通过近端的造口排出体外,故不会有大量肠液、粪便通过吻合口,有利于促进吻合口的愈合,从而可以达到预防和降低吻合口漏发生的目的[20],进而降低器官腔隙感染发生率。目前,对于保护性造口是否可有效预防吻合口漏的发生,仍存在争议,有学者认为保护性造口会引发肠梗阻等并发症,延长患者住院时间[21-22]。但更多的RCT研究及Meta分析推荐行保护性造口,可有效降低吻合口漏的发生率及患者的再手术率[23-25]。严重吻合口漏或吻合口漏未及时发现及处理,便会引起腹腔感染的发生,因此采取有效预防吻合口漏的措施,对预防术后腹腔感染是有效的。本研究结果显示,保护性造口是器官腔隙感染的独立保护性因素。
本研究中,行保护性造口可有效降低肿瘤距肛门5 cm以下的直肠癌患者术后器官腔隙感染的发生率,对肿瘤距肛门5~7 cm患者也有一定的作用,但对肿瘤距肛门≥7 cm患者效果不明显。对整体患者而言,术后器官腔隙感染发生率虽有所降低,但差异无统计学意义。Bertelsen等[6]研究表明,对于肿瘤距肛门5 cm以下的直肠癌患者,无保护性造口患者发生吻合口漏的风险显著增加,是有保护性造口患者的5.37倍。因此对于肿瘤距肛门5 cm以下的直肠癌患者,保护性造口是优先考虑的方案,对于肿瘤距肛门5~7 cm患者可以酌情考虑。但目前对于保护性造口的利与弊仍存在争议,毕竟保护性造口期间,患者需要承受一定的心理压力,另外还有二次手术的风险等。如何衡量其作用和风险,如何确定保护性造口指征,还需要进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
