脊柱结核患者骨密度与骨髓间充质干细胞迁徙研究
2022-08-28郭超峰胡小江张宏其高琪乐唐明星刘少华李艳冰
郭超峰,胡小江,李 韬,张宏其,高琪乐,唐明星,刘少华,李艳冰
[1. 中南大学湘雅医院骨科脊柱外科,湖南 长沙 410008; 2. 国家老年疾病临床医学研究中心(湘雅医院),湖南 长沙 410008; 3. 中南大学湘雅医院检验科,湖南 长沙 410008]
脊柱结核是结核分枝杆菌侵入椎体及附件引起的一类继发性感染疾病。近年来,由于人口基数居高不下、人口流动率高以及耐药菌的出现,脊柱结核发病率有回升的趋势[1]。国内外临床研究[2-3]显示,脊柱结核患者骨质减少,骨质疏松发生率明显高于正常人。目前引起脊柱结核患者骨质减少的病因尚未完全明确,有研究[3]显示,脊柱结核患者骨质疏松的发生可能与患者成骨分化能力不足相关。骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)是一种存在于骨髓或骨膜中具有增殖分化为骨、软骨、脂肪组织的潜能细胞,在细胞培养瓶中具有贴壁生长的趋势。BMSCs是成骨细胞的前体细胞,在增殖分化之前需接受“指令”从而迁徙到目标位置[4]。BMSCs的迁徙能力是其成骨分化的前提条件,BMSCs迁徙能力受限将影响其成骨分化能力,并可能最终导致宿主骨质减少[5-6]。目前,针对脊柱结核患者BMSCs成骨分化的相关研究较少,结核分枝杆菌对宿主BMSCs迁徙能力的影响更鲜见报道。
本研究收集脊柱结核患者和对照人群的骨密度信息,并提取两者的BMSCs,比较两者BMSCs迁徙能力的差异,同时向BMSCs中加入卡介苗(BCG)进行共培养,模拟结核分枝杆菌感染环境,进一步观察BMSCs迁徙能力的变化,以期阐明宿主因素和环境因素对BMSCs迁徙能力的影响,进而为脊柱结核患者骨代谢异常的相关研究提供方向。
1 对象与方法
1.1 研究对象 选取2020年6月1日—2021年12月1日中南大学湘雅医院脊柱外科住院确诊为脊柱结核行脊柱内固定的患者为结核组,胸腰椎骨折或椎管狭窄行脊柱内固定的患者为对照组。本研究已获得中南大学伦理委员会批准,所有患者均签署知情同意书。
1.2 纳入与排除标准 纳入标准:①结核组需通过培养、Xpert等确诊脊柱结核;②年龄18~75岁;③患者自愿接受骨密度测定。排除标准:①有吸烟、喝酒等不良嗜好者;②有风湿性疾病、自身免疫性疾病者;③垂体功能障碍者;④肿瘤患者或既往患肿瘤者。
1.3 仪器和试剂 BCG(成都生物制品研究所有限责任公司)、人外周血淋巴细胞分离液(天津市灏洋生物制品科技有限公司)、DMEM F12(1∶1)1×(Gibco,美国)、FBS(BI,以色列)、胰酶(0.25% TRYPSIN-EDTA,Gibco,美国)、双能X线(型号:Discovery Wi S/N87047)。
1.4 骨密度测定 应用双能X线扫描测量所有纳入人群腰椎1~4(L1~4)骨密度(g/cm2)。
1.5 BMSCs的提取与培养 取结核组和对照组患者(各6例)手术时采集的钉道血2 mL,立即转入无菌真空肝素管内,迅速置于二级生物安全实验室内,用同等体积的生理盐水稀释。随后将稀释后的钉道血缓慢加至含有3 mL人外周血淋巴细胞分离液的15 mL离心管中,使血液处于淋巴细胞分离液的上层。离心(10 min,1 000 g)后取中间白色云雾状细胞层于另1支离心管中,加入DMEM F12(1∶1)1×稀释后离心(10 min,1 000 g),弃上清液,将离心管底部原代BMSCs用含15%FBS的DMEM F12(1∶1)1×的培养基重悬,移至细胞培养瓶中,并于37℃、5%CO2的培养箱中培养。待细胞贴壁后每3天更换一次培养基,当单层细胞铺满培养瓶底90%后用胰酶(0.25% TRYPSIN-EDTA)传代,并将原代BMSCs冻存于液氮内,后续传代细胞用于正式试验,BMSCs代数不超过4代。
1.6 细胞划痕试验 ①将每例患者第1代BMSCs接种于6孔板(1.3×104细胞/孔)中,用无抗生素的培养基培养,其中3孔加入BCG(1.3×105CFU/孔),即为BCG共培养,3孔未加BCG者即为单纯培养。②用划痕细胞耙在每孔划痕3条,BCG共培养和单纯培养各3孔、9条划痕,取9条划痕细胞迁徙率的平均值用作后续统计分析。③用1 mL的基础培养基清洗细胞3次,去除非贴壁细胞并使划痕边缘光滑;分别于0、第8小时、第16小时、第24小时用倒置显微镜拍摄(4×)细胞迁徙愈合图像,用ImageView软件测定每条划痕的宽度,测定结果取平均值。
1.7 统计分析 应用SPSS 20.0软件进行数据分析,计数资料采用构成比描述,比较采用卡方检验;各组患者年龄和骨密度、BMSCs迁徙率比较采用ANOVA检验,成对比较采用LSD-t检验;使用Pearson相关系数分析骨密度和BMSCs迁徙率的相关性,以P≤0.05为差异具有统计学意义。
2 结果
2.1 骨密度检测结果 结核组纳入病例72例,对照组纳入病例76例,两组患者性别、年龄比较,差异均无统计学意义(均P>0.5)。结核组患者的骨密度低于对照组,差异有统计学意义(P<0.05)。见表1。
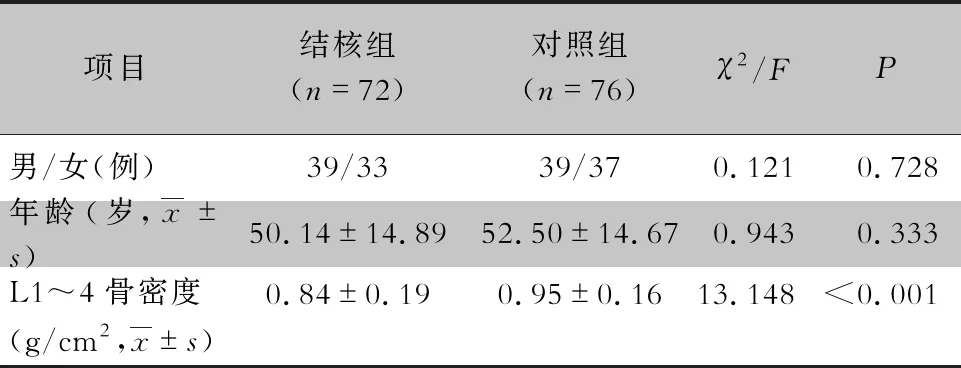
表1 两组患者基本资料及骨密度检测结果
2.2 BMSCs迁徙能力 两组患者钉道血划痕试验结果显示,在第8小时、第16小时结核组患者BMSCs迁徙率小于对照组(P<0.05);在第24小时结核组BMSCs迁徙率数值仍小于对照组,但差异无统计学意义(P>0.05)。见表2、图1~2。
2.3 BCG对BMSCs迁徙能力的影响 结核组BCG共培养与单纯培养比较,对照组BCG共培养与单纯培养比较,不同时间BMSCs迁徙率差异均无统计学意义(均P>0.05)。在第8小时、第16小时,结核组BCG共培养BMSCs迁徙率低于对照组BCG共培养,差异具有统计学意义(P<0.05);在第24小时,结核组BCG共培养与对照组BCG共培养BMSCs迁徙率比较,差异无统计学意义(P>0.05)。见表2、图1~2。
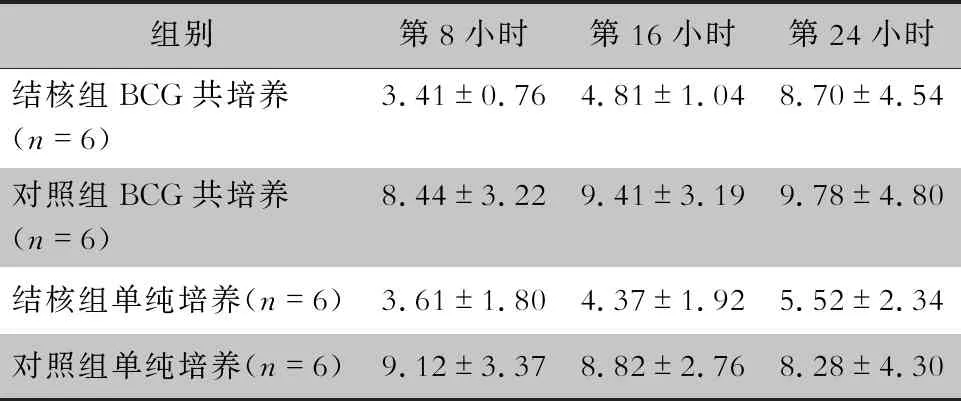
表2 两组患者BCG共培养及单纯培养不同时间BMSCs迁徙率(μm/h)
2.4 BMSCs迁徙率与骨密度相关分析 将BMSCs迁徙率与标本来源患者的椎体骨密度进行Pearson直线相关分析,结果发现,在第8小时、第16小时患者骨密度和患者BMSCs迁徙率相关系数(r值)分别为0.80、0.67(均P<0.05);在第24小时两者r值为0.51(P>0.05)。见图3。
3 讨论
本研究发现,相较胸腰椎骨折或椎管狭窄患者,脊柱结核患者骨密度明显降低。脊柱结核患者骨质疏松的发生率明显上升[3],在脊柱结核小鼠模型中也发现结核小鼠骨小梁密度普遍降低[7]。结核分枝杆菌可降低成骨细胞骨保护素(OPG)的表达,增强核因子κB受体活化因子配体(RANKL)的表达,且能诱导成骨细胞凋亡[8]。BMSCs作为成骨细胞的前体细胞,与脊柱结核患者的骨代谢密切相关。BMSCs可吞噬结核分枝杆菌造成持续感染状态[9],并使机体作出相应的免疫应答[10]。
BMSCs向病灶区域的迁徙和聚集,是启动成骨分化的必要条件[11]。划痕试验是一种用于研究细胞迁移和细胞间相互作用的实验室技术,通过半定量的方法来测定细胞迁徙率,从而反映细胞的迁徙能力强弱[12]。影响BMSCs迁徙的因素有很多:包括趋化因子[基质衍生因子-1(SDF-1)、CXC趋化因子受体4(CXCR4)]、细胞因子[骨调素(OPN)]和生长因子[转化生长因子β1(TGF-β1)]等化学因素,以及生理循环静水压、流体剪切应力、骨基质形变和脉冲电磁场等物理因素[4]。影响BMSCs迁徙能力的因素,最终也会对BMSCs的成骨能力造成影响。本研究将患者BMSCs迁徙率与椎体骨密度进行Pearson直线相关分析发现,患者骨密度与BMSCs迁徙率之间具有相关性。关于BMSCs迁徙的研究逐渐成为了成骨机制研究的重点,但关于脊柱结核患者BMSCs迁徙能力的研究鲜有报道。
本研究中,脊柱结核患者BMSCs的迁徙能力低于对照组,此与脊柱结核患者骨密度降低、骨代谢紊乱的临床表现相符合。在脊柱结核感染的过程中,病灶中的结核分枝杆菌是否会影响BMSCs迁徙能力的下降,从而造成脊柱结核患者成骨的减弱?为验证此假设,研究将BCG和BMSCs共培养以模拟脊柱结核椎体病灶环境。共培养后的划痕试验表明,BCG的存在对BMSCs的迁徙能力影响并不明显,可能与BCG致病力不足有关,但在共培养的条件下仍然观察到脊柱结核患者BMSCs迁徙能力出现进一步下降的趋势,与Rahyussalim等[13]在体外细胞试验中结核分枝杆菌不影响BMSCs的生长和分化的结论一致。因此,推测结核分枝杆菌感染和结核病患者疾病严重程度的差异主要是因为宿主和环境因素,而结核分枝杆菌变异造成的影响较小[14]。结核病患者存在多个易感基因,宿主对于结核分枝杆菌感染的免疫反应受多个易感基因共同调控。Gao等[15]对208例脊柱结核患者和210名健康志愿者进行DNA测序分析后发现,MCP-1-2518 GG基因型和G等位基因的存在,可能与中国汉族人群对脊柱结核的易感性有关;2020年Xu等[16]研究表明,MC3R rs6127698基因的多态性与多灶性结核病的易感性有关;2013年郭超峰等[17]研究发现,单核细胞趋化蛋白1基因多态性、人血清中单核细胞趋化蛋白1的表达水平与脊柱结核易感性相关;最近,Li等[18]研究表明,SLC11A1 rs17235409基因的多态性与脊柱结核的易感性有关。
本试验存在以下不足:①共培养使用的是无毒的BCG,而不是结核分枝杆菌强毒株,可能对试验结果产生一定影响。但无毒的BCG抗原性和强毒株一致,且研究[19]表明BCG和结核分枝杆菌强毒株引起某些细胞因子、生长因子升高的水平差异无统计学意义;Inoue等[20]研究也曾使用BCG代替结核分枝杆菌进行研究,因此本试验共培养也采用BCG模拟脊柱结核椎体病灶环境。②本研究基于现有条件只采集了6对BMSCs进行试验,在一定程度上可能存在偏倚。
综上所述,本研究在临床上发现脊柱结核患者骨密度降低,提出脊柱结核分枝杆菌感染影响BMSCs迁徙能力的假设,从而研究脊柱结核患者BMSCs迁徙能力的改变以及BCG对于脊柱结核患者BMSCs迁徙率的影响,并通过已有的样本分析骨密度与BMSCs迁徙率的相关性。本组研究发现,脊柱结核患者BMSCs迁徙率减低,BCG对BMSCs的迁徙能力无明显影响,且骨密度与BMSCs迁徙率之间具有相关性。结果提示脊柱结核患者骨密度降低与BMSCs迁徙能力的减低存在相关性,但暴露于结核分枝杆菌抗原并不引起BMSCs迁徙能力减低,推测脊柱结核患者BMSCs迁徙能力的减低主要与宿主自身因素相关,而结核分枝杆菌的影响较弱。
利益冲突:所有作者均声明不存在利益冲突。
