miR-212-5p通过靶向PCED1B基因抑制Wnt/β-catenin信号通路调控膀胱癌细胞的增殖和凋亡
2022-08-26王俊卿王敏李晶
王俊卿 王敏 李晶
(1酒泉市人民医院,甘肃 酒泉 735000;2上海市口腔医院)
膀胱癌(BC)是常见的泌尿系统恶性肿瘤,发病率和死亡率均居高不下,其主要治疗方式是手术和辅助放化疗,前期患者需要顺铂全身化疗,或采用新的靶向或免疫治疗〔1〕。研究表明,miRNA在癌症中通常表达异常,可能与癌症的分化、转移和侵袭有关。miRNA在BC组织、患者尿液或血液样本中表达异常,可能与患者诊断、预后、疾病监测和靶向治疗等相关〔2〕。有报道显示,miR-212-5p在胃癌〔3〕和三阴性乳腺癌〔4〕中低表达,其通过lncMIF-AS1/miR-212-5p/NDUFA4信号转导促进胃癌细胞的增殖并抑制凋亡,其表达水平与乳腺癌的肿瘤大小、是否侵犯淋巴结和血管有关,其高表达可抑制乳腺癌的上皮间质转化(EMT)及癌细胞的迁移和侵袭能力。本研究通过StarBase预测发现,miR-212-5p与PCED 1B可能存在靶向关系。PCED1B在胶质瘤中高表达,敲除PCED1B可以抑制胶质瘤细胞的增殖能力和诱导细胞凋亡能力〔5〕。但miR-212-5p和PCED1B在BC中表达和作用尚不清楚。根据生物信息学预测结果和上述报道结论,本研究以BC细胞系为主要研究对象,假设miR-212-5p靶向PCED1B基因通过Wnt/β-catenin信号通路调节BC细胞凋亡和增殖。
1 材料与方法
1.1材料 人正常膀胱上皮细胞SV-HUC-1及BC细胞系T24、RT4和UM-UC-3购自美国ATCC;RPMI1640培养基、F12K培养基和胎牛血清(FBS)购自美国Gibco公司;胰蛋白酶购自Sigma-Aldrich公司;细胞培养板购自美国Corning公司;CCK-8试剂盒和细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;引物、miR-212-5p模拟物(miR-212-5p)、miR-212-5p抑制剂(anti-miR-212-5p)、PCED1B抑制剂(si-PCED1B)、PCED1B高表达载体(pcDNA-PCED1B)和对照(miR-NC、anti-miR-NC、si-NC和pcDNA-NC)及PCED1B野生型和突变型双荧光载体均购自上海吉玛制药有限公司;PCED1B抗体、细胞周期蛋白(Cyclin)D1抗体、酶切含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3抗体、β-catenin抗体和β-actin抗体均购自美国Santa Cruz公司;双荧光素酶报告系统购自美国Promega公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;总RNA提取试剂盒、实时荧光定量-聚合酶链反应(PCR)试剂盒、反转录(RT)-PCR试剂盒均购自宝生物工程(大连)有限公司;流式细胞仪购自美国BD公司,实时荧光定量PCR仪购自美国Bio-Rad公司。
1.2方法
1.2.1细胞培养 将SV-HUC-1细胞培养在含10% FBS的F12K培养基中,将BC细胞T24、RT4和UM-UC-3培养在RPMI1640培养液中,培养液中均添加100 U/ml青霉素和100 μg/ml链霉素,培养条件:在湿度95%,37℃ 5%CO2培养箱中培养细胞,消化传代。
1.2.2细胞转染 将RT4细胞培养至对数生长期,收集细胞,胰蛋白酶消化,以1×106个细胞/ml接种于6孔板培养,当细胞融合度达到80%时根据Lipofectamine 2000转染试剂说明书进行转染。miR-NC、miR-212-5p mimics、si-NC、si-PCED1B分别转染至RT4细胞,分别记为miR-NC组、miR-212-5p组、si-NC组、si-PCED1B组。miR-212-5p mimics和pcDNA-NC、miR-212-5p mimics和pcDNA-PCED1B分别共转染至RT4细胞,分别记为miR-212-5p+pcDNA-NC组、miR-212-5p+pcDNA-PCED1B组。
1.2.3qRT-PCR检测RNA的表达 总RNA提取试剂盒从SV-HUC-1、T24、RT4和UM-UC-3细胞中提取总RNA,然后反转录合成cDNA并检测,然后以cDNA 为模板,按照实时荧光定量PCR试剂盒的说明书进行反应,合成miR-212-5p和PCED1B mRNA。运用2-ΔΔCt法进行数据分析。
1.2.4CCK-8实验测定细胞增殖率 胰蛋白酶消化转染后的RT4细胞,培养基稀释细胞,以浓度2×103个细胞/孔(200 μl细胞)接种于96孔板,加入20 μl CCK-8溶液,培养4 h,酶标仪检测450 nm处的吸光度(A)值。细胞增殖率=实验组A值/对照组A值×100%。
1.2.5流式细胞术检测细胞凋亡 将转染后的RT4培养至对数生长期,用胰蛋白消化细胞,收集细胞,清洗细胞,稀释细胞,取5×103个细胞,弃上清,加入195 μl AnnexinV-FITC结合液轻轻重悬细胞,加入5 μl AnnexinV-FITC和10 μl碘化丙啶(PI),轻轻混匀,室温避光孵育10~20 min,然后上流式细胞仪检测细胞凋亡率。
1.2.6Western印迹 收集各组转染的RT4细胞,室温用放射免疫沉淀试验(RIPA)裂解液裂解30 min,超声破碎细胞,收集蛋白,检测蛋白浓度。进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白样本,转聚偏氟乙烯(PVDF)膜,脱脂奶粉室温封闭2 h,分别加入一抗,PCED1B抗体(1∶1 000)、CyclinD1抗体(1∶3 000)、酶切caspase-3抗体(1∶1 500)、β-catenin抗体(1∶6 000)和抗β-actin抗体(1∶2 000),4℃孵育过夜。洗膜3次,然后加入稀释的辣根过氧化物酶标二抗,室温孵育2 h。以β-actin为内参,分析蛋白水平。
1.2.7双荧光素酶报告系统实验验证miR-212-5p、PCED1B的靶向关系 根据1.2.2方法培养RT4至细胞融合度为80%,进行转染,将构建的PCED1B的野生型(WT)和突变型(MUT)双荧光素酶报告载体,分别与miR-NC或miR-212-5p共转染RT4细胞,转染48 h,收集细胞,裂解细胞,离心收集上清,-20℃保存或直接检测荧光素酶活性。以海肾荧光素酶活性为内参,计算相对萤火虫荧光素酶活性。
1.2.8Western 印迹验证miR-212-5p、PCED1B的调控关系 采用Lipofectamine 2000转染试剂说明书进行转染,将miR-NC、miR-212-5p mimics、anti-miR-NC、anti-miR-212-5p分别转染至RT4细胞,转染48 h后收集细胞,Western印迹检测PCED1B蛋白表达量。
1.3统计学方法 采用SPSS17.0软件进行独立样本t检验、单因素方差分析。
2 结 果
2.1在BC细胞系中,PCED1B高表达,miR-212-5p低表达 与人膀胱上皮细胞SV-HUC-1组相比,BC细胞系T24、RT4和UM-UC-3组细胞中miR-212-5p含量均显著下降(P<0.05),PCED1B的mRNA和蛋白表达量均显著上升(P<0.05),见表1,图1。PCED1B和miR-212-5p在T24、RT4和UM-UC-3 BC细胞系中表达情况一致,采用表达差异较大的RT4细胞进行后续实验。

表1 BC细胞系中miR-212-5p和PCED1B 表达水平

图1 Western印迹检测PCED1B蛋白表达
2.2高表达miR-212-5p抑制BC RT4细胞增殖和促进细胞凋亡 与miR-NC组相比,miR-212-5p组RT4细胞中miR-212-5p含量显著升高,CyclinD1和酶切caspase-3表达量均显著降低,细胞增殖率显著降低,凋亡率显著升高(均P<0.05),见图2,表2。说明高表达miR-212-5p可降低BC RT4细胞的增殖率,促进细胞凋亡。

A:流式细胞仪检测细胞凋亡;B:Western印迹检测CyclinD1、酶切caspase-3蛋白表达图2 高表达miR-212-5p对BC细胞RT-4增殖和凋亡的影响

表2 高表达miR-212-5p抑制BC细胞RT4细胞增殖并促进凋亡
2.3低表达PCED1B对BC细胞RT4增殖和凋亡的影响 与si-NC组相比,si-PCED1B组RT4细胞中PCED1B、CyclinD1和酶切caspase-3、细胞增殖率均显著下降(均P<0.05),凋亡率显著升高(P<0.05),见图3、表3。说明低表达PCED1B可抑制BC RT4细胞增殖并促进凋亡。

A:流式细胞仪检测细胞凋亡;B:Western印迹检测PCED1B、CyclinD1、酶切caspase-3蛋白表达图3 低表达PCED1B对BC细胞RT4增殖和凋亡的影响

表3 低表达PCED1B对BC细胞RT4增殖和凋亡的影响
2.4miR-212-5p靶向PCED1B StarBase预测发现,PCED1B的3′UTR中含有与miR-212-5p互补的位点,说明PCED1B可能是miR-212-5p的靶基因,见图4。与miR-NC组相比,miR-212-5p组PCED1B WT的荧光素酶相对活性显著下降(P<0.05);而PCED1B MUT的荧光素酶相对活性无显著差异(P>0.05)。见表4。miR-212-5p组PCED1B蛋白水平(0.39±0.04)显著低于miR-NC组(1.13±0.11,P<0.05),anti-miR-212-5p组PCED1B蛋白水平(1.42±0.14)显著高于anti-miR-NC组(1.16±0.12,P<0.05)。见图5。说明miR-212-5p靶向负向调控PCED1B的表达。
2.5恢复PCED1B表达可部分反转miR-212-5p高表达对RT4细胞凋亡和增殖的影响 恢复PCED1B表达后RT4细胞中的PCED1B、CyclinD1和酶切caspase-3表达量、细胞增殖率均显著升高(P<0.05),细胞凋亡率显著降低(P<0.05),见图6、图7、表5。说明恢复PCED1B表达可部分逆转miR-212-5p高表达对RT4细胞凋亡和增殖的影响。

图4 StarBase对miR-212-5p和PCED1B结合 进行预测

表4 双荧光素酶活性实验

1~4:miR-NC组、miR-212-5p组、anti-miR-NC组、anti-miR-212-5p组图5 Western印迹检测PCED1B表达量
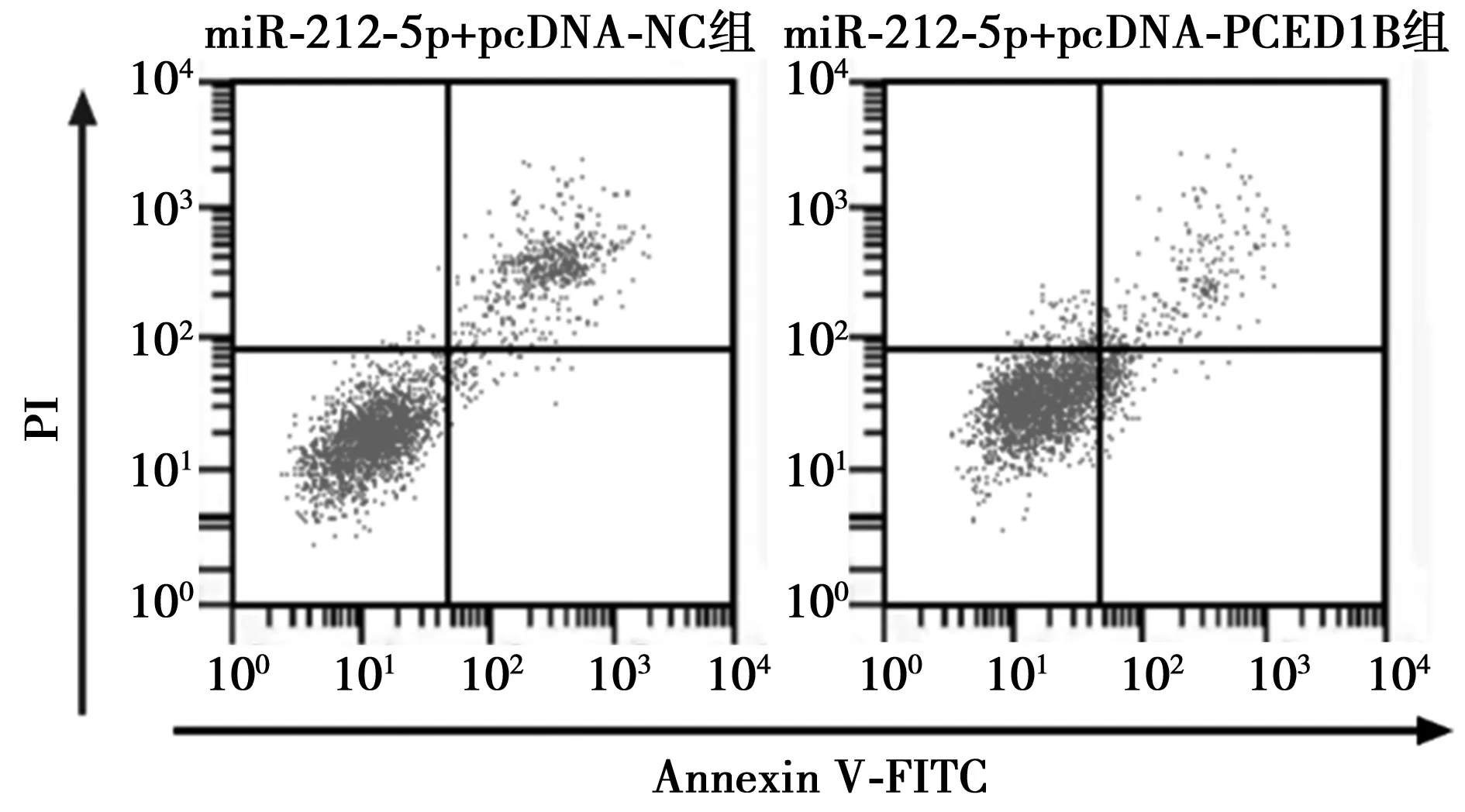
图6 流式细胞仪检测细胞凋亡

图7 Western印迹检测PCED1B、CyclinD1、 酶切-caspase-3蛋白表达

表5 高表达PCED1B可部分逆转miR-212-5p高表达对RT4细胞凋亡和增殖的影响
2.6Western印迹检测Wnt/β-catenin信号通路相关蛋白的表达 与miR-NC组β-catenin蛋白水平(0.86±0.09)相比,miR-212-5p组(0.34±0.03)显著降低(P<0.05);与miR-212-5p+pcDNA-NC组β-catenin蛋白水平(0.36±0.04)相比,miR-212-5p+pcDNA-PCED1B组(0.72±0.07)显著升高(P<0.05);见图8。说明过表达miR-212-5p可抑制Wnt/β-catenin信号通路,而恢复PCED1B表达可激活Wnt/β-catenin信号通路。

1~4:miR-NC组、miR-212-5p组、miR-212-5p+pcDNA-NC组、miR-212-5p+pcDNA-PCED1B组图8 Western印迹检测β-catenin蛋白表达
3 讨 论
BC大多是浅表性的,大约有30%的BC会演变成肌肉浸润性膀胱癌(MIBC)或转移性BC,全身化疗加放射治疗是保留膀胱的重要治疗方法,顺铂为主的化疗是转移性BC的主要治疗手段,靶向抑制剂为主要形式的个性化治疗也越来越多的用于BC,改善患者预后和延长生存期〔6〕。
研究表明,miR-212-5p与癌症〔3,4〕、创伤性脑损伤〔7〕、帕金森病〔8〕、急性髓系白血病〔9〕等多种疾病有关。miR-212-5p在调节肝脏脂质代谢方面具有新的功能,可能是治疗非酒精性脂肪性肝病(NAFLD)的潜在治疗靶点〔10〕。miR-212-5p在慢性阻塞性肺疾病(COPD)中表达下调,其可抑制COPD相关基因的过度表达,对COPD具有保护作用〔11〕。miR-212-5p在黑色素瘤组织中表达下调,其低水平与黑色素瘤细胞的增殖和侵袭有关,上调其表达可通过抑制kruppel样因子(KLF)4蛋白进而抑制癌细胞的增殖和侵袭〔12〕。本研究结果发现,与人膀胱上皮细胞SV-HUC-1相比,miR-212-5p在BC细胞系T24、RT4和UM-UC-3中表达均显著下调,与研究〔3,4,12〕结果类似;说明miR-212-5p在BC的发展中具有重要作用。
Yang等〔5〕发现PCED1B和PCED1B-AS1在胶质瘤中均表达升高,敲除PCED1B或PCED1B-AS1均可抑制胶质瘤细胞增殖并增强细胞凋亡能力,上调PCED1B可逆转PCED1B-AS1沉默对胶质瘤细胞增殖和凋亡的影响,PCED1B通过PCED1B-AS1/miR-194-5p/PCED1B信号通路在胶质瘤中发挥致癌作用〔5〕。还有研究表明,PCED1B甲基化的升高可能与消防员癌症风险增加有关〔13〕。本研究发现,PCED1B在BC细胞系A489、RT4和SN12-PM6中均表达上调,与研究〔5〕结论类似,低表达PCED1B可抑制BC RT4细胞增殖并促进凋亡。说明PCED1B在BC也发挥致癌作用。
Wnt/β-catenin信号通路在调控胚胎发育和维持成人体内干细胞平衡中起着关键作用,参与细胞等多种生理病理过程,Wnt/β-catenin通路失调与BC的发生、浸润和转移等过程密切相关〔14〕。Wnt参与了尿路上皮的发育和维持成人尿路上皮组织的稳态,Wnt/β-catenin通路关键分子的突变/表观遗传学改变与BC的发生、耐药性的发展和生存率的提高有关〔15〕。
综上,在BC RT4细胞中,miR-212-5p靶向PCED1B可能通过Wnt/β-catenin信号通路调控BC细胞凋亡和增殖。miR-212-5p可能是BC的潜在分子靶点。
