miR-214-3p通过调节SIRT7表达调控白血病细胞放疗敏感性
2022-08-26马莉莎王嵘柴丽霞
马莉莎 王嵘 柴丽霞
(青海省第五人民医院放疗科,青海 西宁 810007)
微小RNA(miRNA)是一种内源性非编码单链RNA分子,广泛存在于真核生物中,长度19~25 nt。尽管miRNA不编码蛋白质,但它通过在转录后水平与特定靶标mRNA的3'非翻译区(3'UTR)相互作用来降解或抑制翻译,并调节靶mRNA的表达,进一步参与肿瘤的发展,包括增殖、侵袭、转移和放疗敏感性〔1~3〕。研究发现,不同肿瘤中miRNA的失衡与肿瘤细胞的放疗敏感性密切相关,例如miR-451a〔4〕。miR-214-3p是miRNA家族成员之一,参与乳腺癌〔5〕、肺癌〔6〕、视网膜母细胞瘤〔7〕等的进展。Hsieh等〔8〕报道,miR-214-3p诱导小儿颅内非生殖性恶性生殖细胞肿瘤的顺铂耐药性的表达。He等〔9〕发现,miR-214-3p在急性淋巴细胞白血病细胞中低表达,然而其在白血病中的生物学功能和意义仍有待揭示。沉默信息调节因子(SIRT)7是Sir2组蛋白脱乙酰酶家族的成员,在许多生理过程中起作用,包括细胞代谢、衰老和凋亡〔10〕。急性髓细胞白血病细胞暴露于氯法拉滨、氟达拉滨和白消安药物组合或克拉屈滨、氟达拉滨和白消安药物组合可导致60%~80%的细胞增殖抑制,SIRT7等蛋白水平的降低,细胞凋亡激活和应激反应信号通路、蛋白激酶B(AKT)通路的下调〔11〕。miR-125a-5p可以靶向调控SIRT7并进一步上调肺癌细胞的凋亡,从而增加其对辐射的敏感性,SIRT7过表达降低了辐射诱导的细胞凋亡〔12〕。但miR-214-3p的异常表达是否与白血病放疗敏感性有关,以及miR-214-3p是否通过靶向SIRT7影响白血病细胞的放疗敏感性,目前尚不清楚。因此,本研究考察miR-214-3p对SIRT7的靶向调控及对白血病细胞放疗敏感性的影响,为更好地了解抗辐射机制提供了一个新的视角。
1 材料与方法
1.1细胞与主要试剂 人骨髓基质细胞系HS-5,白血病细胞系K562、HL-60、OCI-AML3(美国典型培养物保藏中心),RPMI1640培养基(美国Gibco),Lipofectamine 2000试剂(美国Invitrogen),SIRT7抗体、细胞周期蛋白(Cyclin)D1抗体、γ-H2AX抗体、磷酸化(p)-磷脂酰肌醇-3激酶(PI3K)抗体、p-AKT抗体、β-肌动蛋白(β-actin)抗体和辣根过氧化物酶(HRP)标记的二抗(英国Abcam),噻唑蓝(MTT)、二甲基亚砜(DMSO,美国Sigma)。
1.2细胞培养与转染 细胞HS-5、K562、HL-60、OCI-AML3在含有10%胎牛血清和100 U/ml青霉素-链霉素的RPMI1640培养基中,在37℃、5% CO2、饱和湿润条件下培养。细胞转染时,选取对数生长期的K562细胞,以1×105/孔接种在6孔板中,根据Lipofectamine 2000试剂制造商的说明,将miR-214-3p及其阴性对照miR-NC,si-SIRT7及其阴性对照si-NC,anti-miR-214-3p及其阴性对照anti-miR-NC,pcDNA-SIRT7及其阴性对照pcDNA-NC转染到K562细胞中,转染后48 h进行后续实验。
1.3实时定量PCR(qPCR)检测miR-214-3p和SIRT7 mRNA水平 收集细胞HS-5、K562、HL-60、OCI-AML3,使用TRIzol试剂提取总RNA。分别使用逆转录试剂盒和SYBR Green试剂盒进行逆转录和qPCR。U6或GAPDH用作内源性对照,通过2-ΔΔCt标准化和估计miR-214-3p和SIRT7 mRNA的相对表达。引物序列如下:miR-214-3p正义链5'-GCATCCTGCCTCCACATGCAT-3',反义链5'-GCGCTGAGGAATAATAGAGTATGTAT-3';U6正义链5'-TGACTTCCAAGTACCATCGCCA-3',反义链5'-TTGTAGAGGTAGGTGTGCAGCAT-3';SIRT7正义链5'-CAGGGAGTACGTGCGGGTGT-3',反义链5'-TCGGTCGCCGCTTCCCAGTT-3';GAPDH正义链5'-AAGTGAAGCAGGAGGGTGGAA-3',反义链5'-CAGCCTCACCCCATTTGATG-3'。
1.4Western印迹检测SIRT7、CyclinD1、γ-H2AX、p-PI3K和p-AKT蛋白的表达 收集细胞HS-5、K562、HL-60、OCI-AML3,检测SIRT7蛋白表达。收集不同处理的细胞K562,检测SIRT7、CyclinD1、γ-H2AX、p-PI3K和p-AKT蛋白的表达。细胞在RIPA1640裂解缓冲液中提取总蛋白,通过双辛可宁酸测定法估算蛋白浓度。将50 μg蛋白通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离。将分离的蛋白质转移到聚偏二氟乙烯膜上,将膜用5%脱脂牛奶封闭印迹。之后,将膜与SIRT7、CyclinD1、γ-H2AX、p-PI3K、p-AKT和参照β-actin一抗(1∶1 000稀释)进行反应,后加入辣根过氧化物酶(HRP)标记的二抗(1∶5 000稀释),然后进行化学发光反应。使用ImageJ程序进行条带分析。
1.5MTT检测白血病细胞K562增殖 收集细胞K562,以1×105/孔接种于96孔板中。经不同的处理后,加入MTT至终浓度为0.5 mg/ml,并将细胞在37℃下孵育4 h。加入150 μl二甲基亚砜(DMSO)摇床震荡10 min,用酶标仪在490 nm下读取光密度,计算细胞存活率。
1.6细胞克隆实验和单机多靶模型检测白血病细胞K562的放射敏感性 收集转染后的细胞K562,使用5个照射剂量点(0、2、4、6、8 Gy)的X射线,以5 Gy/min的剂量率照射细胞,细胞与辐射源之间的距离为100 cm。当细胞培养板中出现明显的细胞克隆时,甲醇和结晶紫分别固定、染色30 min。于显微镜下记录大于50的细胞克隆数,其中,克隆形成率=克隆数/接种细胞数×100%,存活分数(SF)=照射细胞的克隆形成率/对照细胞的克隆形成率×100%。单机多靶模型通过GraphPad Prism 5软件进行,拟合细胞K562的存活曲线,计算放射生物学参数平均致死量(D0)、准闭剂量(Dq)、外推值(N),得出增敏比(SER)。
1.7生物信息软件预测和双荧光素酶活性检测miR-214-3p与SIRT7的靶向关系 用TargetScan预测miR-214-3p和SIRT7的靶向结合,双荧光素酶活性检测进一步证实,即构建含有miR-214-3p结合位点的SIRT7-3'UTR野生型(WT)及突变型(MUT)报告基因载体,在K562细胞中转染miR-214-3p或miR-NC和SIRT7-WT或SIRT7-MUT报告基因载体,转染后48 h,根据制造商的说明,使用双荧光素酶报告基因检测系统分析细胞的荧光素酶活性。
1.8统计学分析 采用SPSS22.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1白血病细胞系中miR-214-3p和SIRT7的表达水平 表1和图1结果显示,与人骨髓基质细胞HS-5比较,白血病细胞K562、HL-60、OCI-AML3中miR-214-3p表达量明显减少,SIRT7 mRNA和SIRT7蛋白表达量显著增加(P<0.05),其中,以K562细胞的差异最为显著,因此,后续研究选取白血病细胞K562为对象。
表1 白血病细胞系中miR-214-3p和 SIRT7表达水平
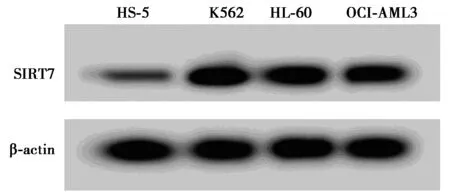
图1 Western印迹检测白血病细胞系中SIRT7蛋白的表达
2.2高表达miR-214-3p对白血病细胞K562增殖和放射敏感性的影响 表2、表3、表4和图2结果显示,与miR-NC组比较,miR-214-3p组明显增加白血病细胞K562中miR-214-3p的表达量,显著降低CyclinD1蛋白水平,并明显提高γ-H2AX蛋白表达量,减少细胞存活率及显著降低白血病细胞K562 2、4、6、8 Gy时的存活分数(P<0.05),细胞SER为1.348。
表2 高表达miR-214-3p对白血病细胞 K562增殖的影响
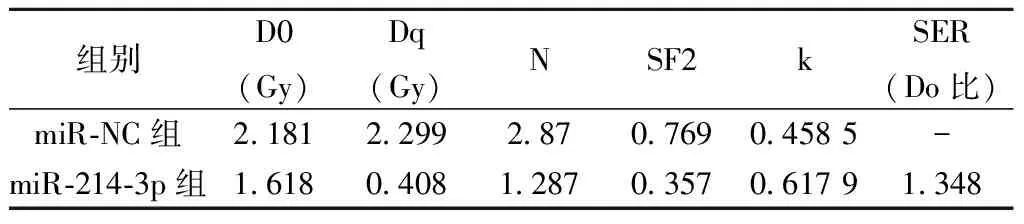
表3 高表达miR-214-3p对白血病细胞 K562放射敏感性的影响
表4 高表达miR-214-3p对白血病细胞K562存活分数的影响
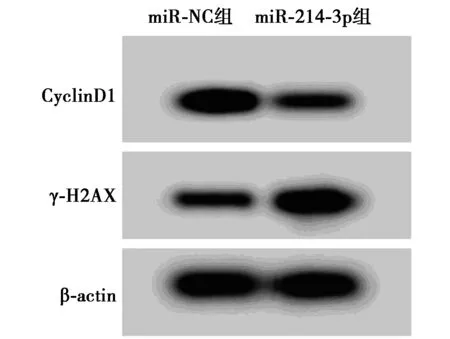
图2 Western印迹检测白血病细胞K562中 CyclinD1、γ-H2AX蛋白的表达
2.3SIRT7低表达对白血病细胞K562增殖和放射敏感性的影响 图3、表5、表6和表7结果显示,与si-NC组比较,si-SIRT7组明显降低白血病细胞K562内SIRT7、CyclinD1的蛋白水平,显著提高γ-H2AX蛋白表达量,明显减少细胞存活率,并且显著降低白血病细胞K562的存活分数(P<0.05),细胞SER为1.422。
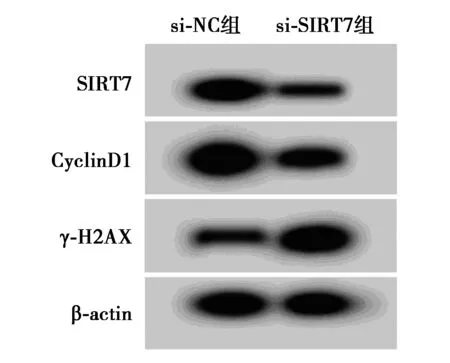
图3 SIRT7低表达对白血病细胞K562增殖
表5 SIRT7低表达对白血病细胞K562增殖的影响

表6 SIRT7低表达对白血病细胞K562放射敏感性的影响
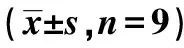
表7 SIRT7低表达对白血病细胞K562存活分数的影响
2.4miR-214-3p靶向调控SIRT7的表达 图4A的TargetScan软件预测结果发现,miR-214-3p和SIRT7的3'UTR具有靶向结合位点。图4B和表8、表9结果显示,与miR-NC和SIRT7-WT报告质粒共转染比较,miR-214-3p和SIRT7-WT报告质粒共转染明显降低白血病K562细胞的荧光素酶活性(P<0.05),而miR-NC或miR-214-3p和SIRT7-MUT报告质粒共转染对K562细胞的荧光素酶活性无显著影响(P>0.05);K562细胞中转染miR-214-3p较转染miR-NC明显减少SIRT7蛋白表达量(0.37±0.03 vs 0.92±0.09,P<0.05),转染anti-miR-214-3p较转染anti-miR-NC显著提高SIRT7蛋白水平(1.28±0.12 vs 0.42±0.04,P<0.05)。
2.5高表达SIRT7可以逆转miR-214-3p对白血病细胞K562增殖和放射敏感性的影响 表9、表10、表11和图5结果表明,与miR-214-3p和pcDNA-NC共转染比较,miR-214-3p和pcDNA-SIRT7共转染明显增加白血病细胞K562的SIRT7和CyclinD1蛋白表达量,显著减少γ-H2AX蛋白表达量,明显提高细胞存活率和细胞的存活分数(P<0.05),SER为0.683。
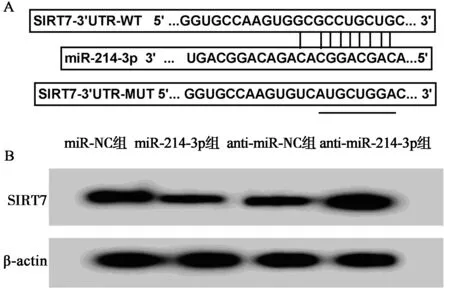
A:生物信息软件预测miR-214-3p与SIRT7靶向关系B:Western Blot检测白血病细胞K562中SIRT7蛋白表达量图4 miR-214-3p靶向SIRT7,调控SIRT7表达
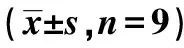
表8 miR-NC或miR-214-3p与报告质粒共转染白血病细胞 K562后的双荧光素酶活性检测
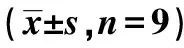
表9 高表达SIRT7可以逆转miR-214-3p对白血病细胞K562增殖和放射敏感性的影响

表10 各组白血病细胞K562转染处理联合X射线照射对K562细胞作用的单击多靶模型参数值
表11 高表达SIRT7可以逆转miR-214-3p对白血病细胞K562存活分数的影响
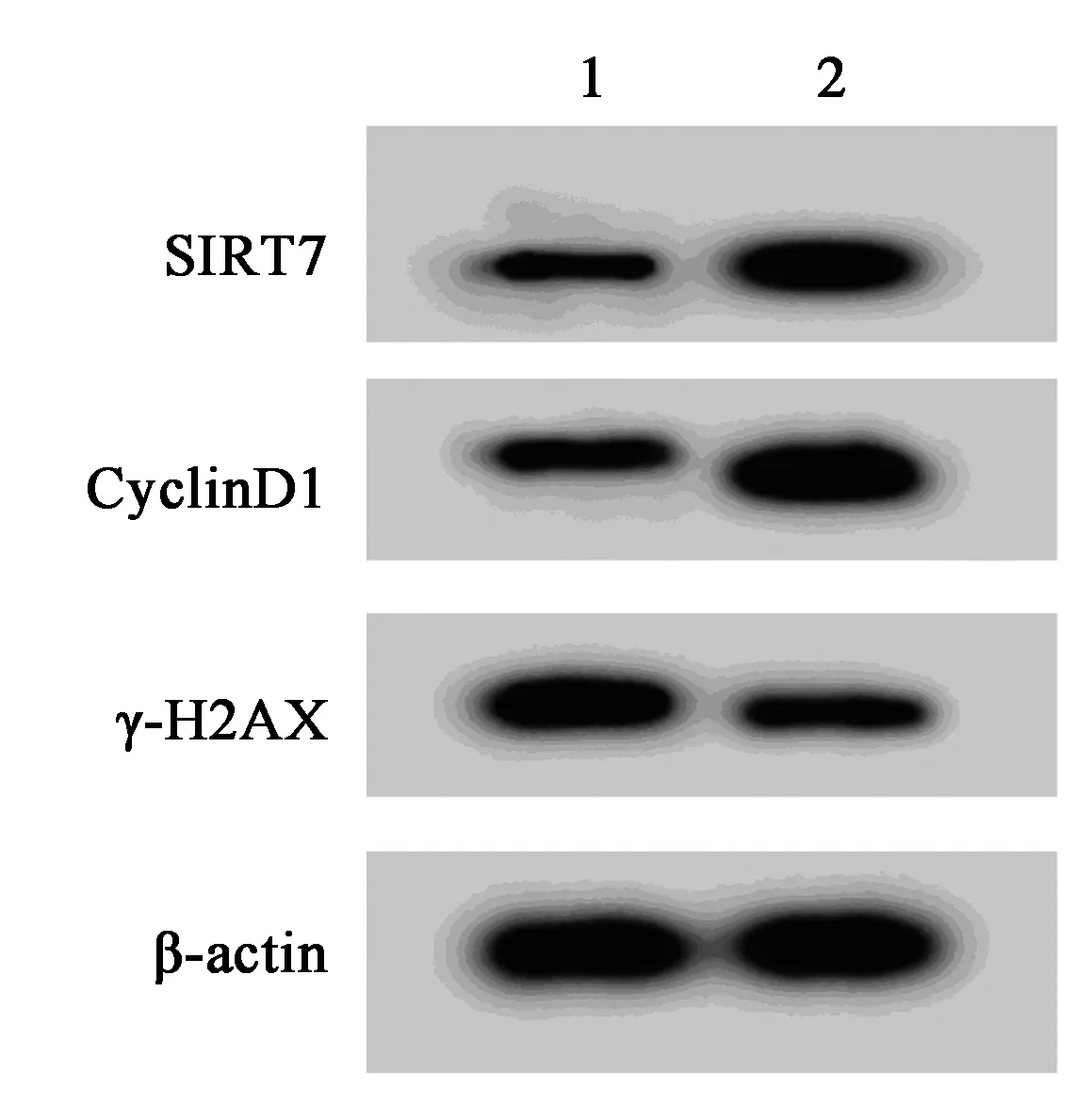
1,2:miR-214-3p+pcDNA-NC组,miR-214-3p+pcDNA-SIRT7组图5 高表达SIRT7可逆转 miR-214-3p对白血病细胞K562增殖
2.6白血病细胞K562中PI3K/AKT信号通路相关蛋白的表达 表12和图6检测结果显示,与miR-NC组比较,高表达miR-214-3p明显减少K562细胞的p-PI3K和p-AKT蛋白表达量(P<0.05);与miR-214-3p和pcDNA-NC共转染比较,miR-214-3p和pcDNA-SIRT7共转染显著提高K562细胞的p-PI3K和p-AKT蛋白水平(P<0.05)。
表12 NF-κB信号通路相关蛋白的表达

1~4:miR-NC组,miR-214-3p组,miR-214-3p+pcDNA-NC组,miR-214-3p+pcDNA-SIRT7组图6 Western印迹检测p-PI3K和p-AKT蛋白的表达
3 讨 论
白血病是常见的恶性血液病之一,作为一种恶性肿瘤,联合化疗、靶向治疗和造血干细胞移植是白血病常用的临床治疗方法,其中,联合化疗是主要的治疗方法。随着放射治疗技术的发展,化学疗法与放射疗法相结合已成为在造血干细胞移植之前进行预处理的重要手段〔13〕。简单的大剂量化疗无法起到清髓作用,并且,由于化疗药物的局限性,很难通过化学疗法清除肿瘤细胞,使肿瘤细胞复发〔14〕,而放射治疗有助于解决这一难题〔15〕。因此,了解对放射疗法的抗性机制和提高治疗功效对于发掘针对白血病的新疗法非常重要。一些研究人员已经证明,肿瘤细胞中miRNA的表达失调可通过调节靶mRNA的表达来影响其对放疗的敏感性〔2〕。因此,miRNA可能成为克服肿瘤细胞放疗抵抗的先进途径之一。本研究揭示了白血病细胞系K562、HL-60、OCI-AML3中miR-214-3p表达水平的变化及miR-214-3p对K562细胞X射线照射的敏感性。miR-214-3p通过调节SIRT7并影响PI3K/AKT信号传导途径提高了白血病K562细胞的放疗敏感性。本研究证实了miR-214-3p参与白血病细胞放疗敏感性的机制,为克服白血病细胞的辐射抵抗提供了一条新途径。
miRNA通过多种机制在癌症中发挥着重要作用,引起了越来越多的关注。许多miRNA,作为抑癌基因或原癌基因参与肿瘤的发生发展过程〔16〕,包括白血病〔17,18〕。资料显示,miR-214-3p在三阴乳腺癌中低表达,通过靶向ST6GAL1抑制癌细胞的存活、迁移、侵袭和上皮间充质转化(EMT)〔19〕。miR-214-3p在子宫内膜癌组织和细胞中下调,miR-214-3p的过表达抑制了癌细胞的迁移和EMT,而其敲低则促进了子宫内膜癌的进展〔20〕。在结直肠癌中miR-214-3p低表达,高表达抑制细胞的增殖、迁移和侵袭,miR-214-3p可能是肿瘤抑制因子。He等〔9〕报告指出,急性淋巴细胞白血病细胞中的miR-214-3p表达下调,然而其在白血病放疗敏感性中的作用仍不清楚。本实验同样检测到miR-214-3p在白血病细胞K562、HL-60、OCI-AML3中的表达量明显减少,提示在白血病中,miR-214-3p可能具有抑癌活性。本研究功能试验结果说明miR-214-3p可以抑制白血病细胞的增殖,从而增强其放疗敏感性。总体而言,这些结果表明miR-214-3p的高表达是改善白血病辐射抗性的重要因素之一,并且可能成为调节肿瘤细胞放疗敏感性的潜在靶标。
本实验结果还表明,SIRT7是该过程的重要组成部分,其表达对于miR-214-3p诱导的白血病细胞放疗敏感性至关重要。根据报道,SIRT7在人脑胶质瘤组织中表达上调,其高表达与胶质瘤恶性程度呈正相关〔10〕。SIRT7的敲除通过抑制前列腺癌中的雄激素受体信号传导,来抑制细胞的增殖,还可增加前列腺癌细胞对辐射的敏感性〔21〕。本实验中,白血病细胞K562、HL-60、OCI-AML3中SIRT7 mRNA和SIRT7蛋白表达显著上调,SIRT7低表达明显抑制白血病K562细胞的增殖和CyclinD1蛋白表达,促进磷酸化组蛋白H2AX(γ-H2AX)表达,并明显降低不同剂量X射线照射后K562细胞的存活分数,提示SIRT7低表达通过抑制白血病细胞的增殖,来提高放疗敏感性,与前人研究〔22〕相符。基于这些发现,SIRT7抑制似乎是白血病放射治疗的潜在增强剂。本研究结果证实,通过靶向调节SIRT7的表达水平,miR-214-3p可以改变白血病细胞对放疗的敏感性。
PI3K/AKT信号通路参与细胞生长,增殖和分化,并在肿瘤的发生、发展、治疗和结果中起重要作用,其异常激活是肿瘤抗辐射性的重要机制〔23〕。PI3K是一种在细胞内具有催化活性的信号蛋白,可由细胞外细胞因子、药物、应激和其他因素激活。激活后的PI3K可以促进AKT的激活,调节多种细胞增殖相关的基因和其他基因的表达〔24〕。高表达miR-214-3p明显降低K562细胞的p-PI3K和p-AKT蛋白表达,而这种抑制作用被高表达SIRT7所逆转。表明miR-214-3p通过靶向SIRT7,并影响PI3K/AKT信号通路的活性,来介导白血病细胞的放疗敏感性。
总之,miR-214-3p通过抑制白血病细胞的增殖能力,增强其放疗敏感性,机制与靶向SIRT7调节PI3K/AKT信号通路有关。这些结果可能有助于对白血病或其他显示miR-214-3p或SIRT7表达异常的癌症患者实施个性化治疗,从而提高放射治疗的效率。并且,这些结果可能会提供基于miR-214-3p/SIRT7/PI3K/AKT信号传导途径的潜在治疗靶点,以克服肿瘤的辐射抗性。
