氧化铜/蛋白质复合物的过氧化物酶及抗菌活性
2022-08-26石成,吕中
石 成,吕 中
武汉工程大学环境生态与生物工程学院,湖北 武汉 430205
细菌引起的感染已成为威胁人类健康的常见病、多发病,抗生素是治疗细菌感染的主要药物[1]。随着抗生素的广泛使用甚至滥用导致细菌产生了严重的耐药性问题[2-3],而新批准上市的抗生素越来越少[4],因此开发新型抗菌剂迫在眉睫。
近年来一类具有类似天然酶活性的纳米材料——纳米酶广受关注。纳米酶具有类似天然酶的高效催化活性,同时还具有稳定性强、易于生产且成本低的优点,在生化检测、疾病诊断等领域显示出了巨大应用前景[5]。近年来研究发现具有过氧化物酶活性的纳米酶具有抗菌活性,且细菌不易产生耐药性[6-7]。这些纳米酶通过催化过氧化氢(H2O2)产生毒性更高的羟基自由基(•OH)等活性氧物质,对细菌产生杀伤作用。目前已报道的具有抗菌活性的纳米酶主要有金属单质及金属氧化物等,例如,Wu 等[8]合成具有过氧化物酶性能的铂中空纳米枝晶,对小鼠的伤口感染具有较好疗效;Wang 等[9]合成钴钒混合金属氧化物纳米酶,对大肠杆菌具有高效的杀伤效果。
氧化铜(CuO)是一种性能优良的P 型多功能窄禁带半导体,其制造成本低且化学性质稳定,已广泛应用于气体传感器、催化、电池以及高温超导体等领域[10]。目前已报道CuO 具有过氧化物酶活性[11],可用于废水处理[12]和分子检测[13]等领域,但利用其过氧化物酶活性进行抗菌的研究却鲜有报道。
本研究以牛血清白蛋白(bovine serum albumin,BSA)为模板合成纳米CuO,使材料具有良好的生物相容性和稳定性[14-15]。进一步研究所合成材料的过氧化物酶活性及抗菌活性,为开发生物相容性好的纳米酶抗菌剂提供实例。
1 实验部分
1.1 实验原料与仪器
BSA(阿拉丁试剂有限公司);三水合硝酸铜[Cu(NO3)2·3H2O](国药集团化学有限公司);3,3',5,5'-四 甲 基 联 苯 胺(3,3',5,5'-tetramethylbenzidine,TMB)(Sigma-Aldrich 有限公司);对苯二甲酸(terephthalic acid,TA)(Adamas 有限公司);其他试剂均采用分析纯。
金黄色葡萄球菌(Staphylococcus aureus,S.aureus,ATCC9118)(中国典型培养物保藏中心);Mueller-Hinton(MH)生物培养基(AOBOX 有限责任公司)。
X-射线 衍 射 仪(X-ray diffractometer,XRD)(型号SmartLab SE,日本理学株式会社)、场发射扫描电子显微镜(field emission scanning electron microscope,FE-SEM)(型号SU8010,日立高新技术公司)、激光粒度仪(laser particle size analyzer,DLS)(型号Zetasizer Nano ZS,英国马尔文仪器有限公司)、紫外可见分光光度计(ultra-violet and visible spectrophotometer,UV-vis)[型号UV-1900,岛津仪器(苏州)有限公司]、荧光分光光度计(型号F-4700,日立高新技术公司)、同步热分析仪(synchronous thermal analyzer, TGA)( 型 号STA449F5 Jupiter,德国耐驰仪器制造有限公司)、傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR)(型号TENSON II,德国布鲁克公司)。
1.2 CuO-BSA 纳米复合物的制备与表征
将60 mg Cu(NO3)2·3H2O 和125 mg BSA 分别溶解在25 mL 水中,混合后在室温下搅拌30 min,缓慢滴加1 mL 氢氧化钠(1 mol/L)溶液,将混合物置于85 ℃水浴反应2 h。将反应后的溶液于10 000 r/min 下离心15 min 收集沉淀,分别用纯水和无水乙醇各洗涤3 次,冷冻干燥后得到CuO-BSA。另外,在不加BSA 且其他条件不变的情况下合成CuO。
采用XRD 对合成的材料组成进行分析,扫描角度为20°~90°;采用TGA 和FTIR 分析材料的组分;采用DLS 分析材料的粒径;采用FE-SEM 观察CuO-BSA 纳米复合物的形貌及大小。
1.3 CuO-BSA 纳米复合物的过氧化物酶活性及稳态动力学测定
CuO-BSA 的过氧化物酶活性测定:在醋酸缓冲液(pH 4.0,0.2 mol/L)中依次加100 μL 2 mg/mL的CuO-BSA 复合物、50 μL 100 mmol/L 的H2O2溶液和50 μL 24 mmol/L 的TMB 溶液构成2 mL 体系,于35 ℃反应20 min,12 000 r/min 条件下离心2 min,取上清液进行UV-vis 扫描。以CuO-BSA+TMB 组、H2O2+TMB 组 以 及 单 独TMB 组 作 为 对照。实验重复3 次。
稳态动力学研究采用固定一种底物浓度,测定反应速率随另一种底物浓度变化的曲线。
CuO-BSA 催化TMB 动力学测定:向1 800 μL醋酸盐缓冲液中分别加入50 μL浓度为400 mmol/L的H2O2溶液、50 μL 浓度分别为0.4~24 mmol/L 的TMB 溶液和100 μL 质量浓度为2 mg/mL 的CuOBSA复合物,混匀后进行UV-vis扫描。实验重复3次。
CuO-BSA 催化H2O2动力学测定:向1 800 μL醋酸盐缓冲液中分别加入50 μL 浓度为24 mmol/L的TMB溶液、50 μL浓度分别为0.4~4 mol/L的H2O2溶液和100 μL 质量浓度 为2 mg/mL 的CuO-BSA复合物,混匀后进行UV-vis 扫描。实验重复3 次。
所有反应均是测定反应开始300 s 内氧化态TMB(oxidation state TMB,oxTMB)在652 nm 处的吸光度随时间变化的曲线,然后由公式(1)计算得到相对应浓度底物的初始反应速率V,如下:
其中,ΔC为Δt时间段内oxTMB 的浓度变化值,ΔA为Δt时间段内oxTMB 在652 nm 处的吸光度变化 值,ε为oxTMB 在652 nm 处的摩尔吸光 系 数[39 000(mol/L)-1·cm-1][16],L为光程长(1.0 cm)。
然后,对初始反应速率V和初始体系中的底物浓度[S]用米氏方程[Michaelis-Menten 拟合(公式2)][16],如下:

其中,V为初始反应速率,[S]为底物浓度,Vmax为最大反应速率,Km为米氏常数。Km值反应纳米酶对底物的亲和力,值越小,说明酶对底物的亲和力越高,反之则越低。
1.4 羟基自由基测定
在醋酸缓冲液中加入100 μL 2 mg/mL 的CuO-BSA 复合物、100 μL 20 mmol/L 的H2O2溶液和100 μL 10 mmol/L 的TA 溶液构成2 mL 体系,反应2 h,测定315 nm 激发下的荧光光谱。以CuOBSA+TA 组、H2O2+TA 组 和 单 独TA 组 作 为 对 照。实验重复3 次。
1.5 CuO-BSA 复合物催化H2O2抗菌活性测定
将100 μL 1×106CFU/mL 菌 液 与 终 浓 度 为1 mmol/L H2O2和100 μg/mL CuO-BSA 混合,反应体系为2 mL,37 ℃培养1 h,取菌液涂布平板,37 ℃恒温培养24 h 后进行菌落计数。以细菌+H2O2、细菌+CuO-BSA 和细菌三组作为对照组。实验重复3 次,每次取3 个平行。
2 结果与讨论
2.1 材料表征
图1(a)为所合成的CuO-BSA 和CuO 的XRD图谱。从图中可知,CuO-BSA 和CuO 两者衍射峰与单斜CuO 的标准卡片谱(JCPDS 48-1548)对应,表明这2 种材料均为CuO。图1(b)为CuO-BSA、CuO 和BSA 的TGA 图谱。可知,当温度达到600 ℃时,CuO-BSA 剩余的质量分数约为74%,CuO 剩余的质量分数约为95%,BSA 剩余的质量分数约为22%,这说明CuO-BSA 上负载有BSA。从FTIR 图中可以看出,CuO-BSA 在1 653 cm-1和1 559 cm-1处、BSA 在1 653 cm-1和1 540 cm-1处均各有2 个肽键特征峰,而CuO 处无相应的特征峰,这进一步说明CuO-BSA 上存在着BSA[图1(c)]。合成的CuO-BSA 平均粒径为201.2 nm[图1(d)]。图1(e)和图1(f)为CuO-BSA 的FE-SEM 图。从图中可知,CuO-BSA 为梭状,表面粗糙,颗粒大小分布较为均匀,颗粒的尺寸与DLS 结果基本一致。
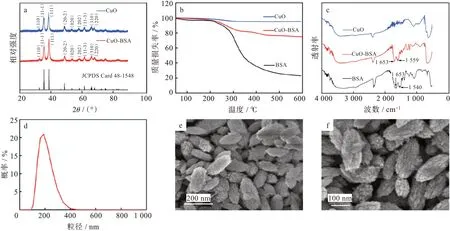
图1 CuO-BSA 纳米复合物的表征:(a)XRD 图谱,(b)TGA 曲线,(c)FTIR 图谱,(d)DLS 图,(e,f)FE-SEM 图Fig.1 Characterization of CuO-BSA nanocomposites:(a)XRD patterns,(b)TGA curves,(c)FTIR spectra,(d)DLS diagram and(e,f)FE-SEM images
2.2 CuO-BSA 复合物的过氧化物酶活性
过氧化物酶催化H2O2还原,同时无色底物TMB 氧化为蓝色的oxTMB,其在652 nm 处有最大吸收峰[8],反应式(3)如下:

基于此,CuO-BSA 复合物的过氧化物酶活性结果如图2(a)所示。单独TMB 体系和TMB+CuO-BSA 体系在652 nm 未出现特征吸收峰,说明TMB 没有发生氧化反应。无CuO-BSA 时,TMB+H2O2体系在652 nm 处有1 个弱的吸收峰,说明TMB 能被H2O2弱氧化。CuO-BSA 存在时652 nm处吸收值显著增加,表明反应体系中产生了更多氧化产物oxTMB。综上结果表明,CuO-BSA 复合物能催化H2O2氧化TMB,具有类似天然过氧化物酶的活性。
进一步考察材料浓度、pH 和温度对CuO-BSA类酶活性的影响。由图2(b)可知,随着CuO-BSA浓度增加,反应速率增加,表明CuO-BSA 的催化活性存在浓度依赖关系。CuO-BSA 复合物的类酶活性受pH 和温度的影响,酶催化反应存在最适pH 和最适温度,pH 为4 和温度为55 ℃时反应速率达到最大。随着pH 和温度的增加,反应速率反而下降,当pH 为6 时,CuO-BSA 复合物仅保留26.0%的相对活性,而当反应温度达到75 ℃时,该复合物的相对活性仅存22.4%[图2(c)和图2(d)]。天然辣根过氧化物酶(horseradish peroxidase,HRP)的最适温度为40 ℃,并且55 ℃时活性仅剩约50%[17]。CuO-BSA 复合物与天然HRP 相比,最适温度提高约15 ℃,表现出更高的热稳定性以及能承受更高的反应温度。
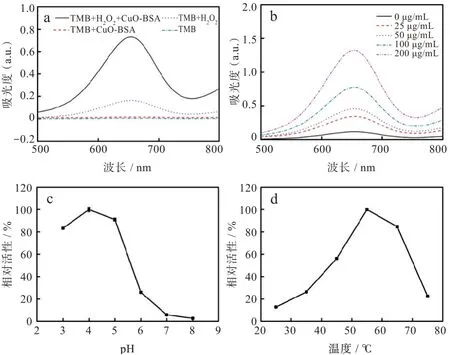
图2 CuO-BSA 过氧化物酶活性及反应条件对酶活性的影响:(a)CuO-BSA过氧化物酶活性,(b)不同浓度的CuO-BSA过氧化物酶活性,(c)pH,(d)温度Fig.2 CuO-BSA peroxidase activity and effect of reaction conditions on enzyme activity:(a)CuO-BSA peroxidase activity,(b)CuO-BSA peroxidase activity at different concentrations,(c)pH,(d)temperature
2.3 CuO-BSA 复合物的过氧化物酶稳态动力学
CuO-BSA 复合物催化H2O2氧化TMB 的反应速率与底物浓度的关系见图3,通过Origin 2018 软件计算得出CuO-BSA 复合物对底物TMB 和H2O2的动力学参数Vmax值和Km值,列于表1 中,并与天然HRP 以及已报道的Fe3O4纳米酶的动力学参数进行比较。复合物CuO-BSA 对底物TMB 的Km值为0.29 mmol/L,低 于HRP,高 于Fe3O4,说 明CuO-BSA 对底物TMB 的亲和力高于HRP,却比Fe3O4纳米酶低。另一方面,CuO-BSA 对底物H2O2的Km值 低 于Fe3O4,高 于HRP,说 明CuO-BSA 对底物H2O2的亲和力高于Fe3O4,却又低于HRP。CuO-BSA 对底物TMB 和H2O2的Vmax值比HRP、Fe3O4对两种底物的Vmax值低。以上结果表明,用生物大分子BSA 作为模板和分散剂合成的纳米CuO,对底物TMB 表现出的亲和力较天然HRP 更高。
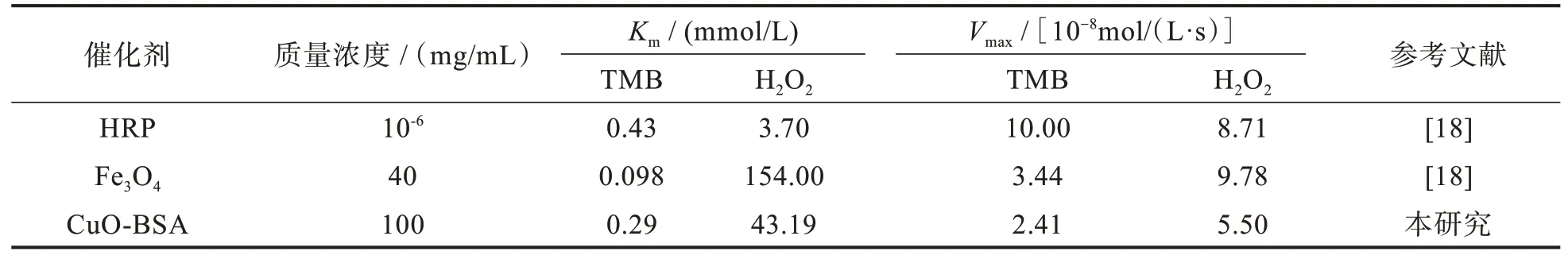
表1 CuO-BSA 与HRP 及Fe3O4纳米酶的动力学参数比较Tab.1 Comparison of kinetic parameters of CuO-BSA with HRP and Fe3O4 nanozymes

图3 CuO-BSA 复合物的稳态动力学曲线:(a)反应速率随TMB浓度变化的曲线,(b)反应速率随H2O2浓度变化的曲线Fig.3 Steady-state kinetic curves of CuO-BSA complex:(a)curve of reaction rates at different TMB concentrations,(b)curve of reaction rates at different H2O2 concentrations
2.4 羟基自由基测定
文献[19]表明,Au/CuS 纳米复合物的过氧化物酶活性来源于纳米粒子表面Cu2+的芬顿反应,其反应如下:
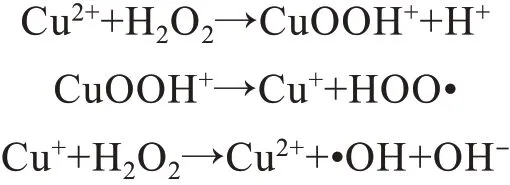
在反应过程中,Cu2+催化H2O2生成大量具有强氧化性的•OH,该•OH 能氧化底物生成有色底物。因此,推测CuO-BSA 纳米复合物的过氧化物酶活性也可能来源于该纳米粒子表面的Cu2+的芬顿反应,反应如上,该过程中产生了强氧化性的•OH,使得底物TMB 氧化生成蓝色产物oxTMB。
为了探究CuO-BSA 催化反应机理,用TA 作为荧光探针来检测•OH 的产生。TA 本身没有荧光,其捕获•OH 并与其反应形成有荧光的2-羟基对苯二甲酸(2-hydroxyterephthalic acid,TA-OH)复合物[20]。如图4所示,单独的H2O2产生少量•OH,CuO-BSA 存在时催化H2O2产生•OH 的量显著增加。以上实验结果表明CuO-BSA 催化H2O2氧化TMB 反应的过程中产生了具有强氧化性的•OH。

图4 TA 捕获•OH 的荧光光谱图,插图为对应曲线的放大图Fig.4 Fluorescence spectra of TA capturing•OH,inset showing enlarged view of corresponding curve
2.5 CuO-BSA 复合物催化H2O2抗菌活性
CuO-BSA 能催化H2O2产生•OH,而•OH 抗菌活 性 高 于H2O2[21],基于 此,评 估 了CuO-BSA 与H2O2联用对S.aureus的抗菌性能。从图5 可以看出,CuO-BSA+H2O2组的细菌存活率仅为3.1%,而单独CuO-BSA 组、单独H2O2组则分别存活了73.5%和35.3%的细菌,远远高于CuO-BSA+H2O2处理组。这一结果表明,CuO-BSA 复合物催化H2O2有显著的杀菌效果,抗菌能力的提高与CuOBSA 催化H2O2产生•OH 有关。

图5 CuO-BSA 与H2O2联用对S.aureus 的抗菌活性Fig.5 Antibacterial activity of CuO-BSA combined with H2O2 against S.aureus
3 结 论
本文以BSA 为模板,采用水热法合成了具有较好生物相容性的CuO-BSA 纳米复合材料。利用H2O2/TMB 比色体系证明了CuO-BSA 复合物具有过氧化物酶活性,在pH 为4 以及温度为55 ℃条件下表现出最佳的酶活性,相比天然HRP,最适反应温度提高约15 ℃。动力学研究表明,CuO-BSA对底物TMB 的亲和力高于HRP。CuO-BSA 催化H2O2产 生•OH,对S. aureus有较好的杀菌效果。本研究为采用纳米酶作为抗菌剂提供了实例。
