lncRNA HULC在乳头状甲状腺癌组织中的表达及意义
2022-08-26袁小笋马慧利薛永飞李长生张敬伟任中海张腾飞
冀 叶,袁小笋, 张 蕾, 马慧利, 薛永飞, 李长生, 张敬伟, 任中海, 张腾飞
(1. 南阳市中心医院肿瘤内科二病区,河南 南阳 473000;2. 郑州大学第一附属医院肿瘤一病区,河南 郑州 450001)
甲状腺癌是内分泌系统常见的恶性肿瘤,好发于女性,近年来发病率呈不断上升趋势[1]。乳头状甲状腺癌(papillary thyroid carcinoma,PTC)约占全部甲状腺癌的80%~90%[2]。多数PTC患者预后良好[3],但由于PTC起病隐匿、早期易转移,且复发率较高,导致仍有部分患者预后不良,甚至死亡[4]。因此,深入探讨PTC的发病机制,寻找与其转移、复发相关的敏感基因,对患者早期诊疗及预后改善意义重大。长链非编码RNA(long non-coding RNA,lncRNA)是一种长度在200 nt以上的RNA,可通过多种途径参与调控恶性肿瘤发生、进展过程[5]。肝癌高表达转录本(highly up-regulated in liver cancer,HULC)是新近发现的1种lncRNA,在肝细胞肝癌[6]、结直肠癌[7]、弥漫性大B细胞淋巴瘤[8]等多种恶性肿瘤组织中呈高表达,在肿瘤细胞侵袭、转移中发挥关键性作用。目前,关于HULC与PTC的研究较少。为此,本研究拟分析PTC组织中HULC的表达及其与临床病理特征的相关性,并通过干扰人PTC细胞株TPC-1中HULC的表达,探讨其对细胞增殖、侵袭的影响,以期为PTC的致病机制研究提供参考。
1 材料和方法
1.1 研究对象
选取2018年1月—2019年12月在南阳市中心医院行手术治疗的PTC患者105例,其中男31例、女74例,年龄21~72岁。TNM分期Ⅰ~Ⅱ期68例、Ⅲ~Ⅳ期37例;发生淋巴结转移39例。术中留取PTC组织及距离肿瘤边缘2 cm以上的癌旁组织(经病理学检查排除癌变可能),快速置于液氮中冷冻,-70 ℃保存。纳入标准:(1)初次手术,且经病理学检查确诊为PTC;(2)术前未接受任何治疗;(3)临床资料完整。排除标准:(1)合并其他系统恶性肿瘤患者;(2)继发性或转移性甲状腺癌患者;(3)合并其他甲状腺疾病患者;(4)妊娠或哺乳期女性。本研究经南阳市中心医院伦理委员会批准,所有患者均知情同意。
1.2 方法
1.2.1 试剂与仪器 Trizol试剂和Lipofectamine 2000均购自美国Invitrogen公司,逆转录和扩增试剂购自日本TaKaRa公司。HULC和内参引物由上海百力格生物技术有限公司设计合成。TPC-1细胞购自上海通派生物科技有限公司。RPMI-1640培养液、胎牛血清、胰蛋白酶、青霉素-链霉素均购自美国Hyclone公司。HULC抑制序列及对照序列由上海吉玛制药技术有限公司设计合成。CCK-8试剂盒购自上海碧云天生物技术有限公司。Transwell小室购自美国Corning公司,基质胶购自美国BD公司。StepOne实时荧光定量PCR仪(美国ABI公司),UV1902PC紫外分光光度计(上海奥析科学仪器有限公司),Stat Fax-2100酶标仪(北京天翔飞域科技有限公司)。
1.2.2 癌组织和癌旁组织中HULC表达的检测 取癌组织和癌旁组织,剪碎、研磨,加入细胞裂解液,按总RNA提取试剂盒说明书提取总RNA,采用UV1902PC紫外分光光度计检测纯度,以A260nm/A280nm比值>1.80为符合要求。根据逆转录试剂盒说明书要求,将总RNA逆转录为互补DNA(complementary DNA,cDNA),并以其为模板,采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)检测HULC的表达,以GAPDH为内参。反应条件:94 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s,74 ℃ 30 s,38个循环。引物序列:HULC上游引物为5'-ACCTCCAGAACTGTGATCCAAAATG-3',下游引物为 5'-GCCAGGAAACTTCTTGCTT G A-3';G A P D H上游引物为5'-CCCTTCATTGACCTCAACTA-3',下游引物为5'-TGGAAGATGGTGATGGGATT-3'。采用2-ΔΔCt法计算癌组织和癌旁组织中HULC的相对表达量。
1.2.3 细胞培养及处理 采用含10%胎牛血清、青霉素-链霉素双抗的RPMI-1640培养液,在5% CO2、37 ℃条件下进行TPC-1细胞培养。培养24 h后,采用胰蛋白酶消化,传代培养。收集对数生长期的细胞,消化后按2.5×105个/孔接种于6孔板,待细胞融合度达到80%以上时,使用Lipofectamine 2000试剂进行转染。按转染序列分为si-HULC组(转染HULC的小分子干扰序列5'-AACCTCCAGAACTGTGATCCA-3')、si-Con组(转染阴性对照序列5'-CGAGCAGAGACTCTAACATTCTCGC-3')、空白组(不作任何处理)。处理后继续培养48 h。
1.2.4 TPC-1细胞中HULC相对表达量的检测 将si-HULC组、si-Con组和空白组细胞进行处理后继续培养48 h,再用胰蛋白酶消化,置于细胞裂解液中,采用RT-qPCR检测HULC的表达情况。操作步骤同癌组织和癌旁组织中HULC表达的检测。
1.2.5 CCK-8法检测细胞增殖活性 取si-HULC组、si-Con组和空白组细胞,用胰蛋白酶消化,制备单细胞悬液,接种于96孔板,密度为2.5×105个/孔,继续培养至细胞贴壁。分别在培养12、24、48、72和96 h时加入10 μL CCK-8,避光孵育3 h,检测各孔A450nm值。
1.2.6 TPC-1细胞侵袭能力检测 取si-HULC组、si-Con组、空白组细胞,用胰蛋白酶消化,离心留取沉淀,用磷酸盐缓冲液(phosphate-buffered saline,PBS)冲洗3次,用无血清RPMI-1640培养液制备细胞悬液,密度为2.5×104个/mL,备用。取基质胶,提前24 h融化,用无血清培养液进行稀释后,平铺在Transwell小室的上室,风干备用。取制备的细胞悬液200 μL,加入Transwell小室的上室,下室加入含10%胎牛血清的RPMI-1640培养液600 μL,常规培养24 h,取出Transwell小室,PBS冲洗,甲醛固定,结晶紫染色,擦除散落的细胞,在倒置显微镜下随机取6个高倍镜视野对穿膜细胞进行计数,取均值。
1.3 统计学方法
所有实验均重复3次。采用SPSS 17.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验,多组间比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 PTC组织与癌旁组织中HULC相对表达量的比较
PTC组织中HULC的相对表达量为2.51±0.19,显著高于癌旁组织(1.02±0.07)(t=73.776,P<0.001)。
2.2 不同临床病理特征的PTC患者癌组织中HULC相对表达量的比较
肿瘤直径>2 cm、TNM分期为Ⅲ~Ⅳ期和发生淋巴结转移的PTC患者的癌组织HULC相对表达量分别显著高于肿瘤直径≤2 cm、TNM分期为Ⅰ~Ⅱ期和无淋巴结转移PTC患者(P<0.05),而不同年龄、性别、病灶数量和局部侵犯类型PTC患者间差异均无统计学意义(P>0.05)。见表1。
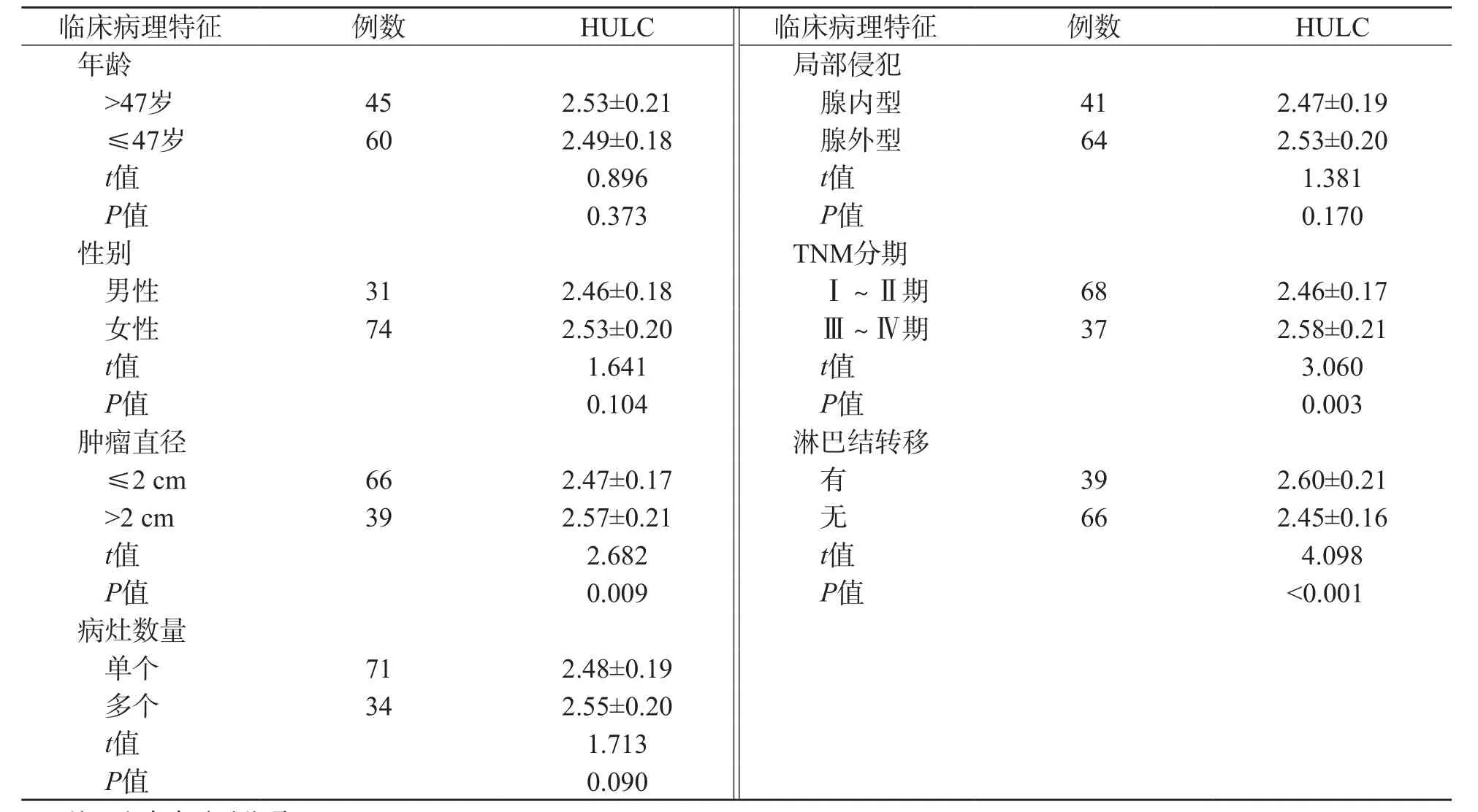
表1 不同临床病理特征的PTC患者癌组织中HULC相对表达量比较
2.3 si-HULC组、si-Con组和空白组HULC相对表达量的比较
si-HULC组、si-Con组和空白组HULC相对表达量分别为0.17±0.05、1.02±0.05和1.00±0.10,3组之间差异有统计学意义(F=293.672,P<0.001)。两两比较,si-HULC组HULC相对表达量低于si-Con组和空白组(P<0.05),si-Con组与空白组之间差异无统计学意义(P>0.05)。
2.4 si-HULC组、si-Con组及空白组细胞增殖活性比较
si-HULC组培养24、48、72和96 h时A值均低于si-Con组和空白组(P<0.05),si-Con组与空白组之间差异均无统计学意义(P>0.05)。见表2。
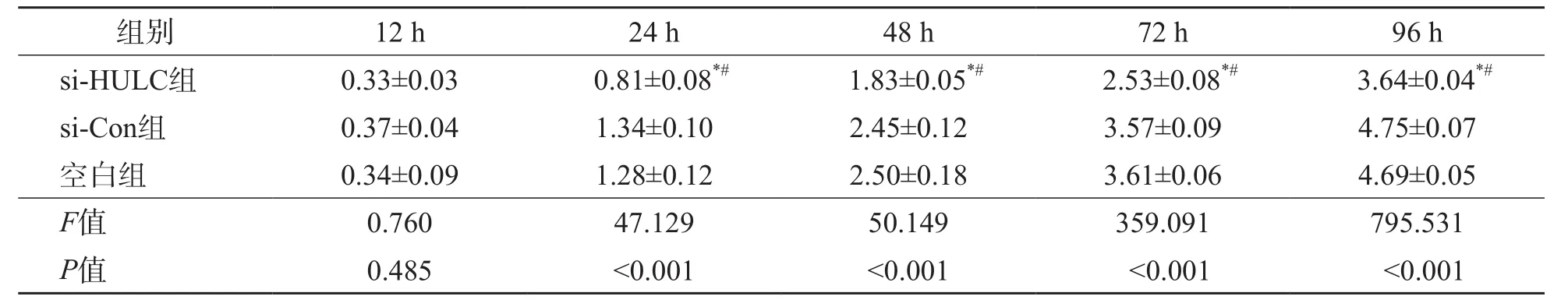
表2 si-HULC组、si-Con组、空白组培养不同时间的细胞增殖活性A值比较
2.5 si-HULC组、si-Con组及空白组细胞侵袭能力比较
si-HULC组、si-Con组和空白组侵袭细胞数分别为(84±8)个、(101±7)个和(103±7)个,3组之间差异有统计学意义(F=11.447,P=0.001)。si-HULC组侵袭细胞数低于si-Con组和空白组(P<0.05),si-Con组与空白组之间差异无统计学意义(P>0.05)。见图1。

图1 si-HULC组、si-Con组、空白组细胞侵袭情况(×200)
3 讨论
有研究结果显示,部分淋巴结转移伴局部侵犯的PTC患者会发生治疗耐受[9]。因此,开展对PTC发病机制及与肿瘤转移相关机制或敏感基因的研究具有重要的临床价值,可以为PTC的诊疗提供新的靶标。
HULC是一种高度保守的,长度为500 nt的lncRNA,位于人染色体6p24.3,在多种恶性肿瘤组织中呈特异性高表达[10],且与肿瘤侵袭、转移[11]及患者临床结局[12]密切相关,下调该基因表达可促进化疗药物诱导的肿瘤细胞凋亡[13]。本研究结果显示,PTC组织中HULC的相对表达量显著高于癌旁组织(P<0.001),提示HULC在PTC组织中呈高表达,可能参与了PTC的发生。本研究结果还显示,肿瘤直径>2 cm、TNM分期为Ⅲ~Ⅳ期和发生淋巴结转移的PTC患者的癌组织中HULC相对表达量明显升高,进一步说明HULC可能参与了PTC的发生、发展,可能在促进肿瘤生长及淋巴结转移中发挥重要作用。
为进一步探讨HULC在PTC发生及进展中的作用,本研究采用小分子干扰RNA技术特异性沉默TPC-1细胞中HULC的表达,结果显示,si-HULC组HULC相对表达量低于si-Con组和空白组(P<0.05),说明转染HULC干扰序列后,si-HULC组TPC-1细胞中的HULC表达被抑制。有研究结果显示,HULC在肿瘤细胞恶性增殖过程中发挥关键性作用[14]。本研究结果显示,si-HULC组培养24、48、72和96 h时的A值均低于si-Con组和空白组(P<0.05),说明在抑制了HULC的表达后,TPC-1细胞的增殖活性明显降低,提示HULC可能参与了TPC-1细胞的增殖过程。苏文等[15]的研究结果显示,HULC可增强口腔鳞癌细胞的侵袭能力。本研究结果显示,si-HULC组侵袭细胞数低于si-Con组和空白组(P<0.05),说明抑制HULC的表达后,TPC-1细胞的侵袭能力被抑制,提示HULC可能参与了肿瘤细胞侵袭过程。
综上所述,PTC组织中HULC表达量升高,且与肿瘤大小、TNM分期和淋巴结转移有关。干扰HULC表达后可抑制TPC-1细胞的增殖活性和侵袭能力。因此,HULC有望为PTC机制研究及治疗靶点选择提供新的目标基因,但其具体作用机制有待进一步研究。
